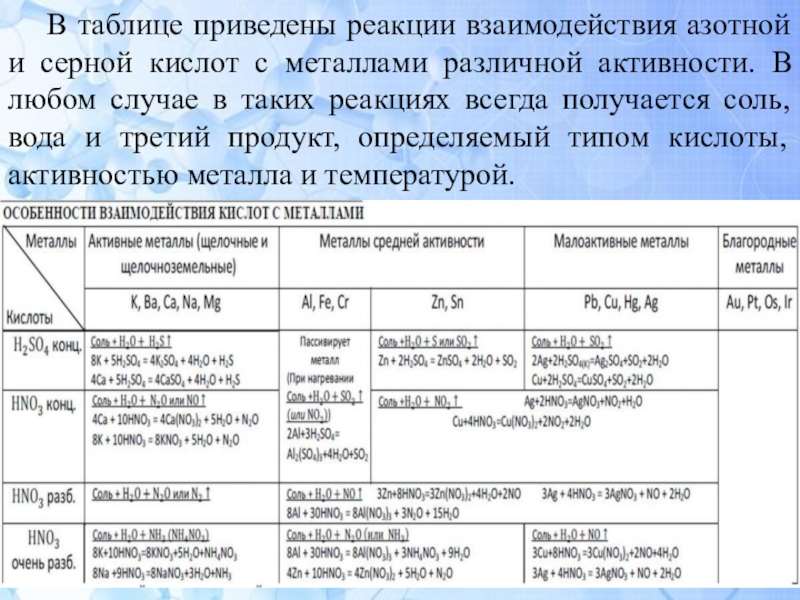
которых проявляются за счет аниона элемента в низшей степени окисления.
Это все галогеноводородные кислоты (кроме плавиковой), сероводородная кислота и т.п.4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
14HBr + K2Cr2O7= 3Br2 + 2CrBr3 + 2KBr + 7H2O
6HI + 2KMnO4= 2MnO2 + 2KOH + 3I2 + 2H2O