Слайд 1
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Структурная изомерия, ее
виды.
Пространственная изомерия, ее виды. Энантиомерия. σ-Диастереомерия.
π-Диастереомерия. Конформационная изомерия.
Составитель: доктор биологических наук, профессор, зав. кафедрой химии Ирина Петровна Степанова
Слайд 2 ЦЕЛИ ЛЕКЦИИ
ОБУЧАЮЩАЯ: сформировать знания о видах
изомерииорганических соединений.
РАЗВИВАЮЩАЯ: расширить кругозор обучающихся на основе интеграции
знаний, развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию у обучающихся устойчивого интереса к изучению дисциплины.
Слайд 3 Для биоорганической и биологической химии изомерия является причиной разной биологической
активности. То есть только определенные изомеры проявляют биологическую активность, которая
может исчезнуть в процессе изомеризации, что вызывает патологические изменения в организме человека.
Медико-биологическое значение темы
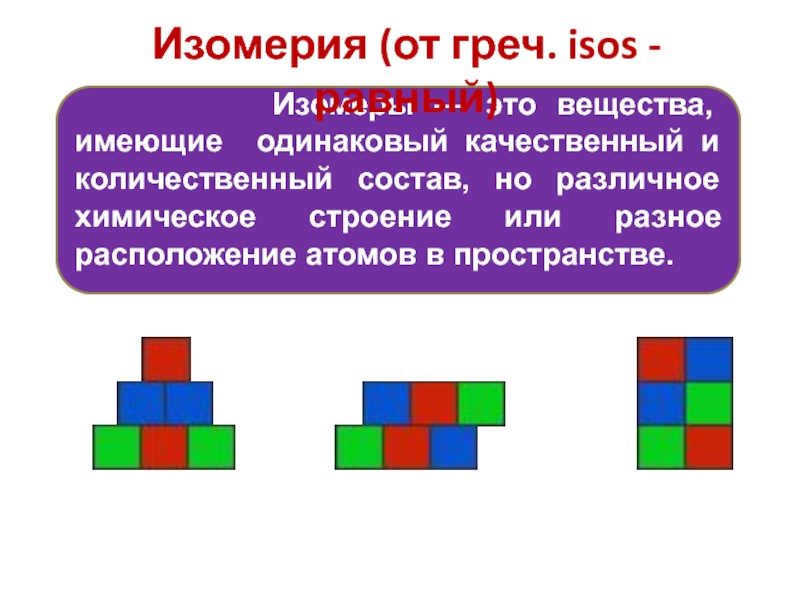
— это вещества, имеющие одинаковый качественный и количественный состав, но
различное химическое строение или разное расположение атомов в пространстве.
Изомерия (от греч. isos - равный)
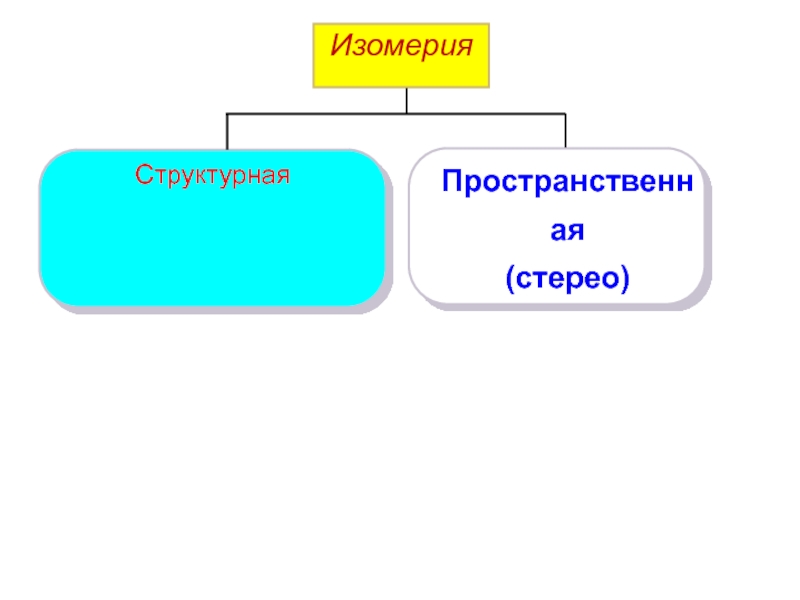
Слайд 5Изомерия
Пространственная
(стерео)
Структурная
Слайд 6Структурная изомерия
Структурные изомеры отличаются друг от друга химическим
строением и, следовательно, обладают разными химическими свойствами.
Слайд 7Структурная изомерия
Различают виды структурной изомерии:
Изомерия углеродного скелета
Изомерия положения кратной
связи
Изомерия положения функциональных групп
Изомерия функциональной принадлежности
(межклассовая изомерия)
Валентная
изомерия
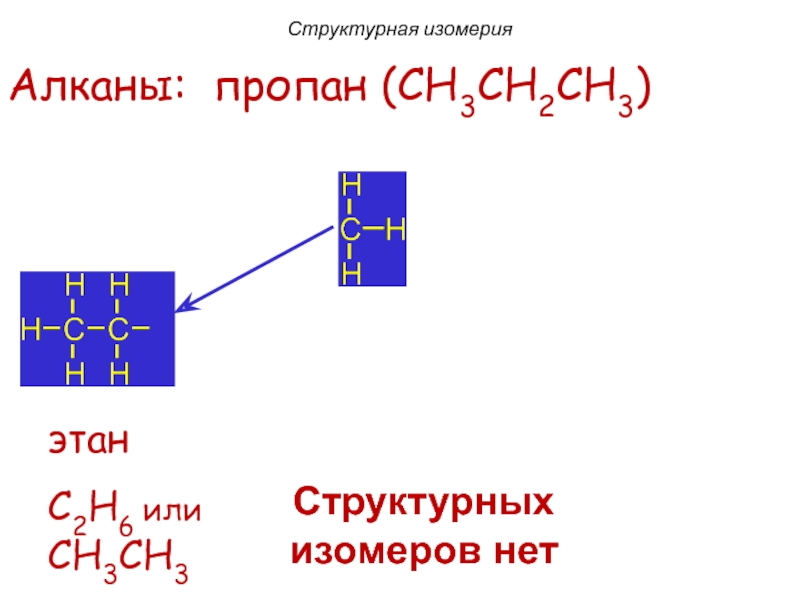
Слайд 8этан
C2H6 или
CH3CH3
Алканы: пропан (CH3CH2CH3)
Структурных изомеров нет
Структурная изомерия
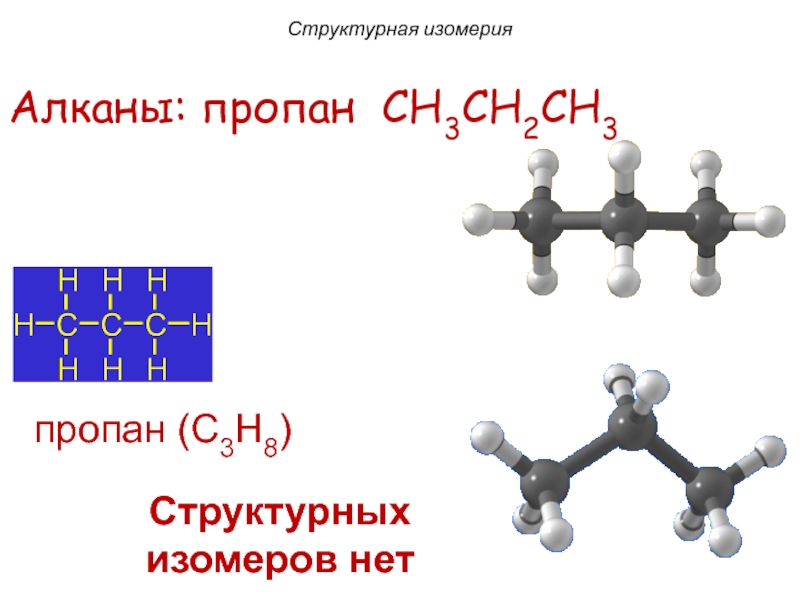
Слайд 9пропан (C3H8)
Алканы: пропан CH3CH2CH3
Структурных изомеров нет
Структурная изомерия
Слайд 10пропан (C3H8)
Алканы: CH3CH2CH3
Структурных изомеров нет
Структурная изомерия
Слайд 11пропан (C3H8)
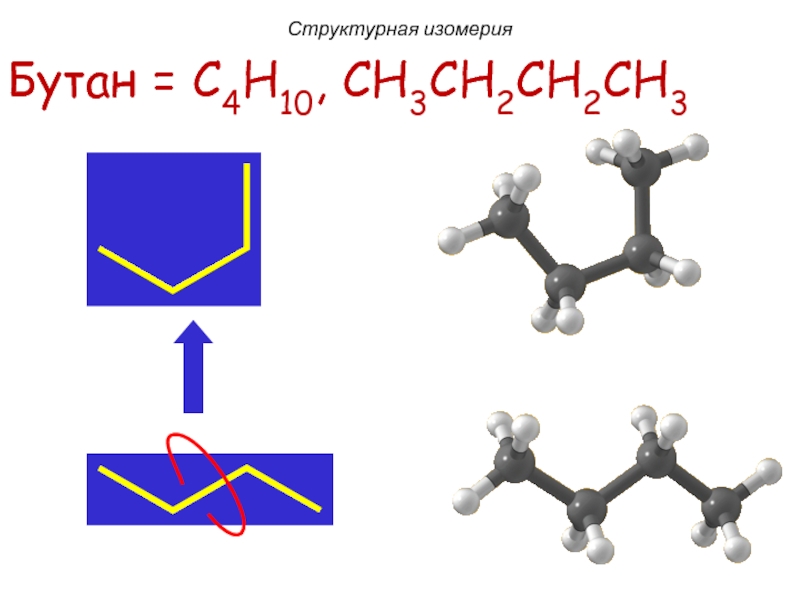
Бутан = C4H10, CH3CH2CH2CH3
Структурная изомерия
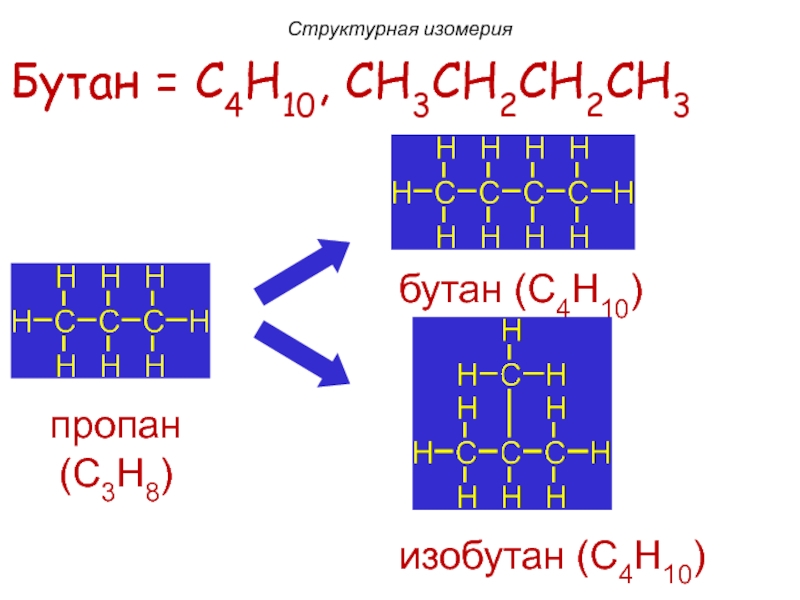
Слайд 12Бутан = C4H10, CH3CH2CH2CH3
изобутан (C4H10)
Структурная изомерия
Слайд 13Бутан = C4H10, CH3CH2CH2CH3
Структурная изомерия
Слайд 14Бутан = C4H10, CH3CH2CH2CH3
Структурная изомерия
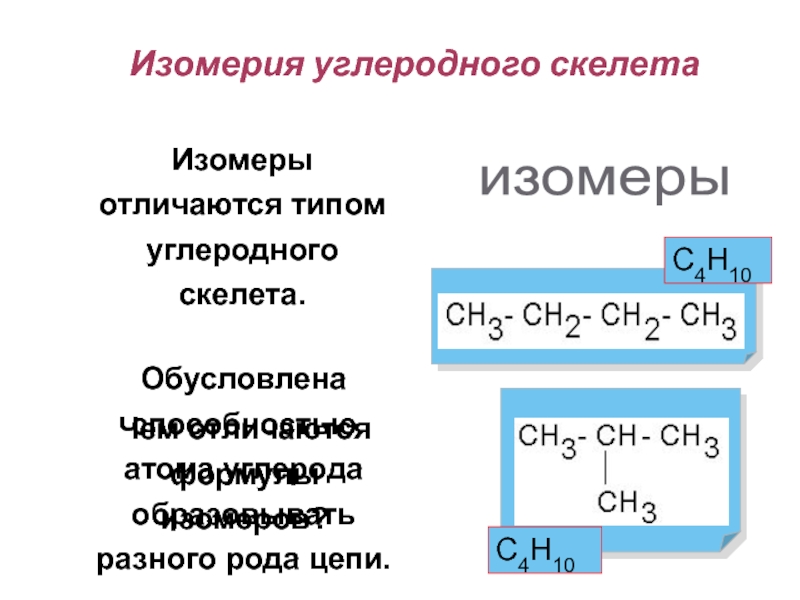
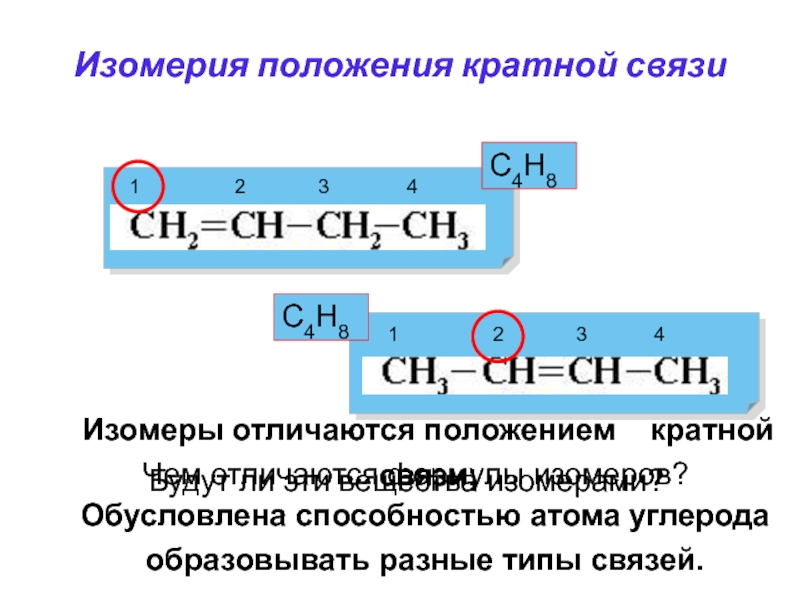
Слайд 15Обусловлена способностью атома углерода образовывать разного рода цепи.
Чем отличаются формулы
изомеров?
Изомерия углеродного скелета
Изомеры отличаются типом углеродного скелета.
изомеры
С4Н10
С4Н10
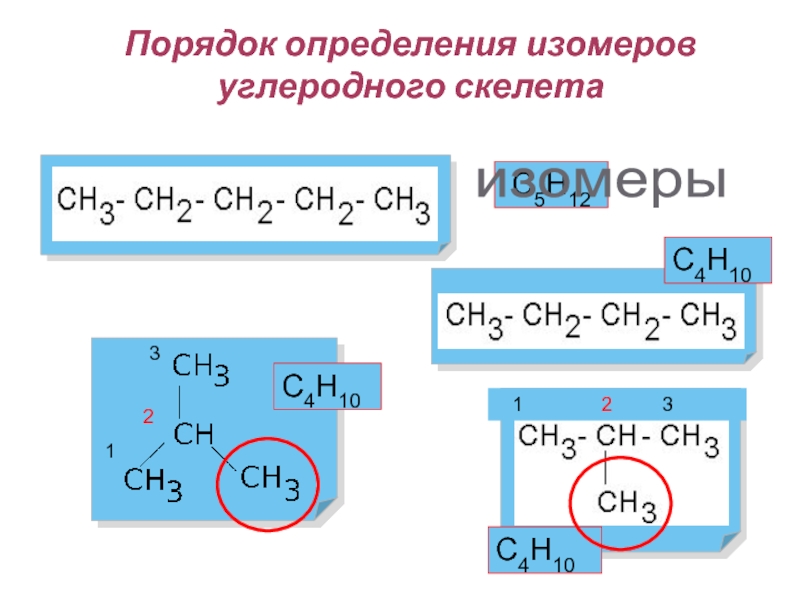
Слайд 16Порядок определения изомеров углеродного скелета
1
2 3
1
2
3
С5Н12
С4Н10
С4Н10
С4Н10
изомеры
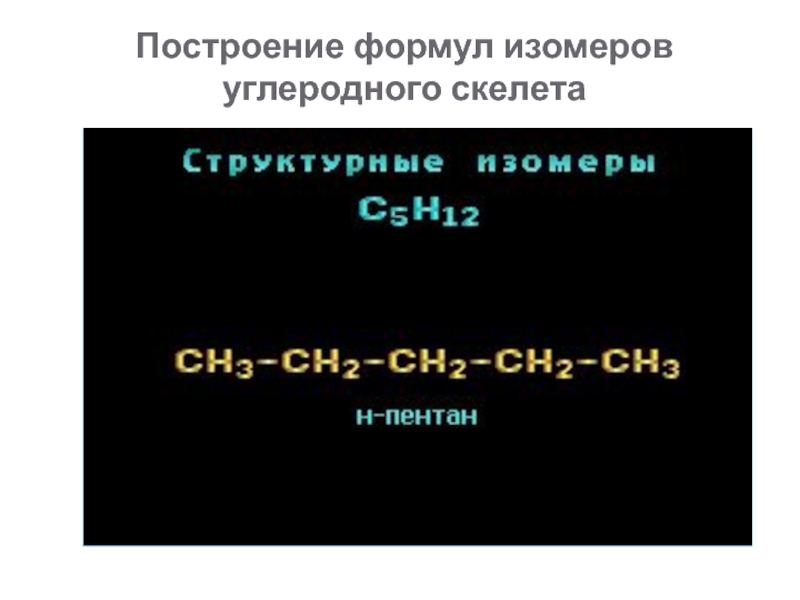
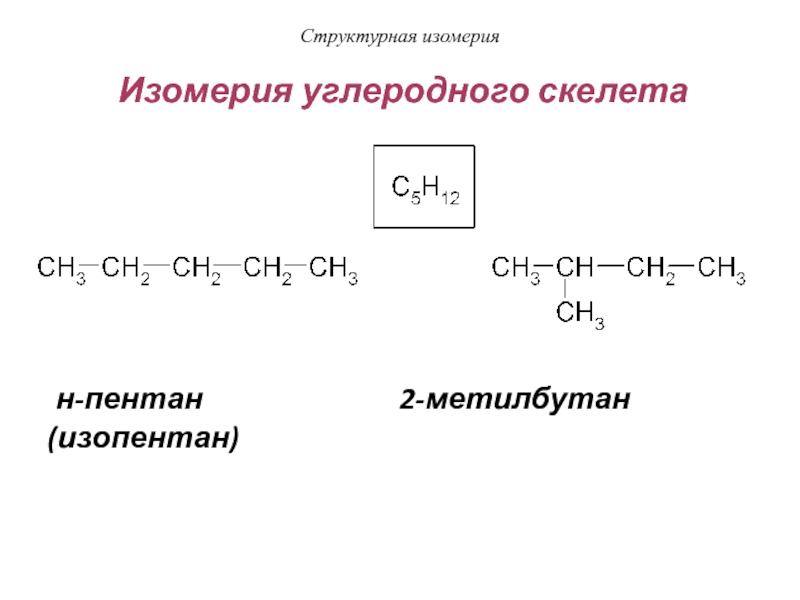
Слайд 17Построение формул изомеров углеродного скелета
Слайд 18Структурная изомерия
Изомерия углеродного скелета
н-пентан
2-метилбутан (изопентан)
Слайд 19Обусловлена способностью атома углерода образовывать разные типы связей.
Изомерия положения кратной
связи
С4Н8
С4Н8
Будут ли эти вещества изомерами?
1
2 3 4
1 2 3 4
Чем отличаются формулы изомеров?
Изомеры отличаются положением кратной связи;
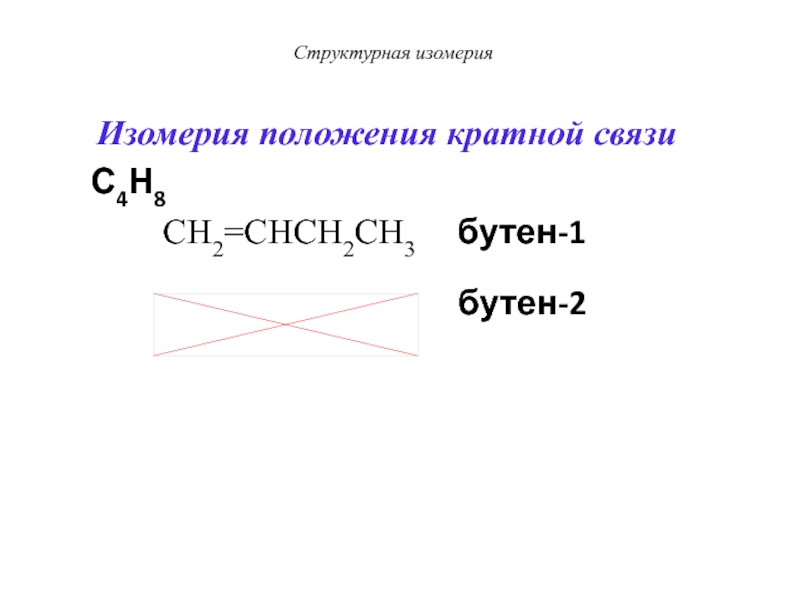
Слайд 20Структурная изомерия
Изомерия положения кратной связи
С4Н8
CH2=CHCH2CH3
бутен-1
бутен-2
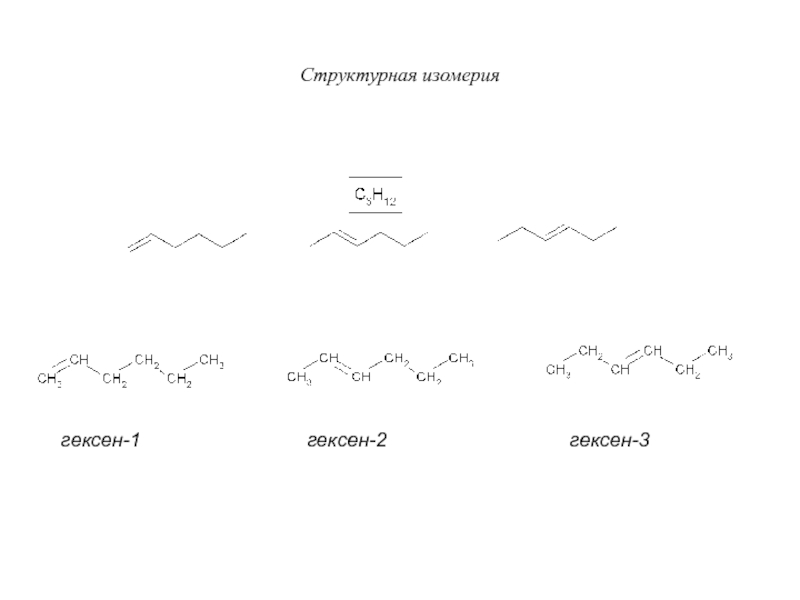
Слайд 21Структурная изомерия
гексен-1
гексен-2
гексен-3
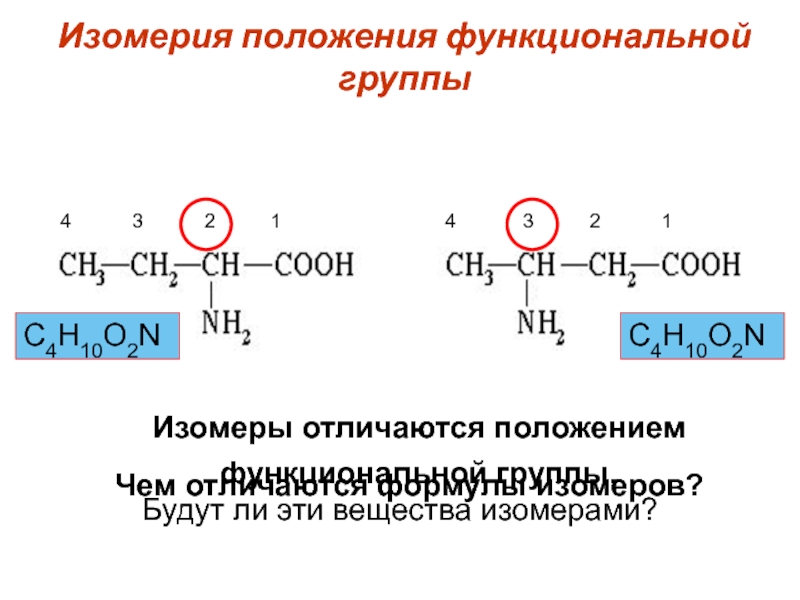
Слайд 22Изомерия положения функциональной группы
Будут ли эти вещества изомерами?
Чем отличаются формулы
изомеров?
Изомеры отличаются положением функциональной группы.
С4Н10О2N
С4Н10О2N
4
3 2 1
4 3 2 1
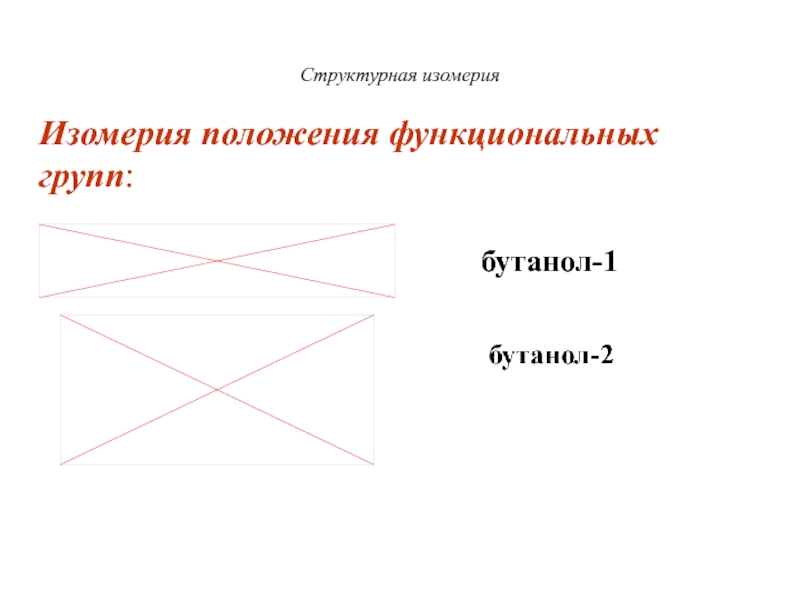
Слайд 23Структурная изомерия
Изомерия положения функциональных групп:
бутанол-1
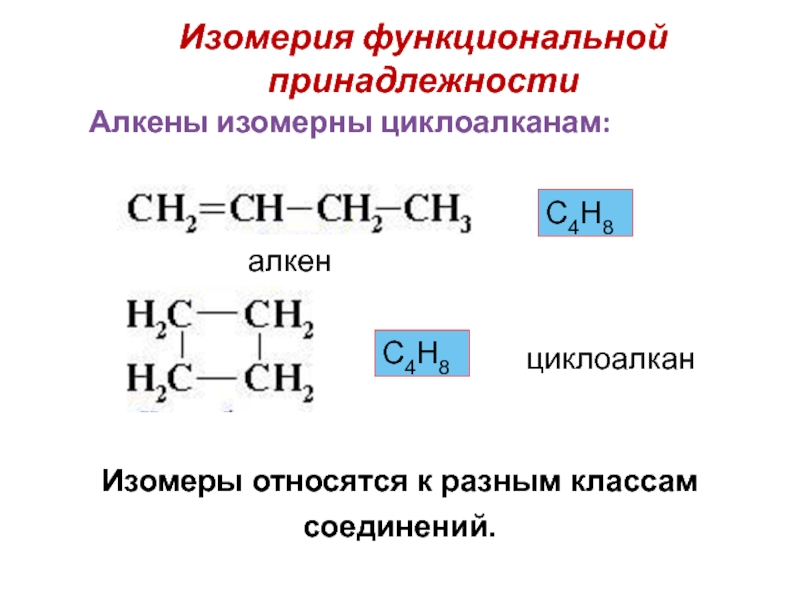
Слайд 24Изомерия функциональной принадлежности
Изомеры относятся к разным классам соединений.
С4Н8
С4Н8
алкен
циклоалкан
Алкены изомерны циклоалканам:
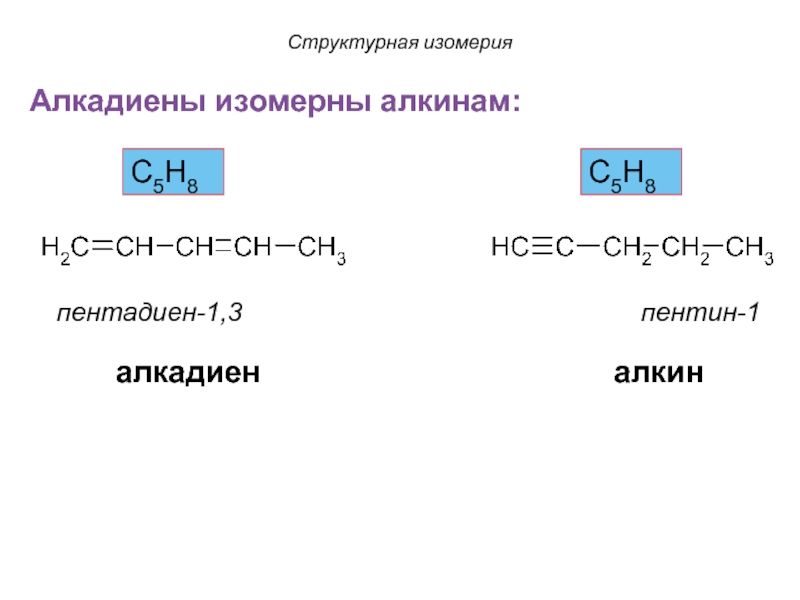
Слайд 25Алкадиены изомерны алкинам:
пентадиен-1,3
пентин-1
С5Н8
С5Н8
алкадиен алкин
Структурная изомерия
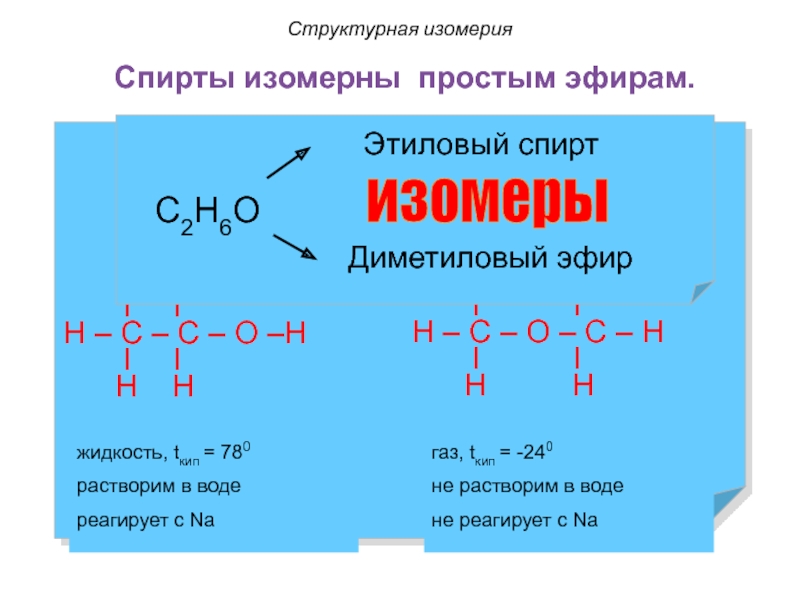
Слайд 26Спирты изомерны простым эфирам.
Структурная изомерия
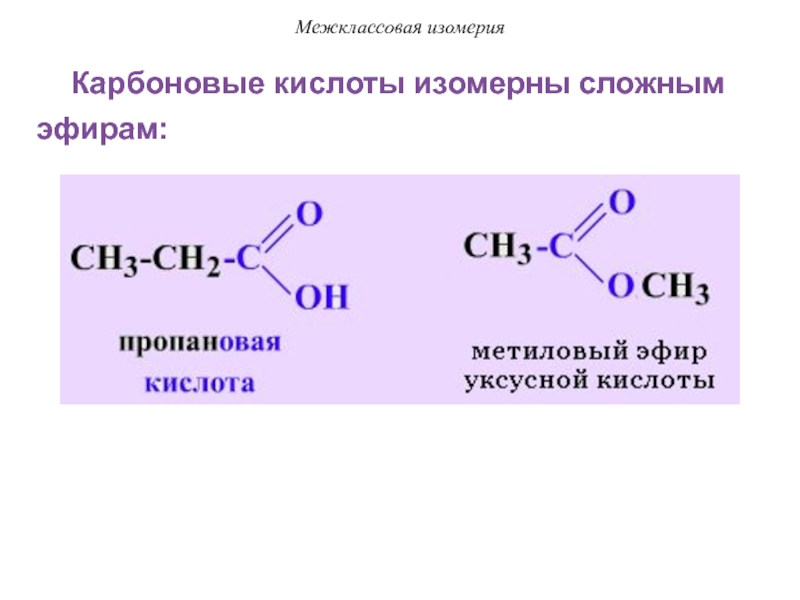
Слайд 27Межклассовая изомерия
Карбоновые кислоты изомерны сложным эфирам:
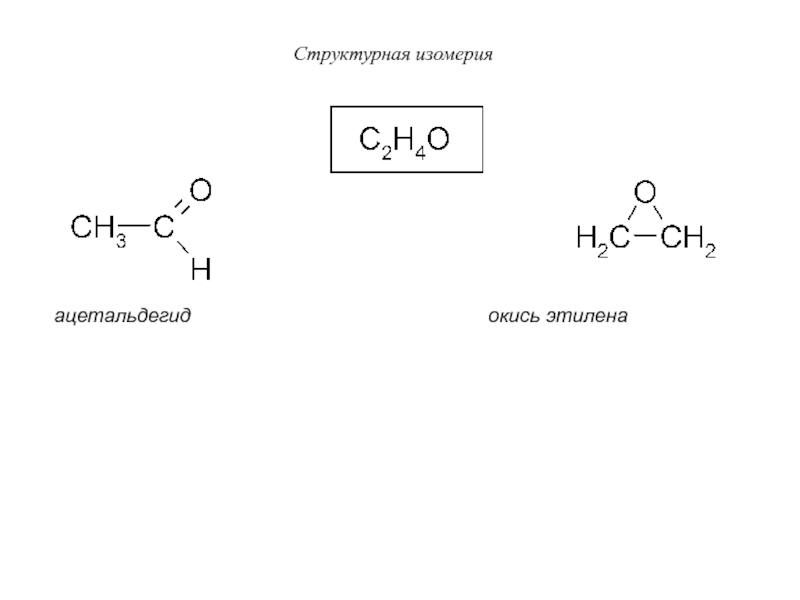
Слайд 28Структурная изомерия
ацетальдегид
окись этилена
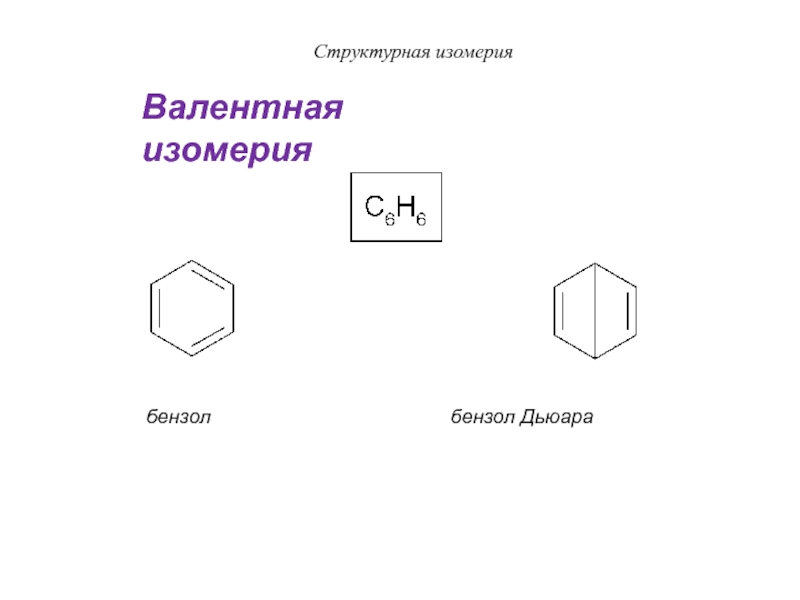
Слайд 29Структурная изомерия
бензол
бензол Дьюара
Валентная изомерия
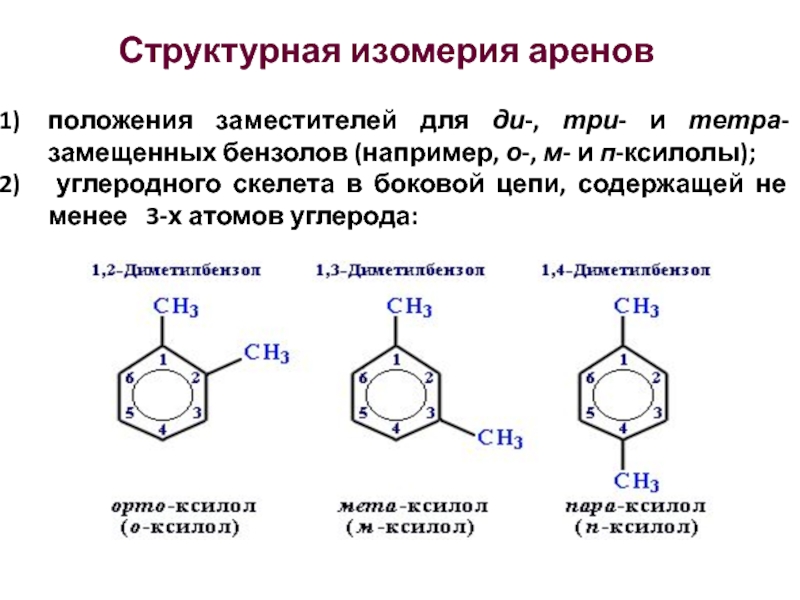
Слайд 30Структурная изомерия аренов
положения заместителей для ди-, три- и тетра-замещенных бензолов
(например, о-, м- и п-ксилолы);
углеродного скелета в боковой
цепи, содержащей не менее 3-х атомов углерода:
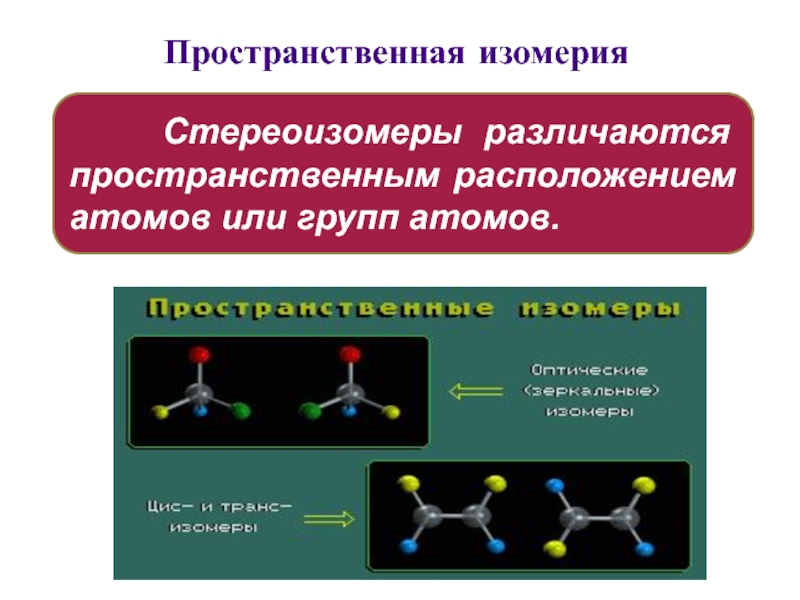
Слайд 31Пространственная изомерия
Стереоизомеры различаются пространственным расположением атомов или
групп атомов.
Слайд 32 Различают виды стереоизомерии:
энантиомерия
σ-диастереомерия
π-диастереомерия (геометрическая)
конформационная изомерия
Пространственная изомерия
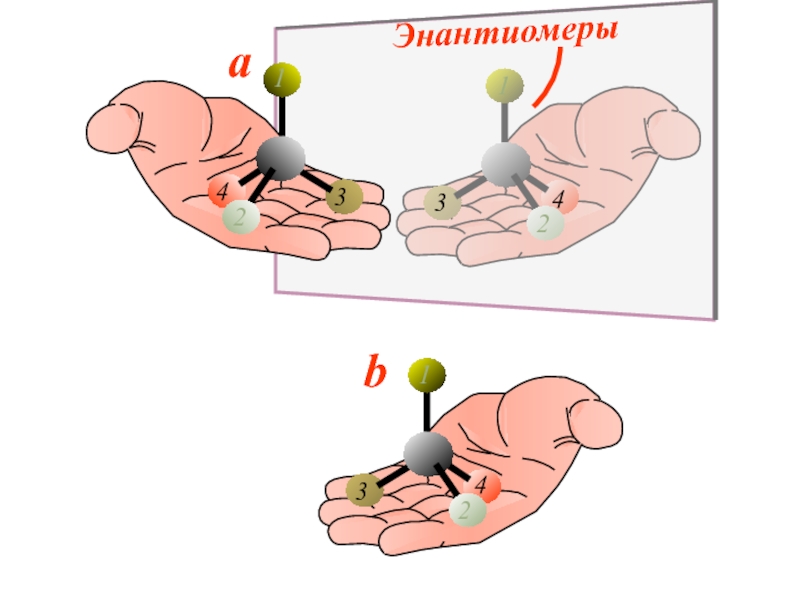
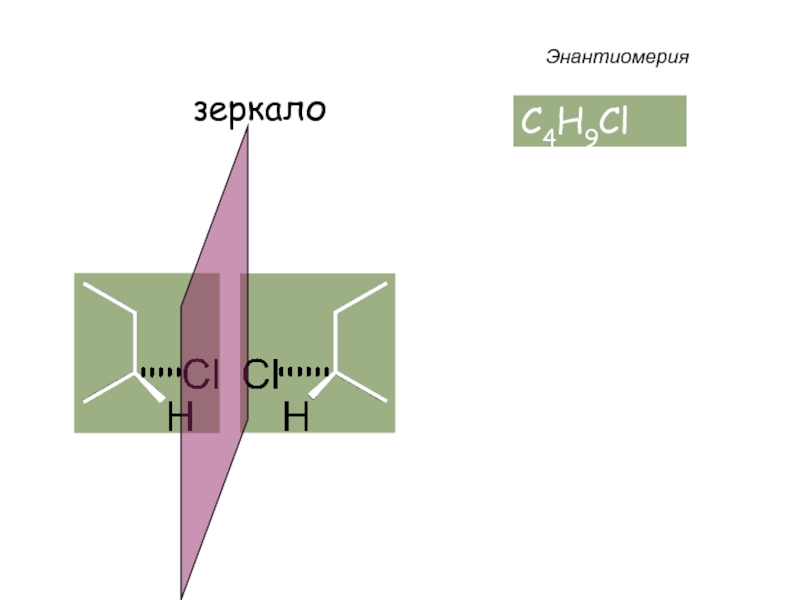
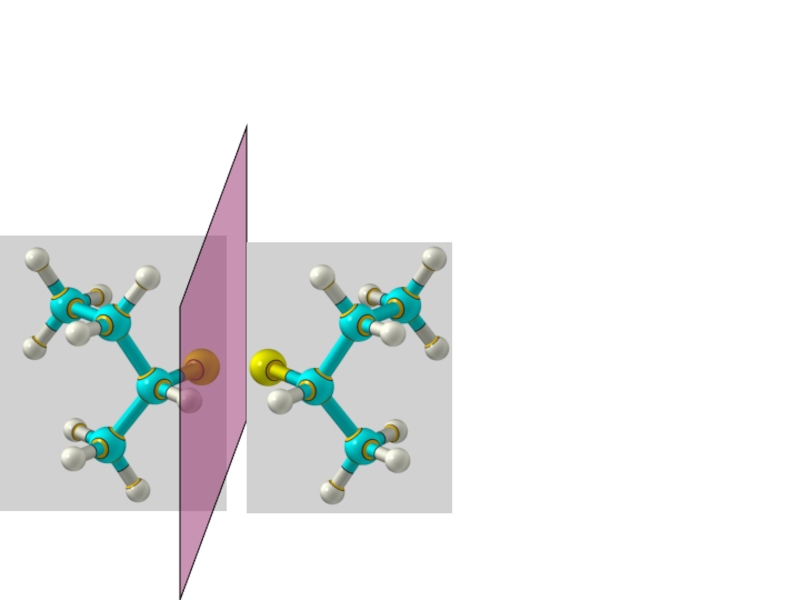
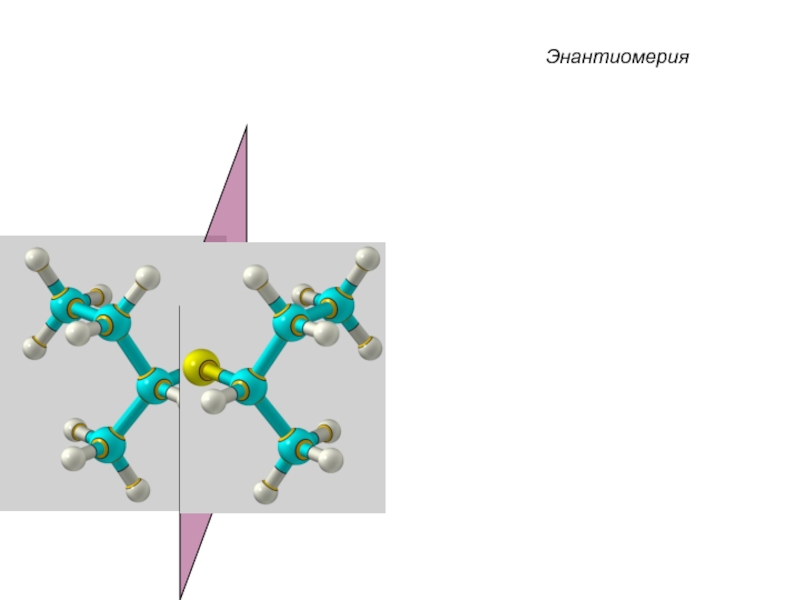
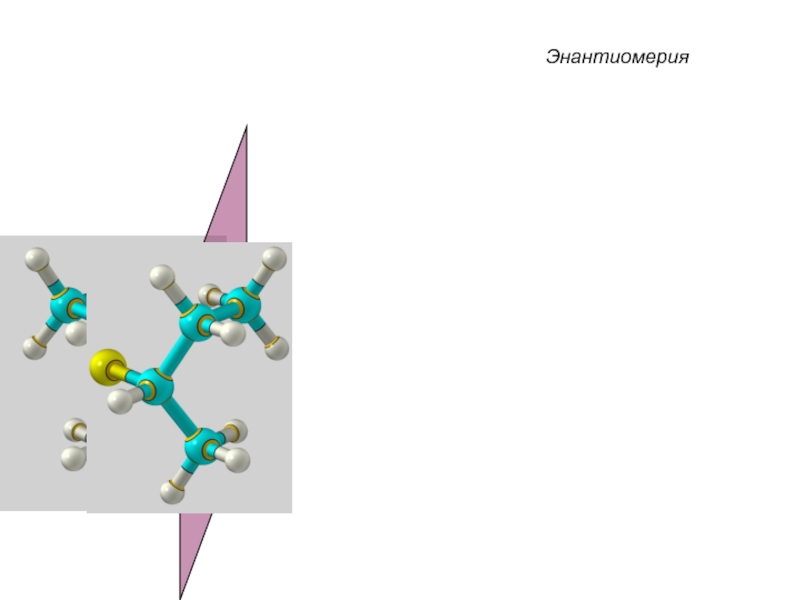
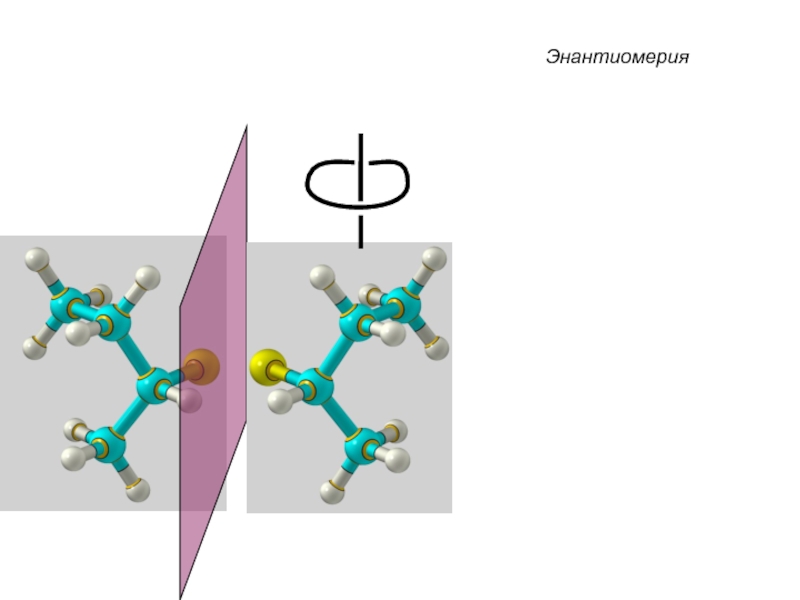
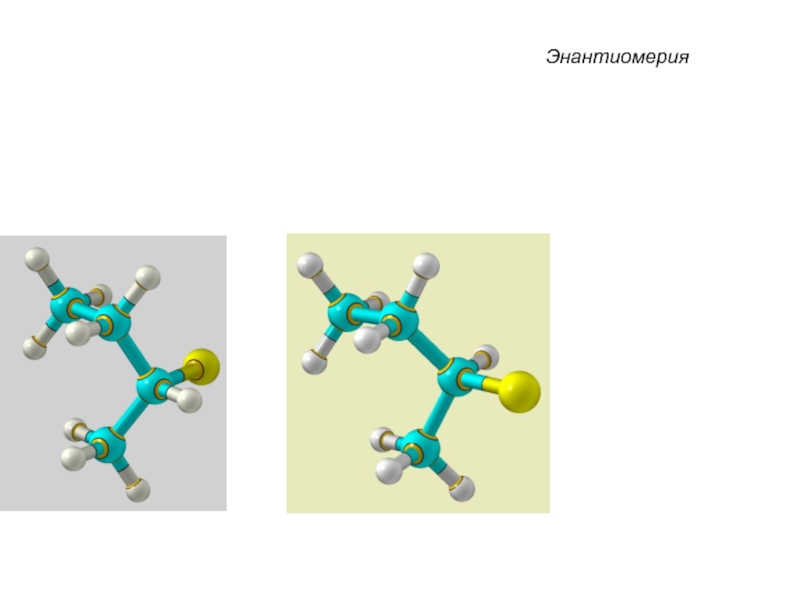
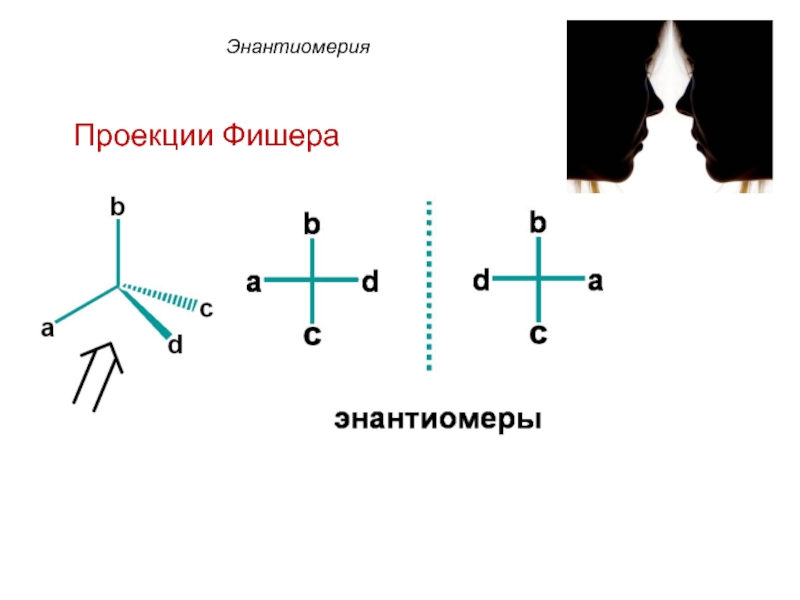
Слайд 33 Энантиомеры – это изомеры, которые относятся друг к другу
как предмет и несовместимое с ним в пространстве зеркальное отражение.
Энантиомеры - близнецы органического мира.
Энантиомерия
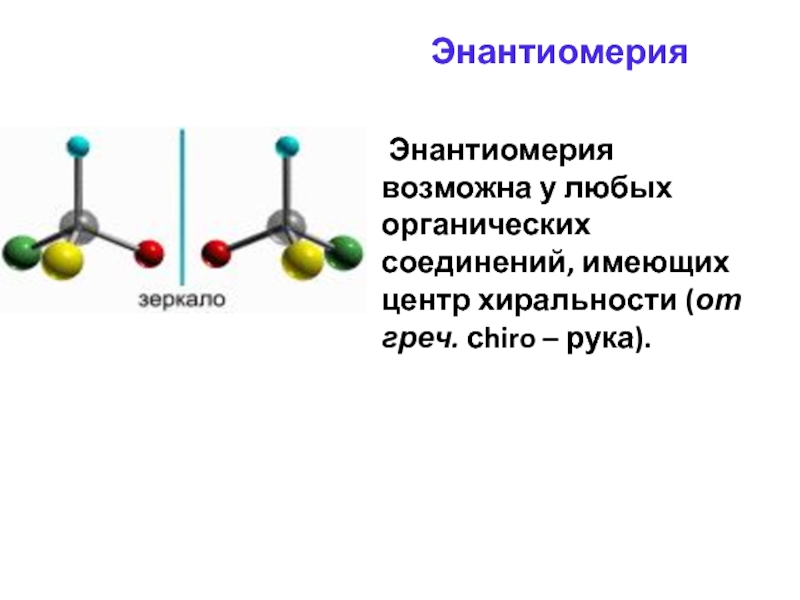
Слайд 35Энантиомерия
Энантиомерия возможна у любых органических соединений, имеющих центр хиральности
(от греч. сhiro – рука).
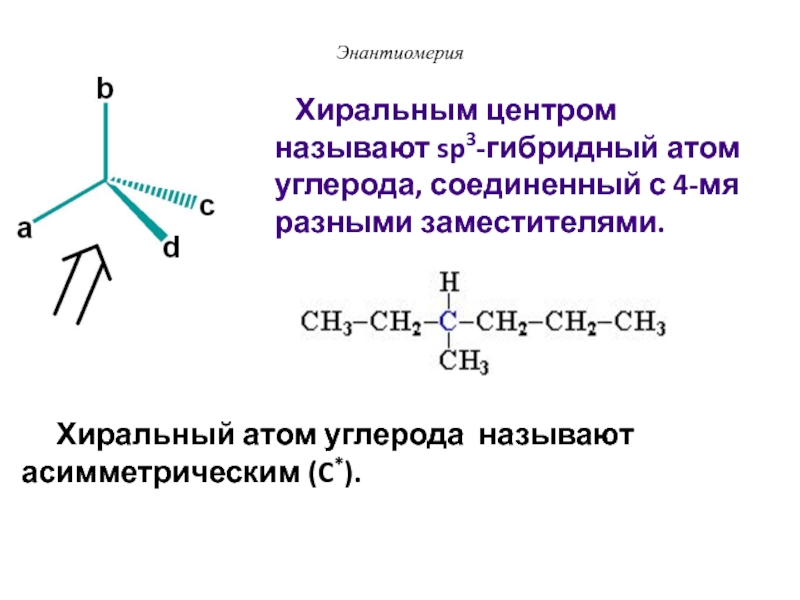
Слайд 36Энантиомерия
Хиральный атом углерода называют асимметрическим (C*).
Хиральным центром называют sp3-гибридный атом углерода, соединенный с 4-мя разными
заместителями.
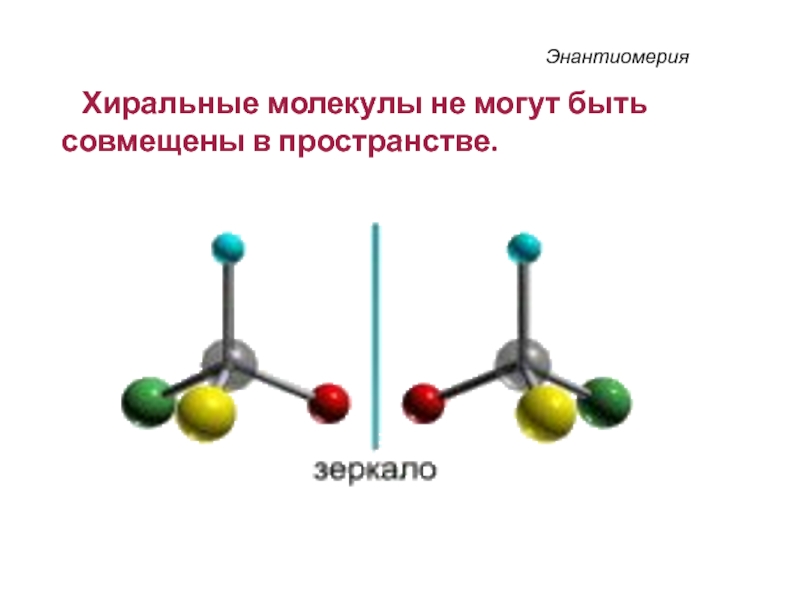
Слайд 37Энантиомерия
Хиральные молекулы не могут быть совмещены в пространстве.
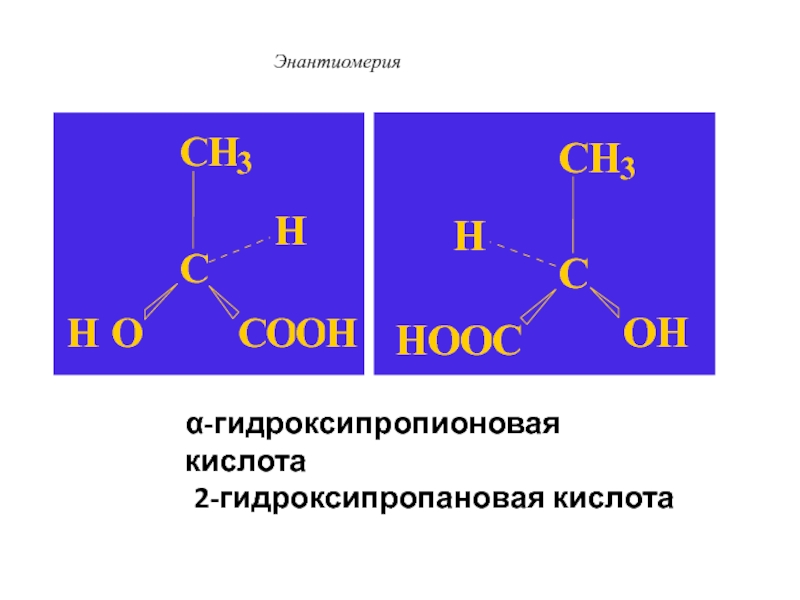
Слайд 44 Пример: хиральная молекула
2-гидроксипропановая кислота
СН3-СН(ОН)-СООН
Для изображения энантиомеров
на плоскости используют проекционные формулы Фишера.
Энантиомерия
Слайд 46Энантиомерия
α-гидроксипропионовая кислота
2-гидроксипропановая кислота
Слайд 47Энантиомерия
α-гидроксипропионовая кислота
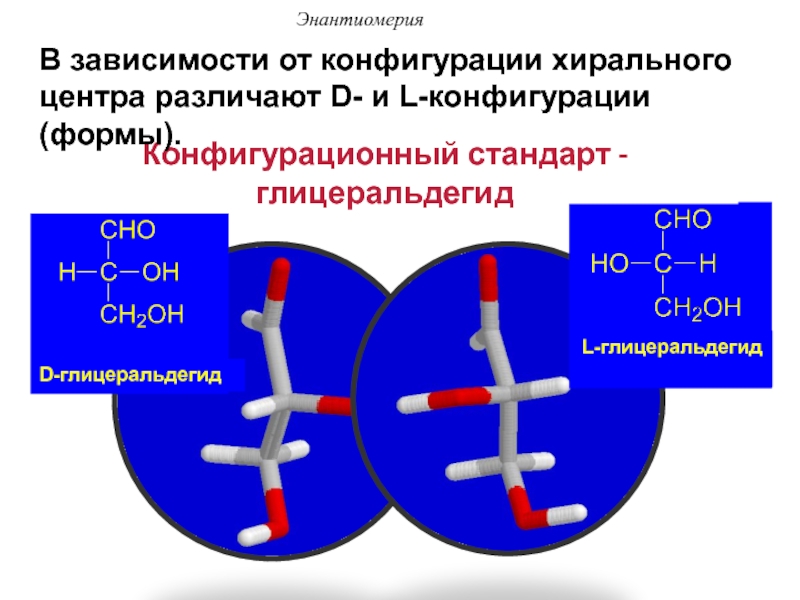
Слайд 48Конфигурационный стандарт - глицеральдегид
D-глицеральдегид
L-глицеральдегид
В зависимости от конфигурации хирального центра различают
D- и L-конфигурации (формы).
Энантиомерия
Слайд 49Энантиомерия
Сравнение конфигурации исследуемого соединения с глицериновым альдегидом производят
путем серии химических превращений, не затрагивающих центр хиральности.
В
D-форме функциональная группа (-ОН) хирального центра располагается справа от углеродной цепи, в L-форме – слева.
D- и L- – это относительная конфигурация.
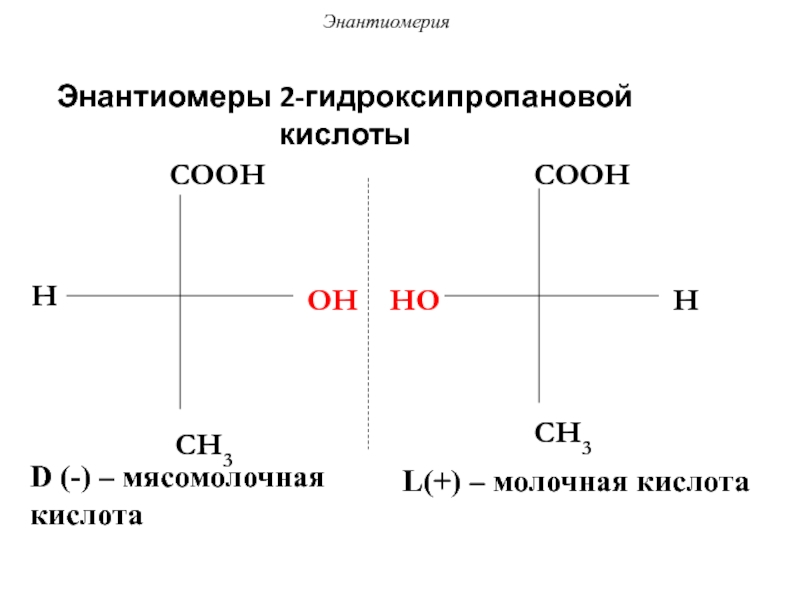
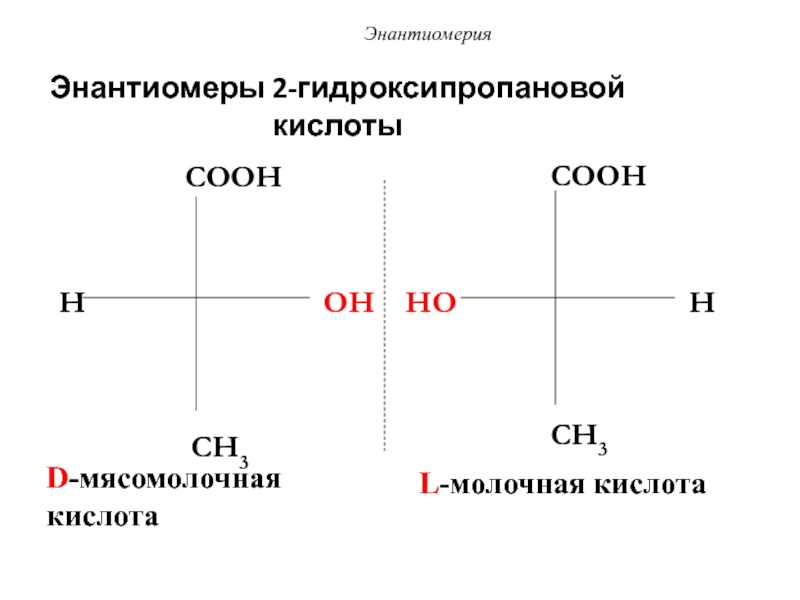
Слайд 50Энантиомеры 2-гидроксипропановой кислоты
H
COOH
OH
CH3
HO
COOH
H
CH3
D-мясомолочная кислота
L-молочная кислота
Энантиомерия
Слайд 51Энантиомерия
Энантиомеры обладают оптической активностью. Они способны вращать плоскость
поляризации света.
Оптическая активность энантиомеров исследуется с помощью
прибора – поляриметра, в котором луч света, пройдя через специальную призму Николя колеблется только в одной плоскости, т,е. становится плоскополяризованным.
Слайд 52ячейка
Поляриметр
Угол вращения плоскости поляризованного света определяется с помощью поляриметра.
[a] - удельное вращение
Энантиомерия
25°C
D
Слайд 53Энантиомерия
Энантиомеры способны отклонять поляризованный луч либо влево,
либо вправо, т.е. они являются оптическими антиподами.
У
энантиомеров угол вращения плоскости поляризации света одинаковый, но направление вращения противоположное.
Один энантиомер – левовращающий,знак (-), а другой правовращающий, знак (+).
Знак вращения плоскости поляризации света не связан с принадлежностью к D- или L-ряду. Он определяется экспериментально.
Слайд 54Энантиомерия
У 2-гидроксипропановой кислоты
D-изомер является левовращающим (-):
D (-); = -2,6
L-изомер является правовращающим(+):
L (+); = +2,6
Смесь энантиомеров называется рацематом. Рацемат не обладает оптической активностью.
Слайд 55Энантиомеры 2-гидроксипропановой кислоты
H
COOH
OH
CH3
HO
COOH
H
CH3
D (-) – мясомолочная кислота
L(+) – молочная кислота
Энантиомерия
Слайд 56Энантиомерия
Энантиомеры обладают одинаковыми физическими и химическими свойствами,
но являются оптическими антиподами, т.е. имеют противоположную оптическую активность и
имеют различную физиологическую активность.
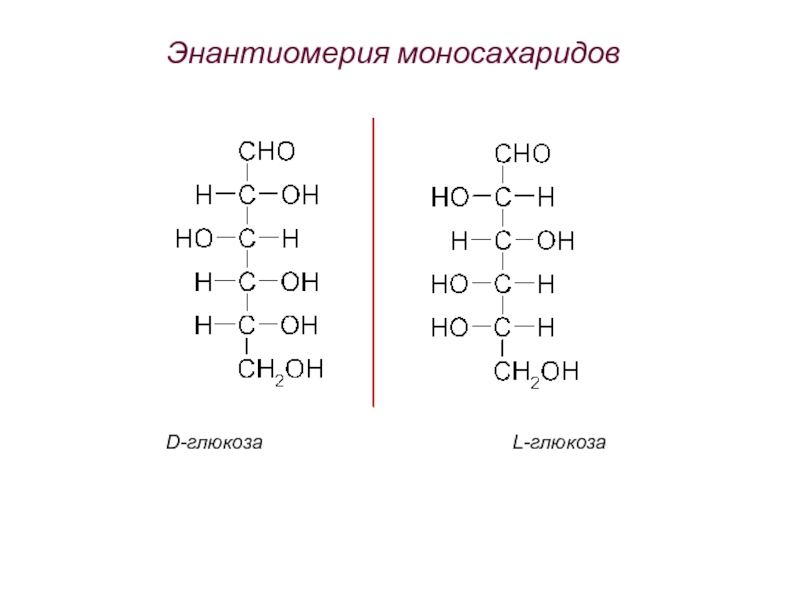
Биологически активными являются D-энантимеры моносахаридов, L-энантиомеры аминокислот.
Слайд 57Энантиомерия моносахаридов
D-глюкоза
L-глюкоза
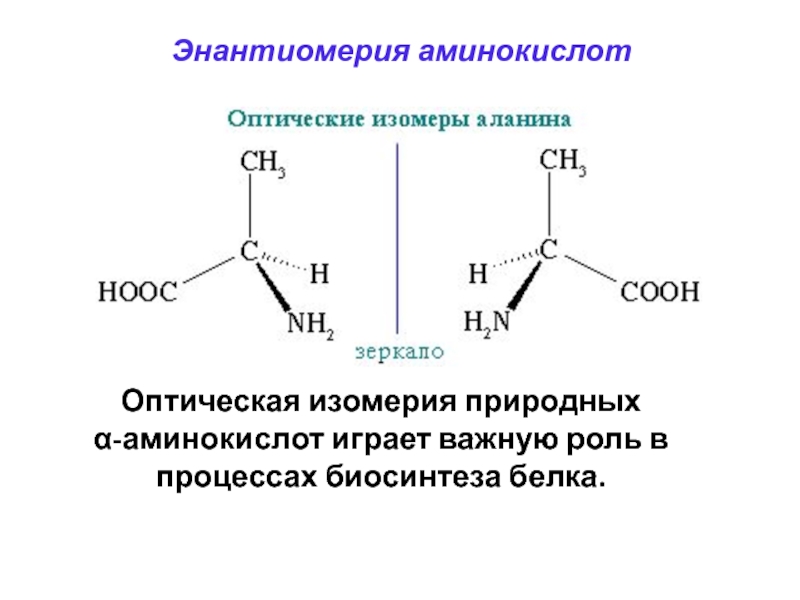
Слайд 58Энантиомерия аминокислот
Оптическая изомерия природных
α-аминокислот играет важную роль
в процессах биосинтеза белка.
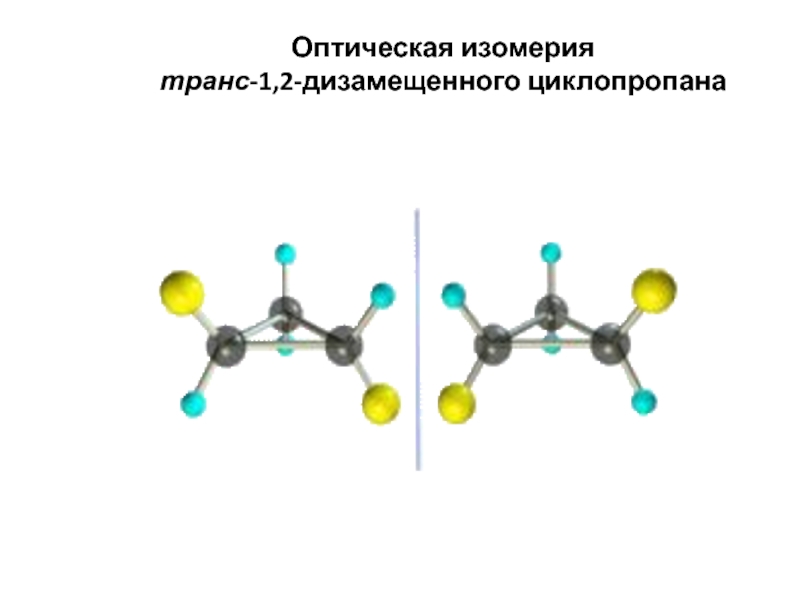
Слайд 59
Оптическая изомерия
транс-1,2-дизамещенного циклопропана
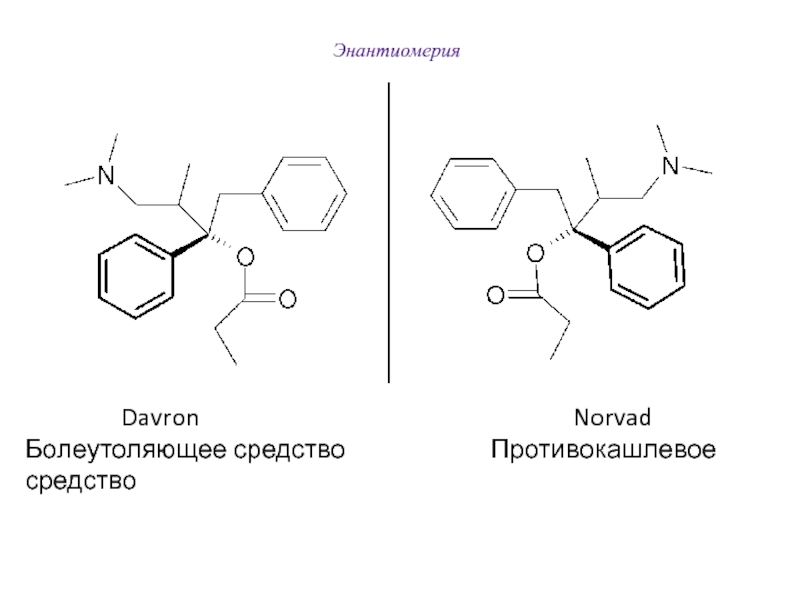
Слайд 60Энантиомерия
Davron
Norvad
Болеутоляющее средство Противокашлевое средство
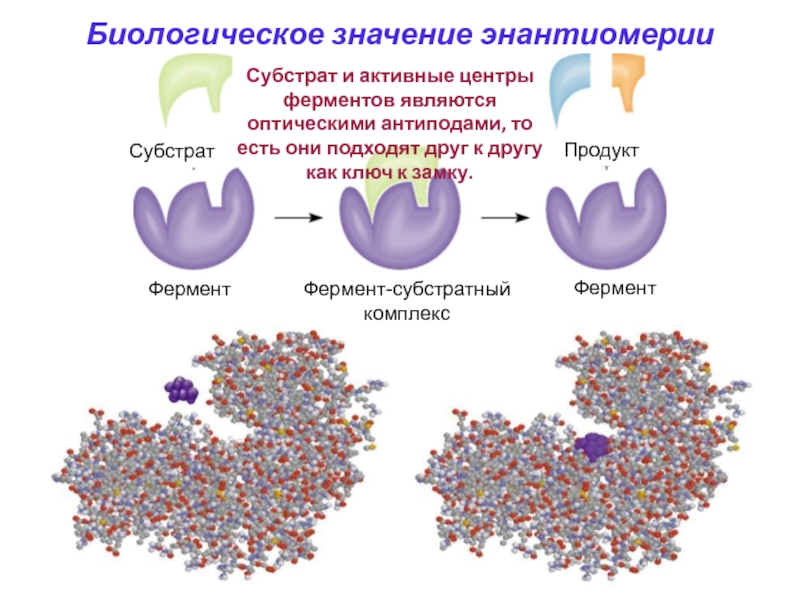
Слайд 61Субстрат и активные центры ферментов являются оптическими антиподами, то есть
они подходят друг к другу как ключ к замку.
Биологическое значение
энантиомерии
Субстрат
Фермент
Фермент-субстратный
комплекс
Фермент
Продукт
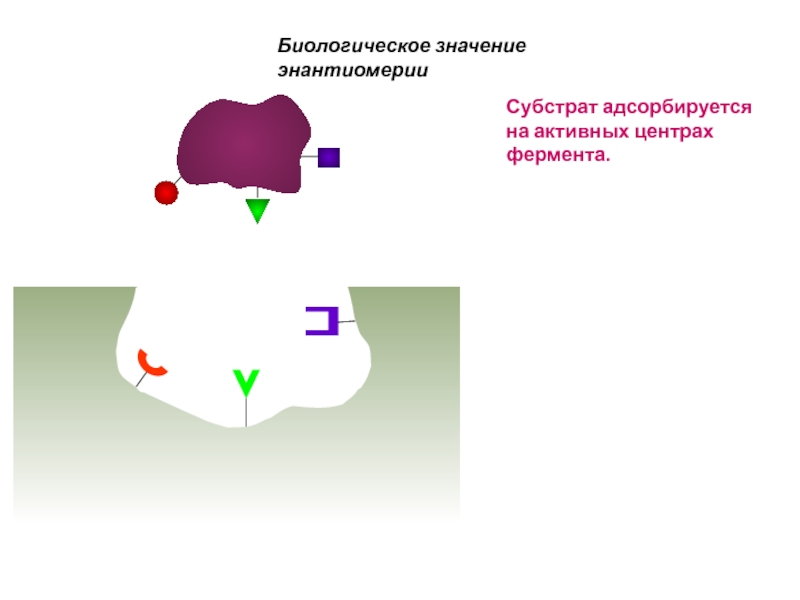
Слайд 62Биологическое значение энантиомерии
Субстрат адсорбируется на активных центрах фермента.
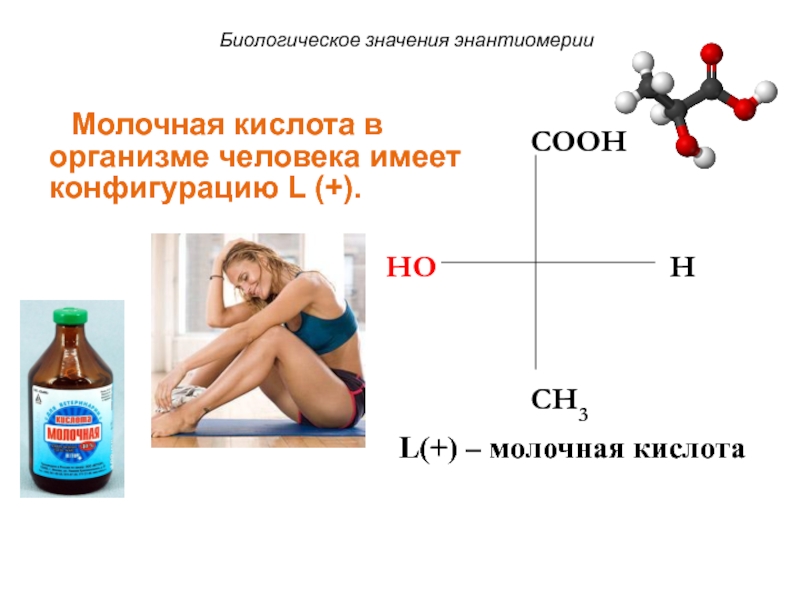
Слайд 63HO
COOH
H
CH3
L(+) – молочная кислота
Биологическое значения энантиомерии
Молочная кислота
в организме человека имеет конфигурацию L (+).
Слайд 64
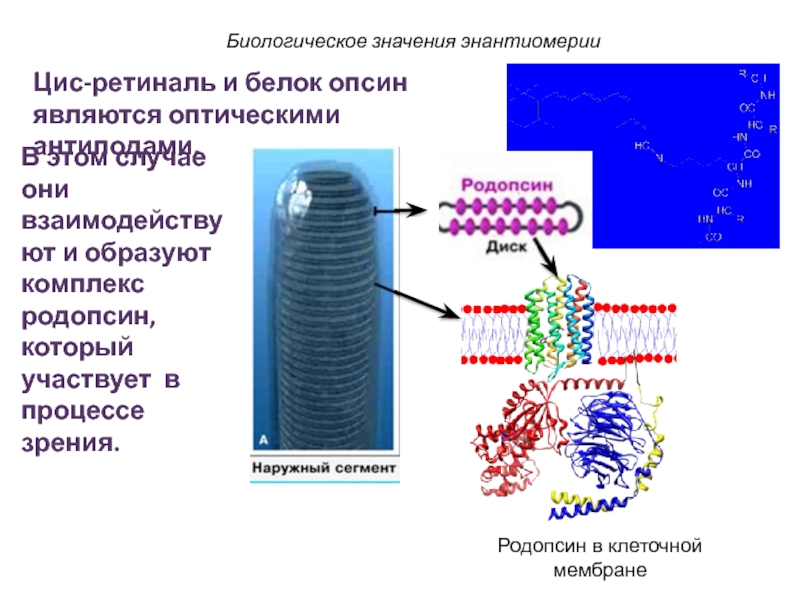
Биологическое значения энантиомерии
В этом случае они взаимодействуют и образуют
комплекс родопсин, который участвует в процессе зрения.
Цис-ретиналь и белок опсин
являются оптическими антиподами.
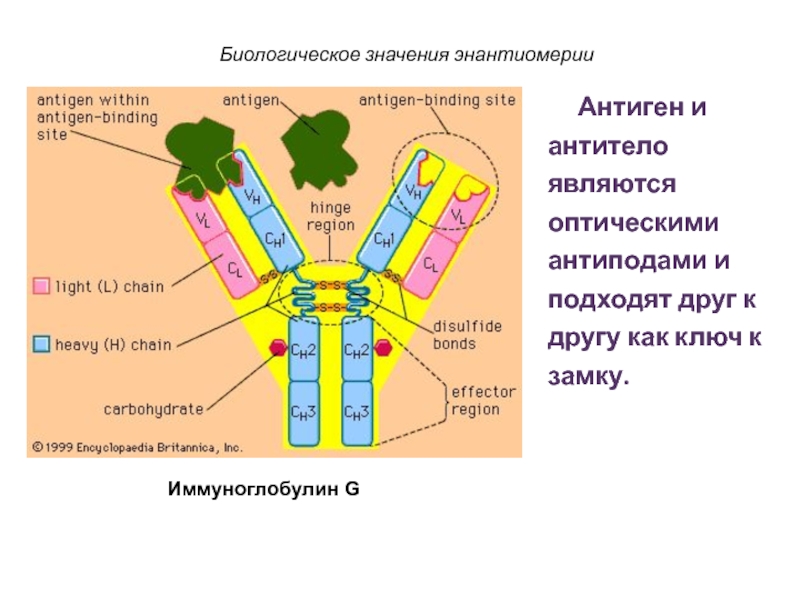
Слайд 65
Биологическое значения энантиомерии
Антиген и антитело являются
оптическими антиподами и подходят друг к другу как ключ к
замку.
Иммуноглобулин G
Слайд 66σ - Диастереомерия
σ-Диастереомерия возникает в молекулах с 2 и более
центрами хиральности.
Слайд 67 Число стереоизомеров (Z) рассчитывают по формуле Фишера:
Z =2n
,
где n-число центров хиральности.
σ - Диастереомерия
Слайд 68 D-, L-определяющим является гидроксил при нижнем асимметрическом
атоме углерода (кроме оксикислот и аминокислот).
Если заместители
находятся по одну сторону углеродной цепи, то такой изомер называется эритро-формой, по разные – трео-формой.
σ - Диастереомерия
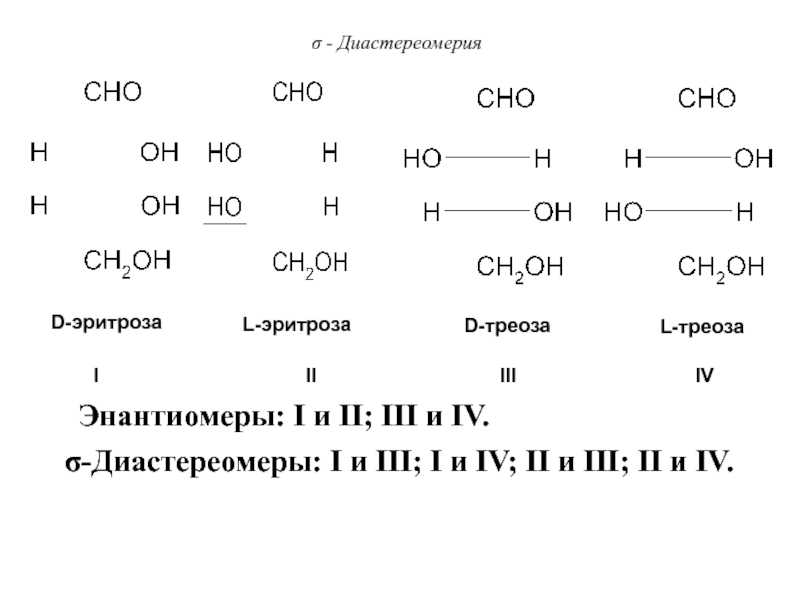
Слайд 69σ - Диастереомерия
Пример: 2,3,4 – тригидроксибутаналь
СН2(ОН)-СН(ОН)-СН(ОН)-СОН
n=2; Z = 22
=4 стереоизомера,
две пары энантиомеров.
Слайд 70σ - Диастереомерия
D-эритроза
L-эритроза
D-треоза
L-треоза
σ-Диастереомеры: I и III; I и IV; II
и III; II и IV.
I
II
III
IV
Энантиомеры: I и II; III и
IV.
Слайд 71σ - Диастереомерия
σ– Диастереомеры имеют разные физические
и химические свойства,
и физиологическое действие.
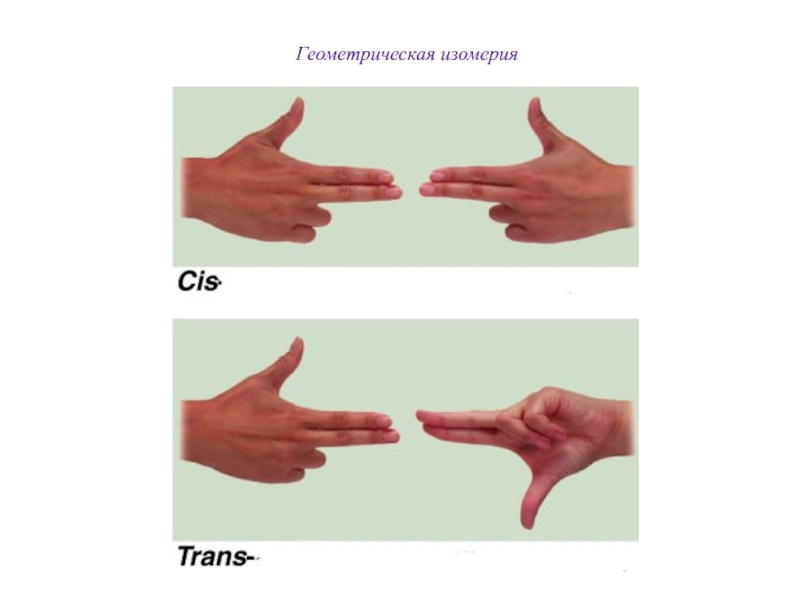
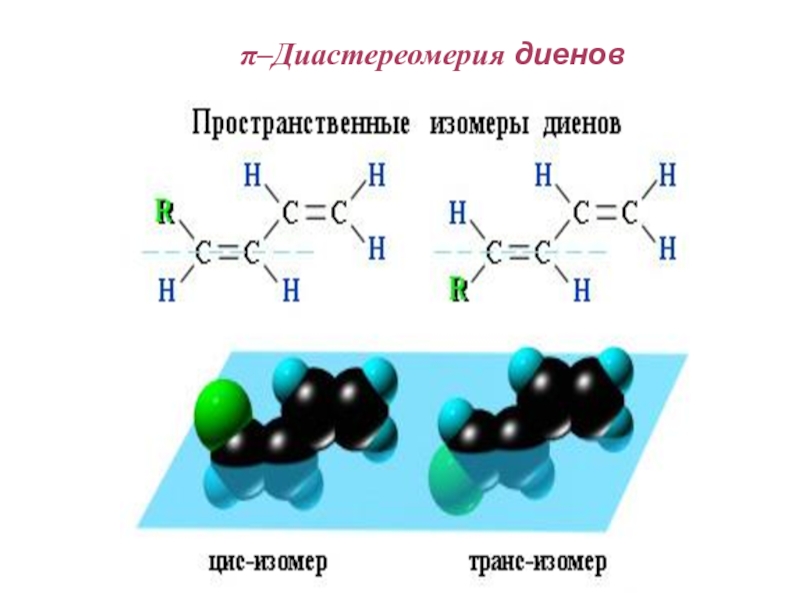
Слайд 72π - Диастереомерия
π-Диастереомеры (цис- и транс-)
- это стереоизомеры, отличающиеся друг от друга различным пространственным расположением
одинаковых заместителей относительно плоскости π-связи.
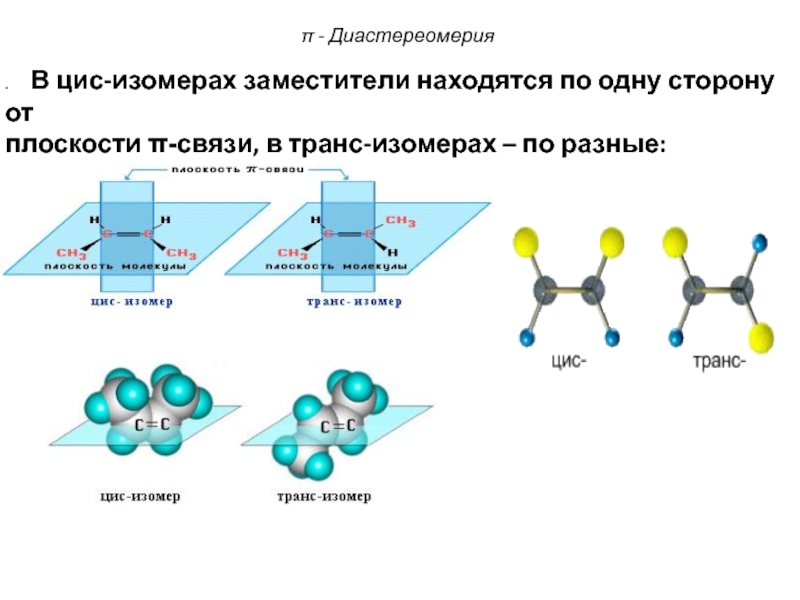
Слайд 74π - Диастереомерия
. В цис-изомерах заместители находятся по
одну сторону от
плоскости -связи, в транс-изомерах – по разные:
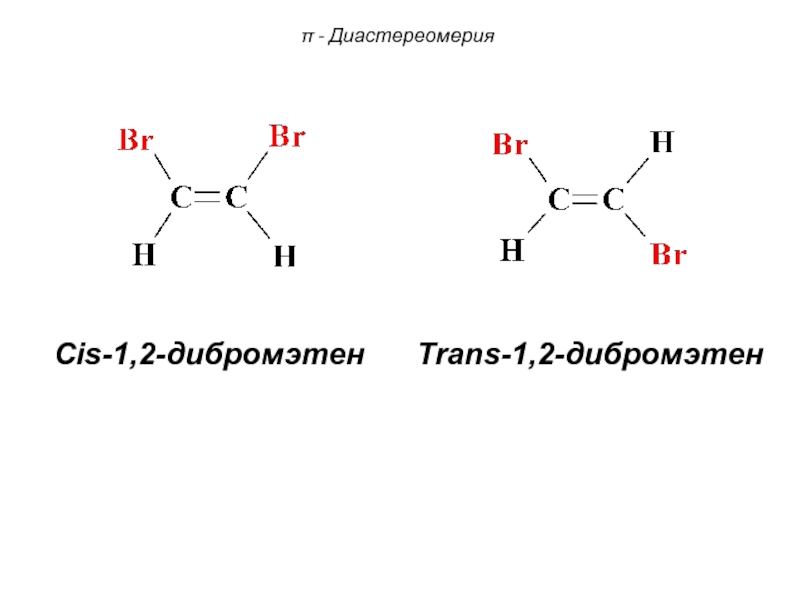
Слайд 75 Cis-1,2-дибромэтен Trans-1,2-дибромэтен
π - Диастереомерия
C = C
H
H
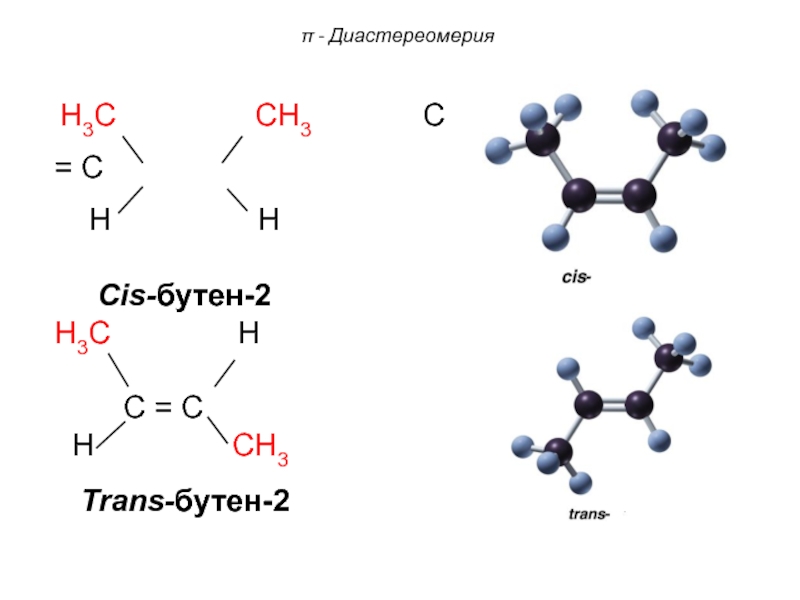
Cis-бутен-2
H3C H
C = C
H CH3
Trans-бутен-2
π - Диастереомерия
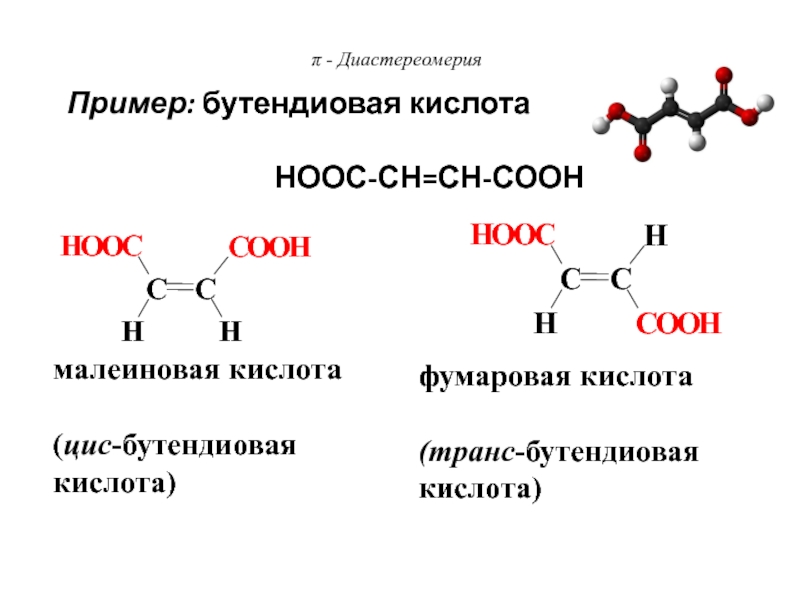
Слайд 78π - Диастереомерия
малеиновая кислота
(цис-бутендиовая кислота)
фумаровая кислота
(транс-бутендиовая кислота)
Пример: бутендиовая
кислота
НООС-СН=СН-СООН
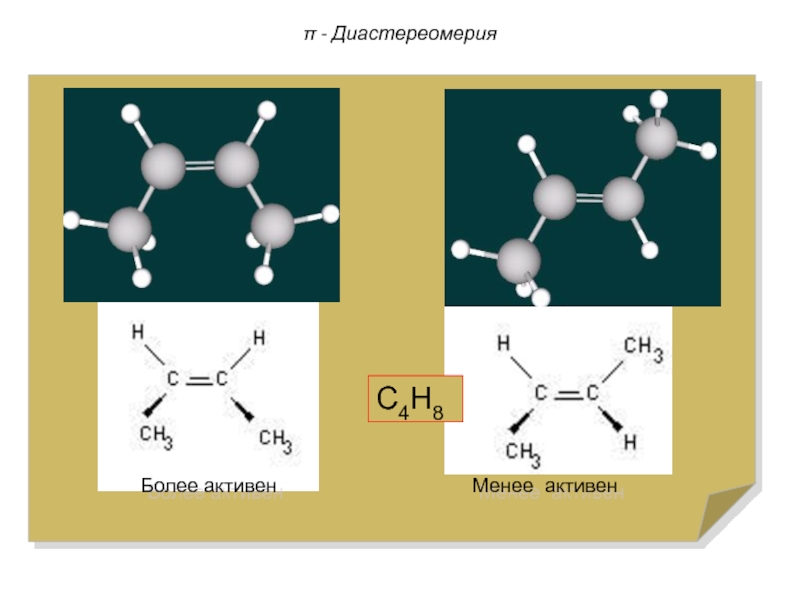
Слайд 79π - Диастереомерия
-Диастереомеры отличаются друг от друга по
физическим и химическим свойствам, а также по физиологическому действию.
Более устойчивыми являются транс--диастереомеры.
Слайд 80π - Диастереомерия
Фумаровая кислота содержится как в растительных,
так и животных организмах, где она образуется как промежуточный продукт
обмена углеводов в анаэробных условиях.
Малеиновая кислота токсична, в природе не встречается, получается синтетическим путём.
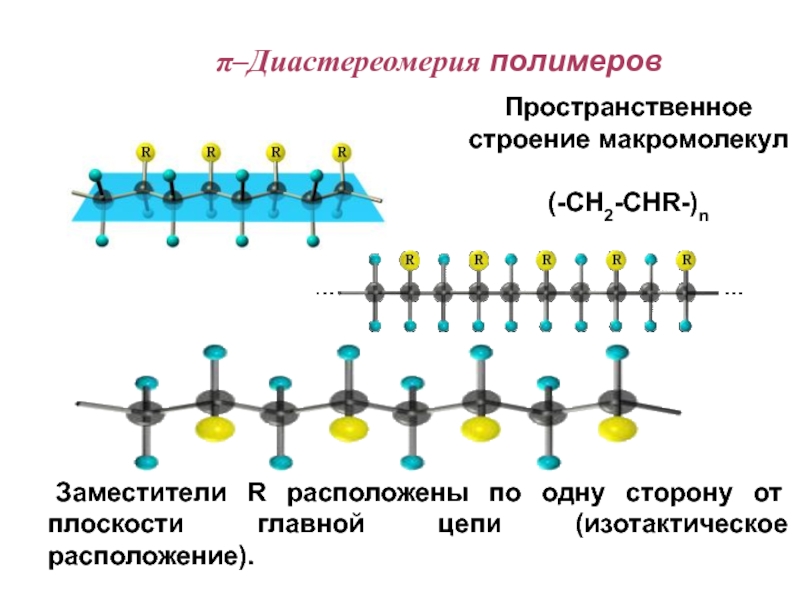
Слайд 82 Заместители R расположены по одну сторону от плоскости главной
цепи (изотактическое расположение).
Пространственное строение макромолекул
(-CH2-CHR-)n
π–Диастереомерия полимеров
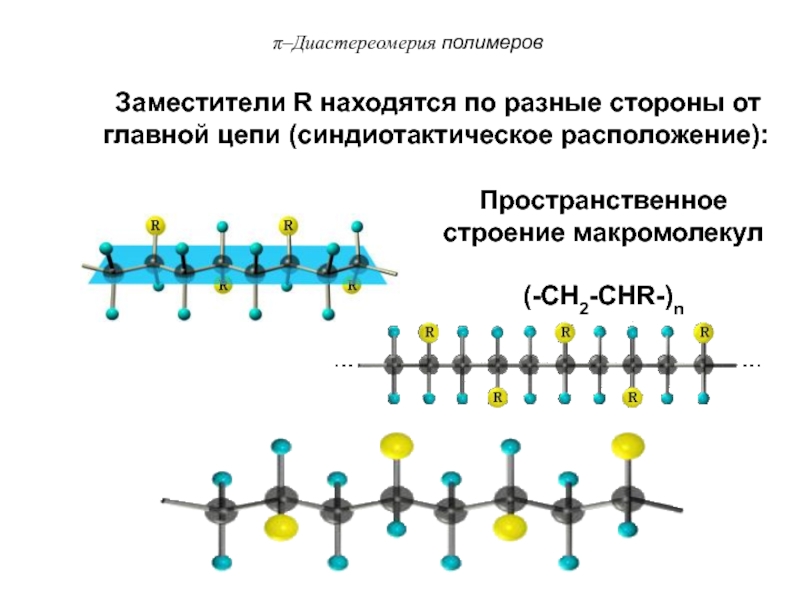
Слайд 83
Заместители R находятся по разные стороны от главной цепи
(синдиотактическое расположение):
Пространственное строение макромолекул
(-CH2-CHR-)n
π–Диастереомерия
полимеров
Слайд 84Биологическое значение
π-диастереомерии
Ретинол (витамин А) имеет транс-конфигурацию.
В организме человека он изомеризуется и приобретает цис- конфигурацию, которая принимает участие в процессе зрения.
Слайд 85Биологическое значение π-диастереомерии
Высшие ненасыщенные жирные кислоты в составе липидов имеют
цис-конфигурацию.
Это обусловливает их укороченный и согнутый вид, что имеет
значение для поддержания структуры клеточной мембраны.
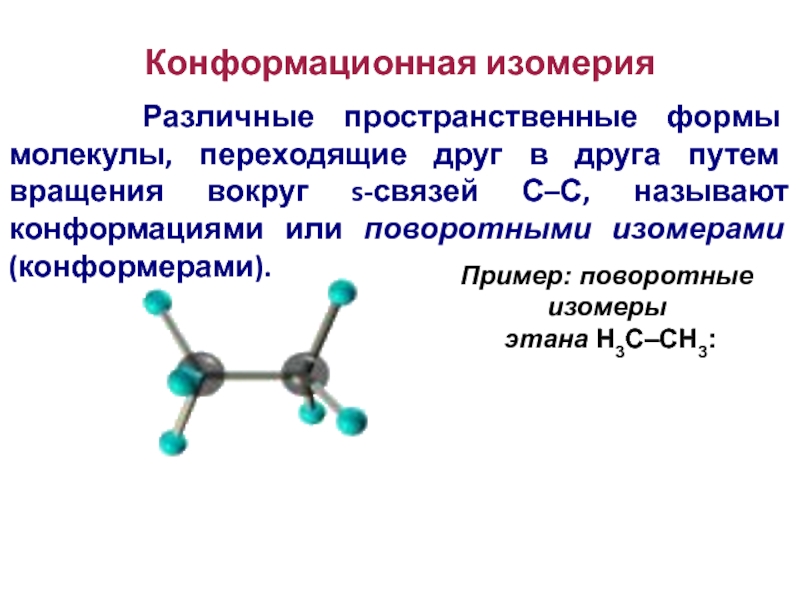
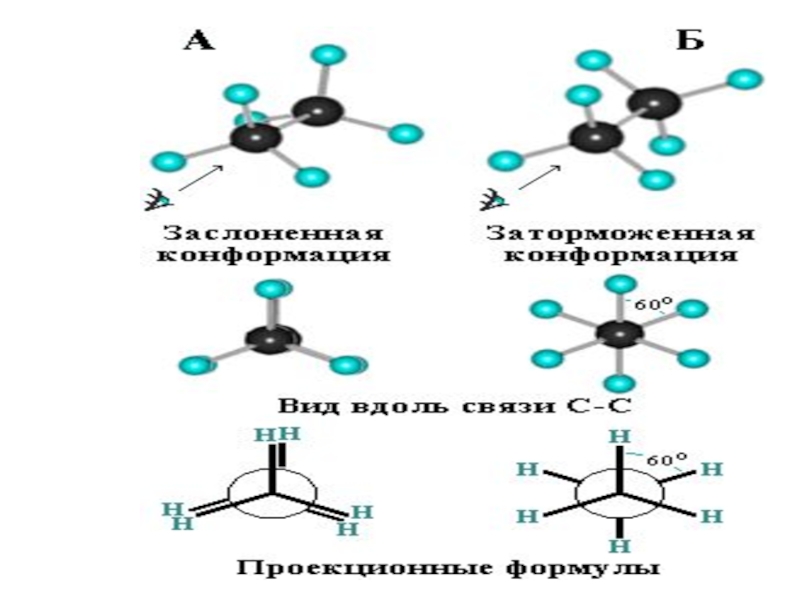
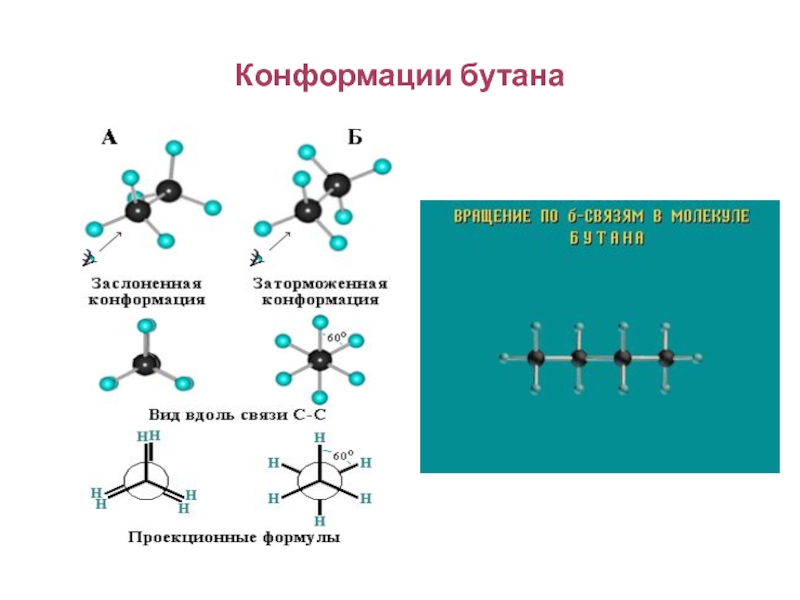
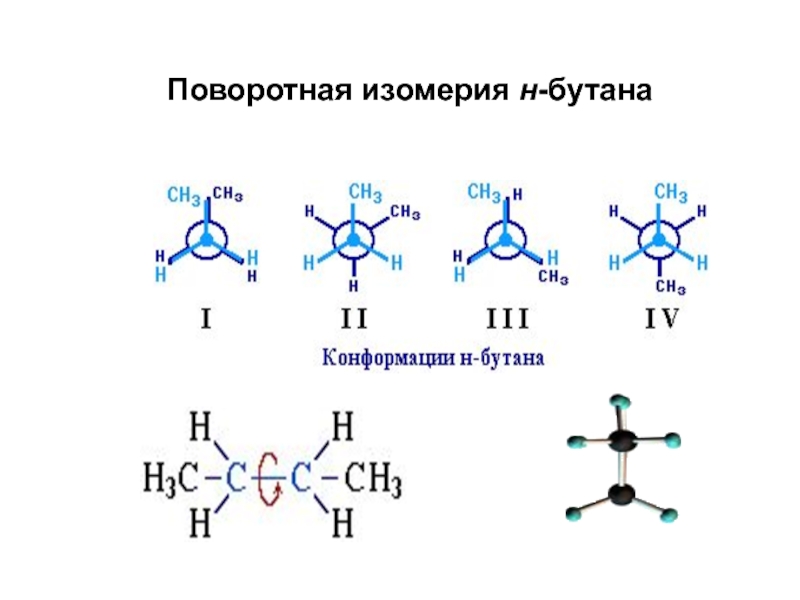
Слайд 86Конформационная изомерия
Различные пространственные формы молекулы, переходящие друг
в друга путем вращения вокруг s-связей С–С, называют конформациями или
поворотными изомерами (конформерами).
Пример: поворотные изомеры
этана Н3С–СН3:
Слайд 90
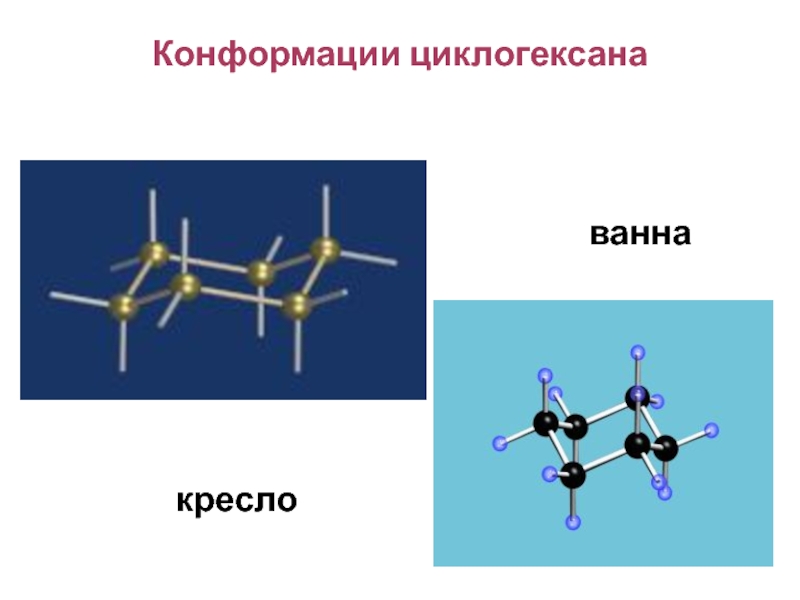
Конформации циклогексана
ванна
кресло
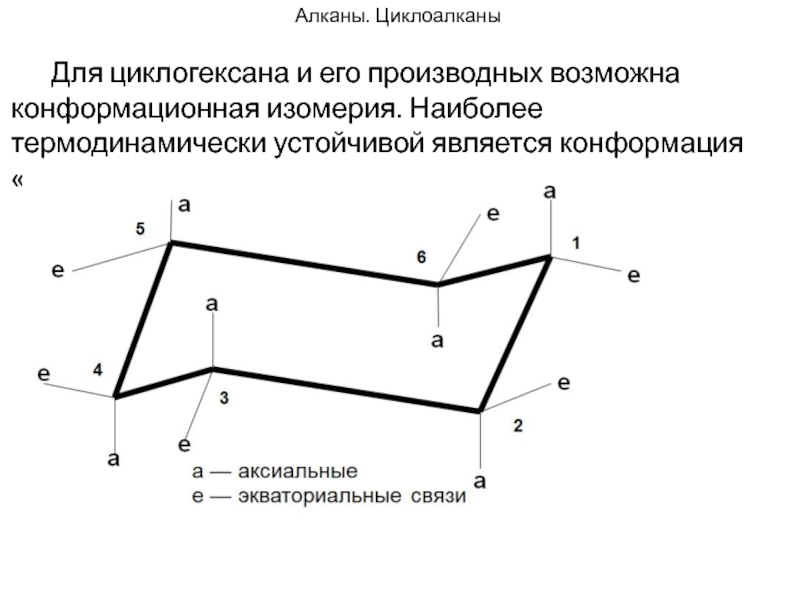
Слайд 91Алканы. Циклоалканы
Для циклогексана и его производных возможна конформационная изомерия. Наиболее
термодинамически устойчивой является конформация «кресло».










![ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ХИМИИ ячейкаПоляриметр Угол вращения плоскости поляризованного света определяется с помощью поляриметра. [a] - удельное вращениеЭнантиомерия25°CD ячейкаПоляриметр Угол вращения плоскости поляризованного света определяется с помощью поляриметра. [a] - удельное вращениеЭнантиомерия25°CD](/img/thumbs/217ed0d9e4147becf98cff55c562182f-800x.jpg)