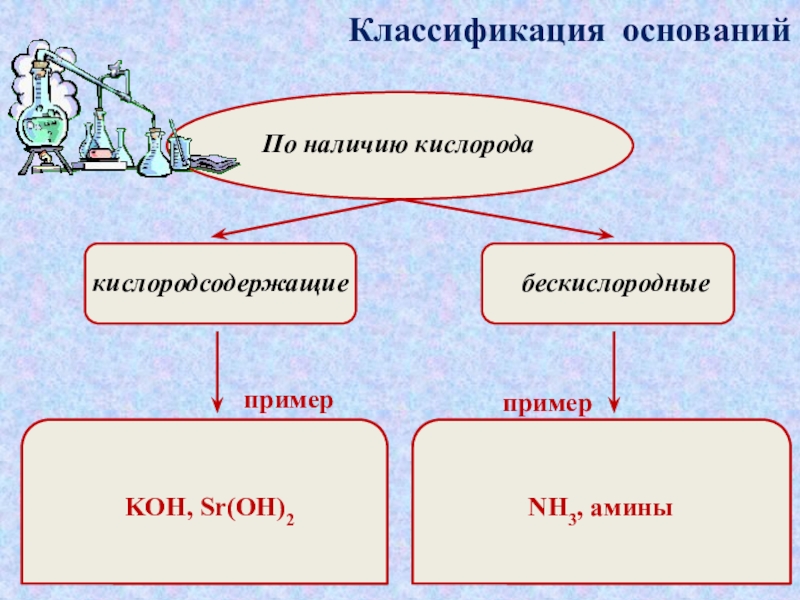
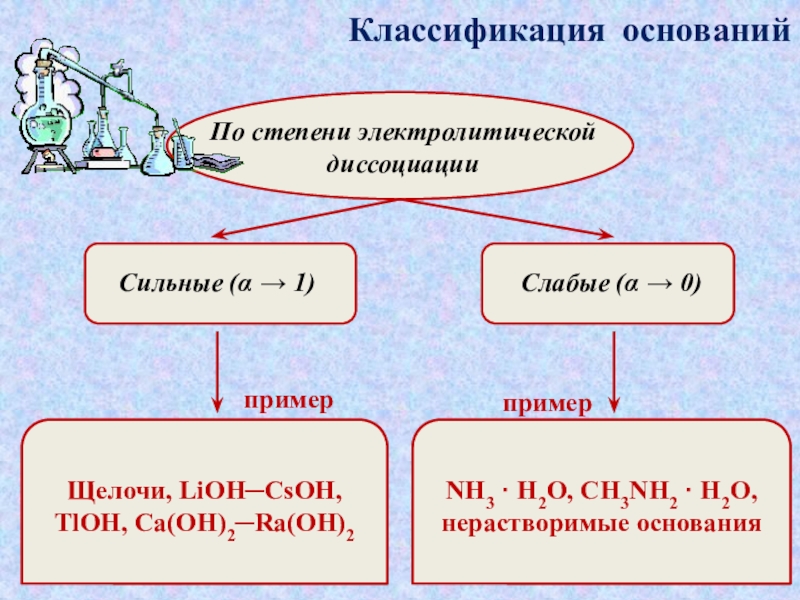
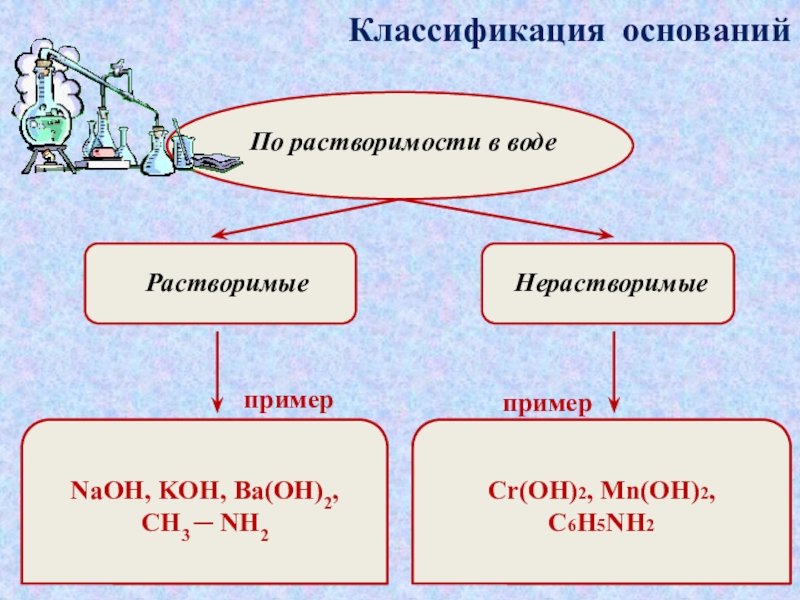
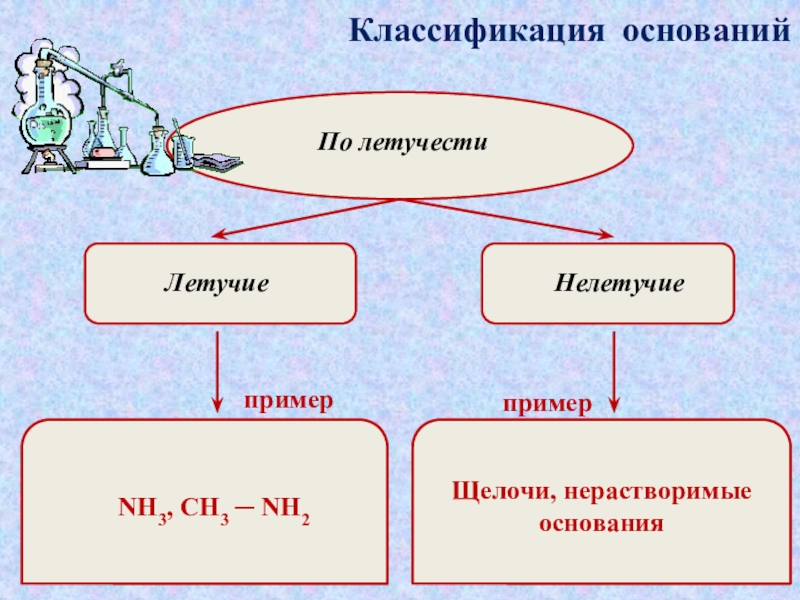
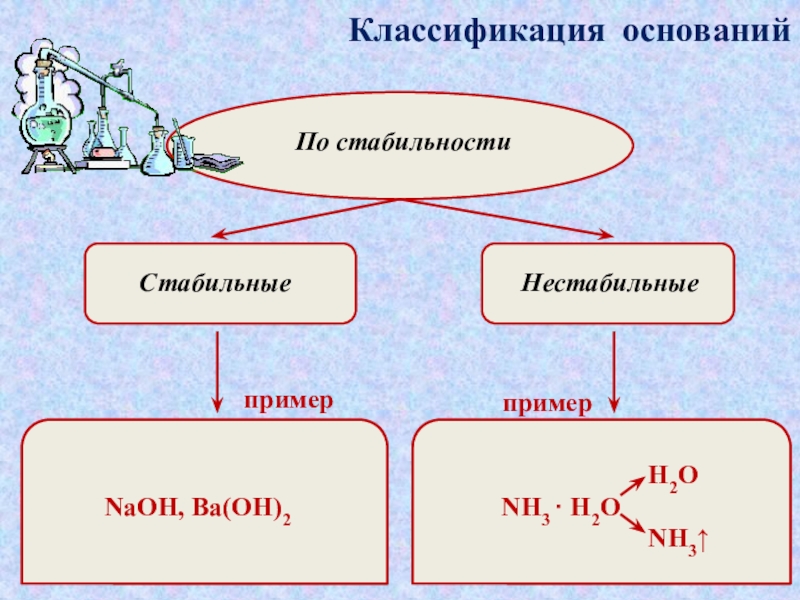
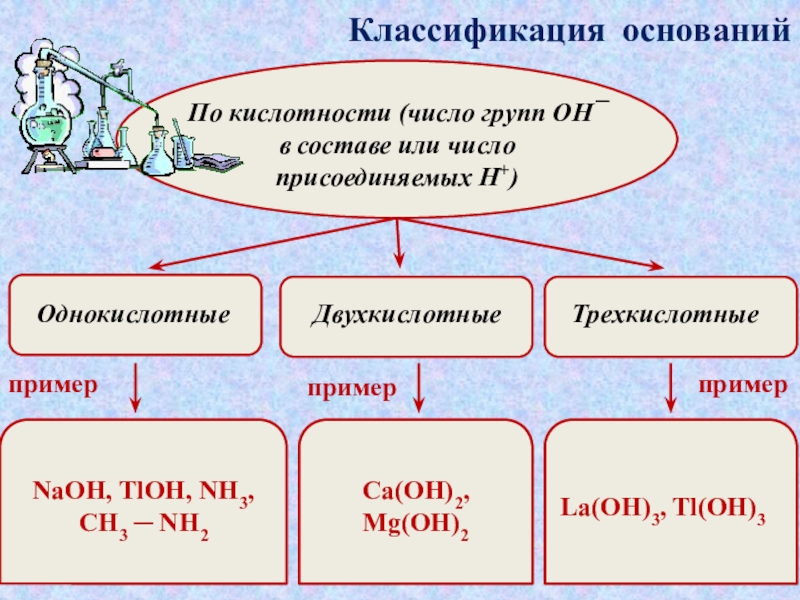
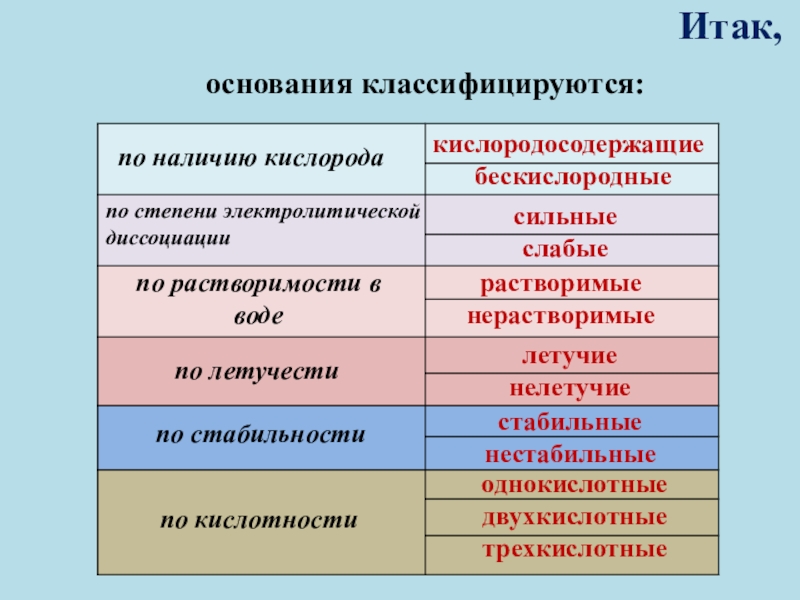
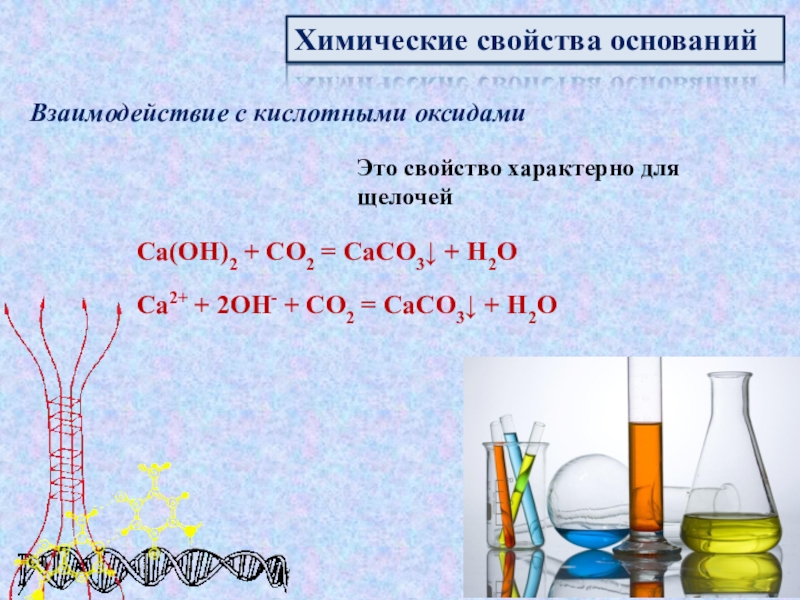
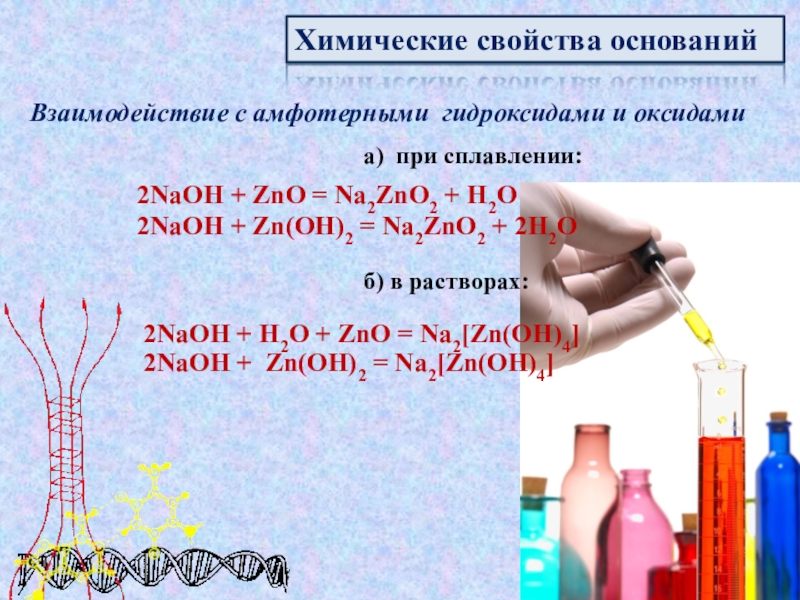
которые состоят
из
атомов металла или иона аммонияи гидроксогруппы (-ОН). Хорошо раст-
воримые в воде основания называются
щелочами.
⇄
ХОН Х+ + ОН-
Гидроксид натрия
Гидроксид кальция
Гидроксид алюминия
Метагидроксид железа(III)