Слайд 1Основные химические понятия и законы.
Предмет химии
Слайд 2
Химия – наука, изучающая свойства и превращения веществ, сопровождающиеся изменением
их состава и строения.
Процесс превращения одних веществ в другие называется
химической реакцией.
Способность вещества участвовать в тех или иных химических реакциях характеризует его химические свойства.
Слайд 3Атомно-молекулярное учение (АМУ)
Молекула — это наименьшая частица определенного вещества, которая обладает
его химическими свойствами.
Атом – это электронейтральная частица, которая состоит из
положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Слайд 4Массы атомов химических элементов очень малы – от 1,674∙10-27 до
4,27∙10-25 кг.
Относительной атомной массой (Ar) элемента называется величина, равная отношению
средней массы атомов данного элемента к 1/12 массы изотопа 12С.
Относительной молекулярной массой (Mr) вещества называется отношение массы его молекулы к 1/12 массы изотопа 12С.
Слайд 5Моль – количество вещества, содержащее столько структурных элементарных единиц, сколько
содержится атомов в 12 г изотопа 12С.
Масса 1 моль вещества
Х называется молярной массой М(Х) и представляет собой отношение массы m этого вещества к его количеству n:
, г/моль
Слайд 6Число Авогадро – это физическая константа, численно равная количеству структурных
единиц в 1 моль вещества.
Определяется как количество атомов в двенадцати
граммах чистого изотопа 12С.
NA = 6,02∙1023 моль-1
Слайд 7
Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции.
Основные
законы химии
1. Закон сохранения массы вещества
Михаил Васильевич Ломоносов, 1748 г.
Антуан
Лоран Лавуазье, 1789 г.
Слайд 8Выходом реакции (η) называют отношение реальной массы продукта (mпр) к
теоретически возможной (mт), выраженное в долях единицы или в процентах.
∙100%, %
Слайд 92. Периодический закон
Дмитрий Иванович Менделеев, 1869 г.
Свойства простых веществ, а
также формы и свойства соединений элементов находятся в периодической зависимости
от заряда ядра элемента.
Слайд 103. Закон постоянства состава
Жозеф Луи Пруст, 1808 г.
Все индивидуальные химические
вещества имеют постоянный качественный и количественный состав и определённое химическое
строение, независимо от способа получения.
CuS – сульфид меди
m(Cu) : m(S) = Ar(Cu) : Ar(S) = 64 : 32 = 2 : 1
Слайд 11n – число атомов;
Ar (Э) – относительная атомная масса элемента;
Mr
(вещества) – относительная молекулярная масса вещества.
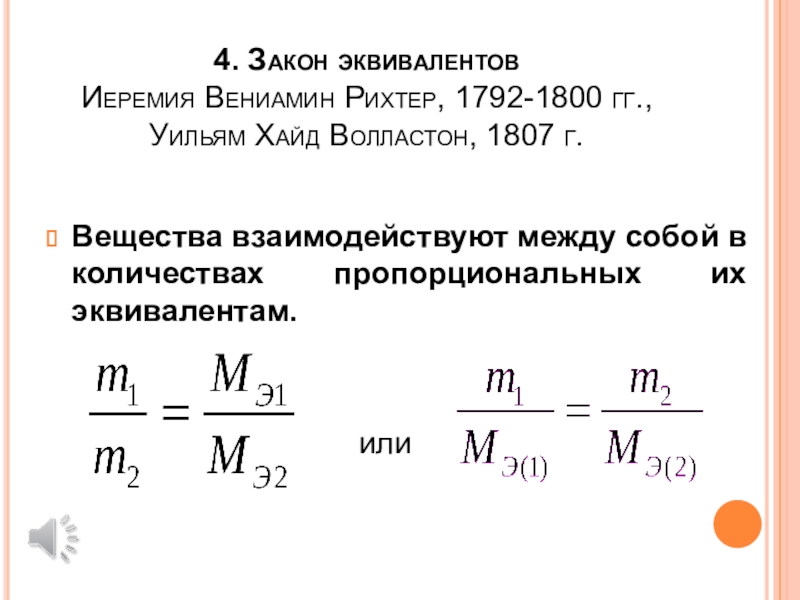
Слайд 124. Закон эквивалентов
Иеремия Вениамин Рихтер, 1792-1800 гг.,
Уильям Хайд Волластон, 1807
г.
Вещества взаимодействуют между собой в количествах пропорциональных их эквивалентам.
или
Слайд 13Эквивалент - условная химическая частица в Z раз меньшая, чем
соответствующая формульная единица вещества.
Величина, обратная числу эквивалентности Z, называется
фактором эквивалентности (fэкв):
Слайд 14 Масса 1 моль вещества эквивалента (1/z X) называется
молярной массой эквивалента M(1/z X) и представляет собой отношение массы
m вещества X к количеству вещества эквивалента n(1/z X):
Слайд 15Эквивалентная молярная масса кислоты
Слайд 16Эквивалентная молярная масса основания
Слайд 17Эквивалентная молярная масса соли
Слайд 18Эквивалентная молярная масса окислителя/восстановителя
Слайд 195. Закон Авогадро
Амадео Авогадро, 1811 г.
В равных объёмах различных газов
при одинаковых условиях содержится одинаковое число молекул.
(! Закон справедлив только
для газообразных веществ)
Слайд 20Следствия:
1) При одинаковых условиях равные количества различных газов занимают равные
объёмы.
Слайд 21Следствия:
2) При нормальных условиях
(0 0С
= 273 К, 1 атм = 101,3 кПа)
1 моль
любого газа занимает объём 22,4 л – Vm – молярный объём.
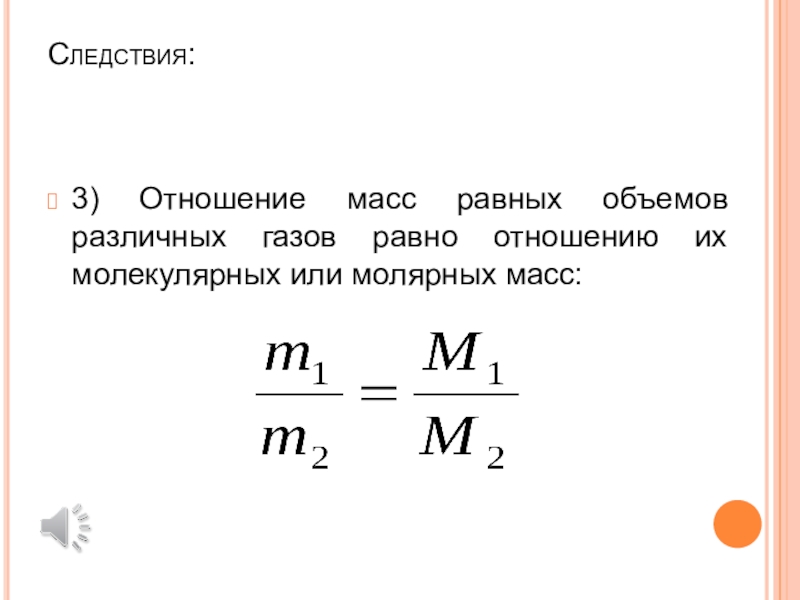
Слайд 22Следствия:
3) Отношение масс равных объемов различных газов равно отношению их
молекулярных или молярных масс:
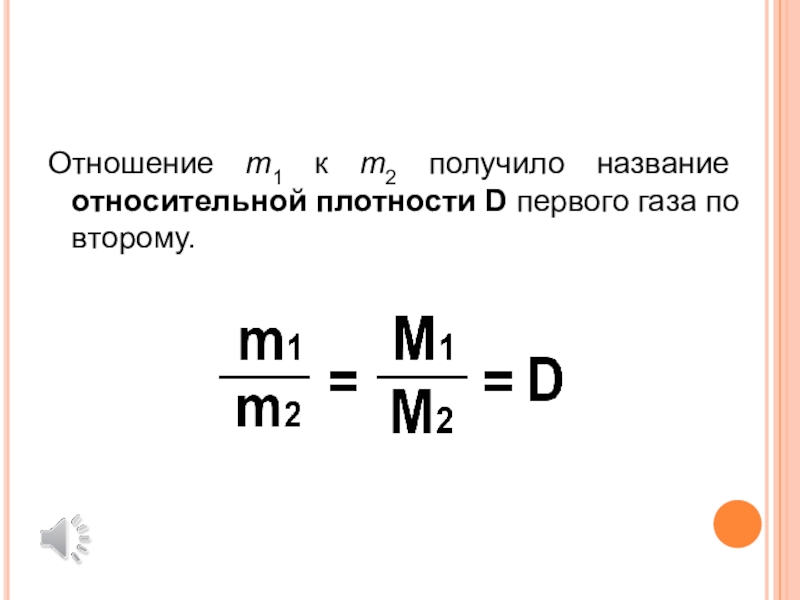
Слайд 23Отношение m1 к m2 получило название относительной плотности D первого
газа по второму.
Слайд 24
6. Объединённый газовый закон
(закон Клапейрона)
Произведение давления данной массы на его
объём, делённое на абсолютную температуру, есть величина постоянная.
где Р0, V0,
T0 – значение величин при н.у.
Слайд 25Закон Гей-Люссака
при Р = const (Р = Р0)
Слайд 26Закон Бойля-Мариотта
при Т = const (Т = Т0)
Р∙V = P1∙V1
Слайд 27Закон Шарля
при V = const (V = V0)
Слайд 28Универсальная газовая постоянная
=
Слайд 29Уравнение состояния идеального газа
уравнение Менделеева-Клапейрона
Менделеев объединил известные нам законы Бойля-Мариотта,
Гей-Люссака и Шарля с законом Авогадро. Уравнение, связывающее все эти
законы, называется уравнением Менделеева-Клапейрона:
если количество газа отлично от 1 моль, то:
pV=RT