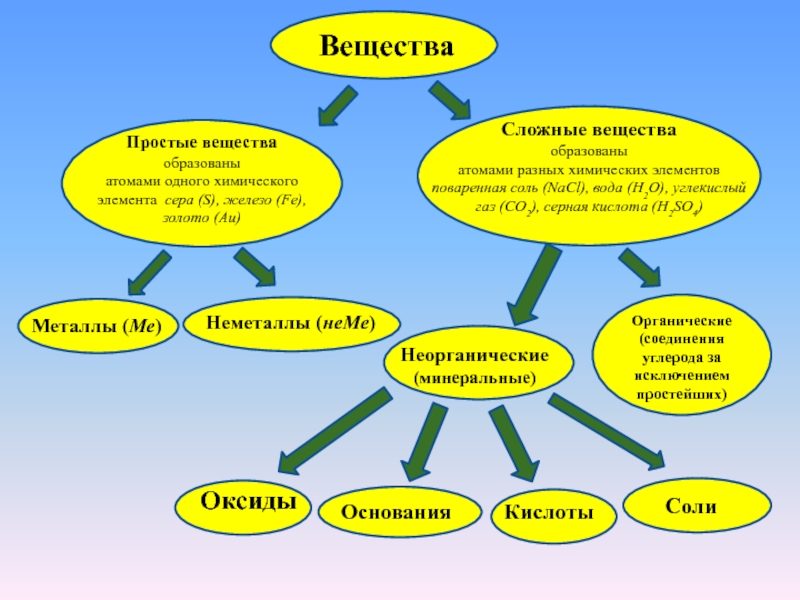
золото (Au)
Сложные вещества
образованы
атомами разных химических элементов
поваренная соль (NaCl),
вода (H2O), углекислый газ (CO2), серная кислота (H2SO4)Металлы (Ме)
Неметаллы (неМе)
Неорганические
(минеральные)
Органические
(соединения углерода за исключением простейших)
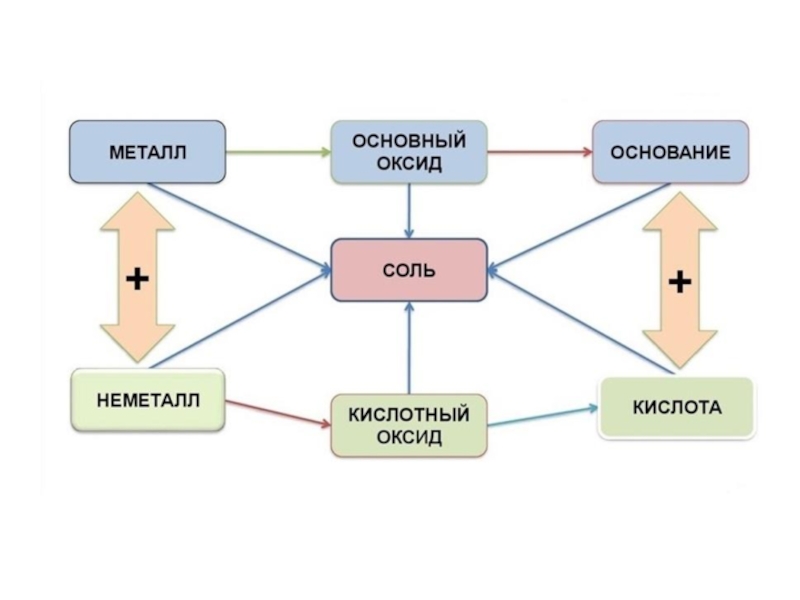
Оксиды
Основания
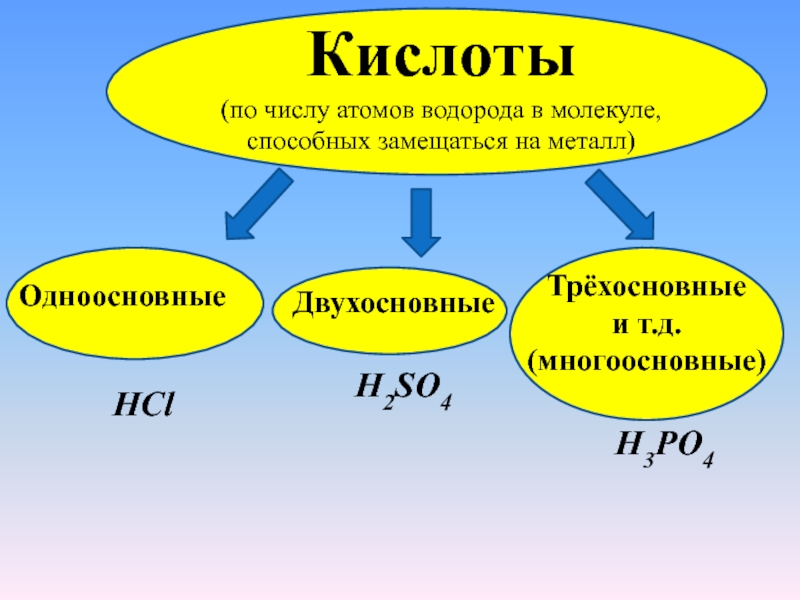
Кислоты
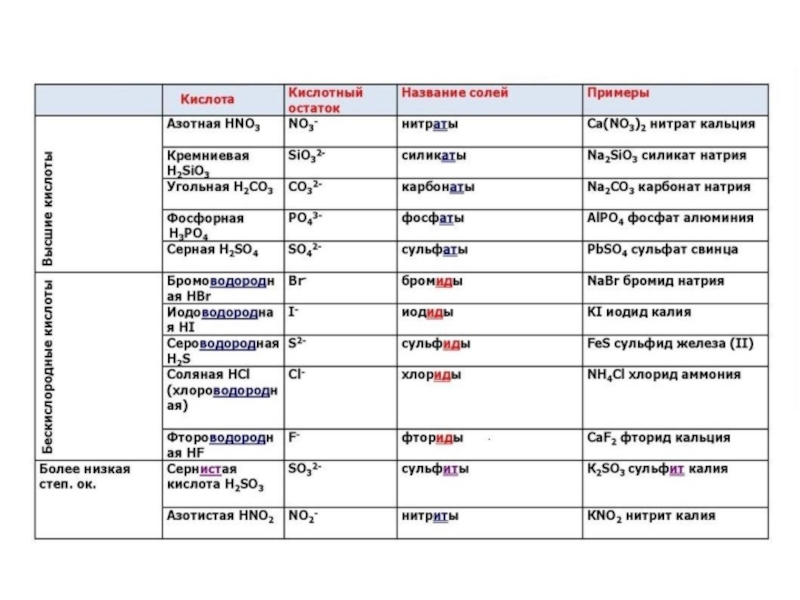
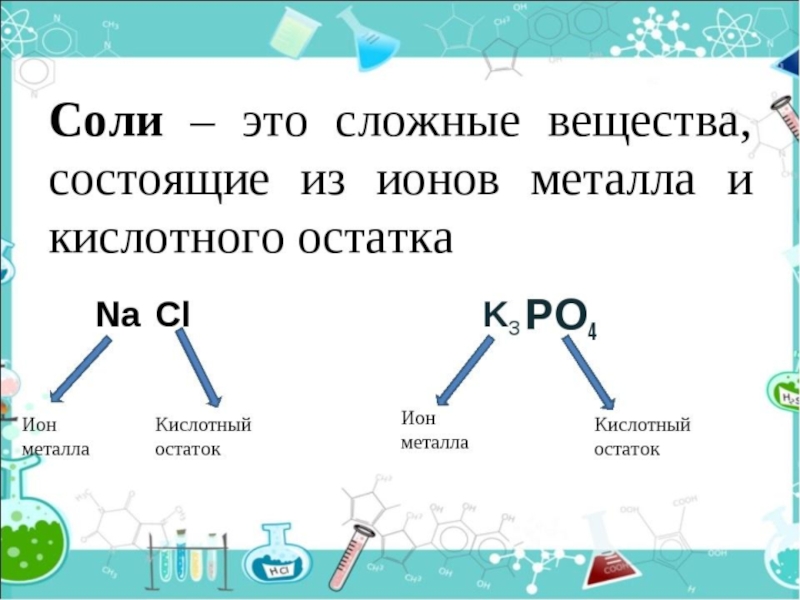
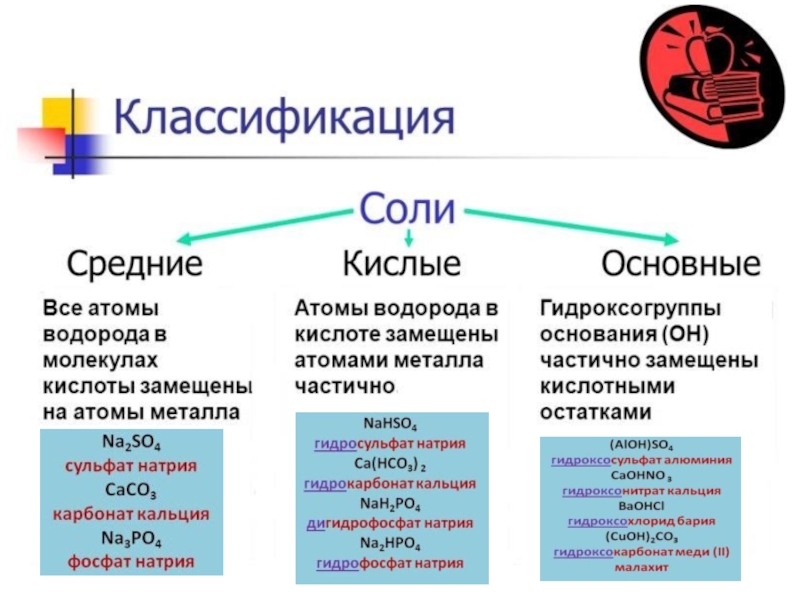
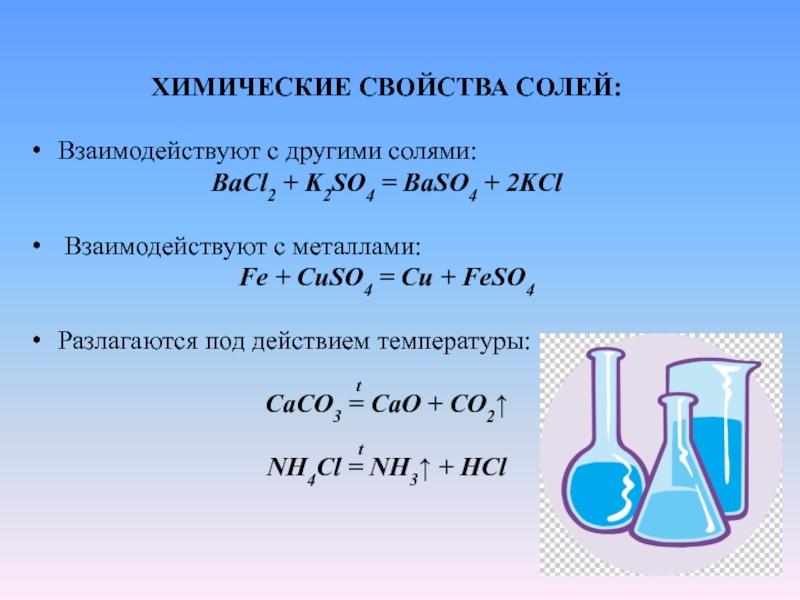
Соли
























![Звуки [х], [ х′ ].
Позначення їх
буквами Х, х ( ха](/img/thumbs/35dbf8338bb9957e36032e16906181a0-800x.jpg)
















