Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 17
Содержание
- 1. Лекция 17
- 2. Минеральными удобрениями называют соли, содержащие элементы, необходимые
- 3. Классификация минеральных удобрений
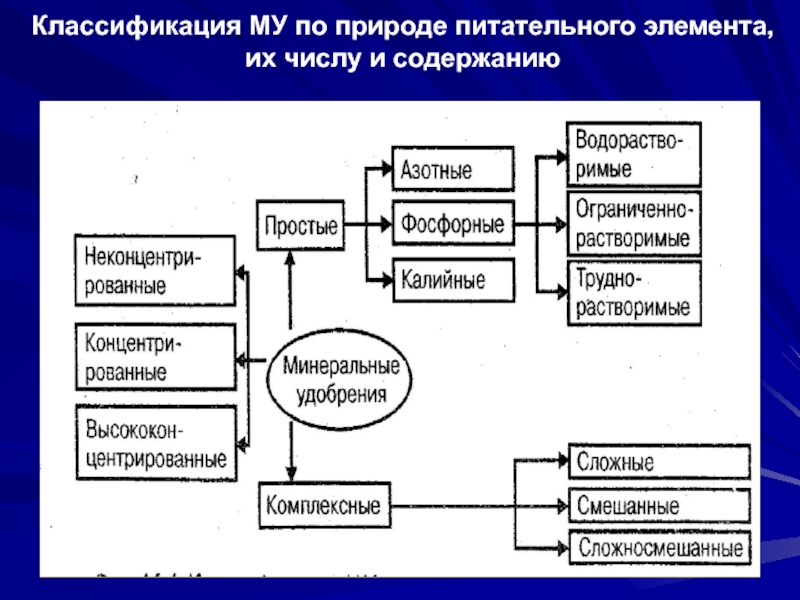
- 4. Классификация МУ по природе питательного элемента, их числу и содержанию
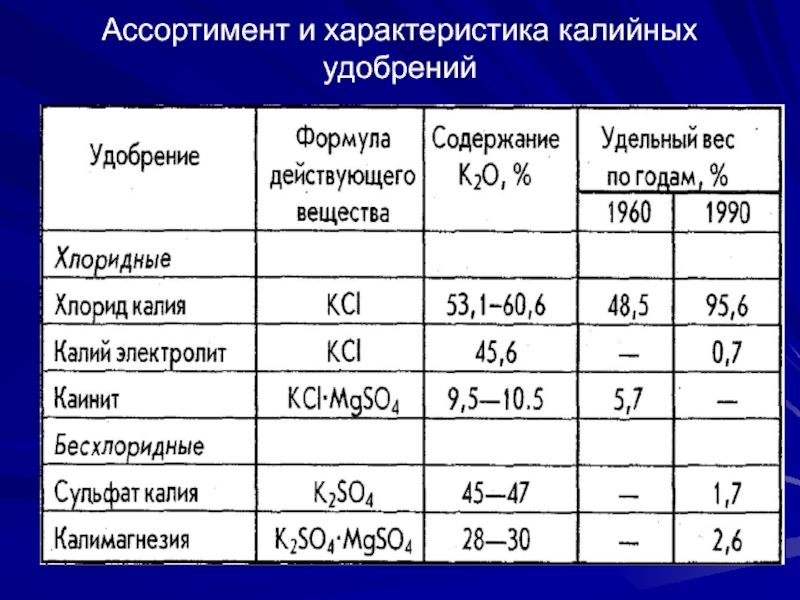
- 5. Ассортимент и характеристика калийных удобрений
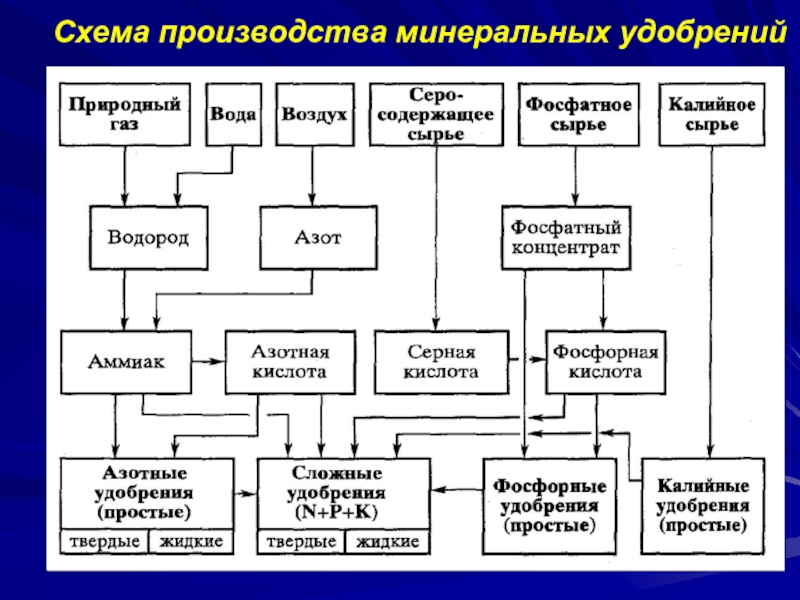
- 6. Схема производства минеральных удобрений
- 7. Производство минеральных солей Типовые процессы солевой технологииБольшинство
- 8. при термохимической обработке с химическими превращениями различают:–
- 9. Растворение и выщелачиваниеРастворением твердого тела называется процесс
- 10. Кристаллизация из растворов и другие процессы.Кристаллизацией называют
- 11. Производство калийных удобренийКалийные удобрения подразделяются на: 1)
- 12. Удобрение Формула
- 13. СЫРЬЕ. Сырьем для производства калия служит почти
- 14. Переработку сильвинитовых и карналлитовых руд на хлористый
- 15. Флотационный способ производстваФлотационный способ выделения KCl из
- 16. Флотация включает следующие операции:1. Измельчение сильвинитовой руды
- 17. Флотационный метод эффективен при извлечении хлорида калия
- 18. Слайд 18
- 19. Галургический способ производства KClГалургический способ выделения KCl
- 20. Растворимость хлоридов калия и натрия при их
- 21. Получение сульфата калияИзвестны следующие пути получения сульфата
- 22. Функциональная схема производства простого суперфосфатаПриродные фосфаты (апатиты,
- 23. Существуют методы переработки природных фосфатов: механические, термические
- 24. В результате сернокислотной переработки получают простой суперфосфат
- 25. Производства простого суперфосфата состоит в превращении природного
- 26. Функциональная схема производства простого суперфосфатаДля обеспечения высокой
- 27. 2. Используют 68,5—69,5%-ную серную кислоту: такая концентрация
- 28. С.к-ту,подогретую до 55-65°С, из напорного бака 4
- 29. Азотнокислотное разложение фосфатовПрогрессивным направлением в переработке фосфатного
- 30. Функциональная схема получения нитроаммофоса на основе азотно-кислотного разложения фосфатов.
- 31. Производство азотных удобренийВажнейшим видом минеральных удобрений являются
- 32. Производство аммиачной селитры Аммиачная селитра, или нитрат
- 33. Реакцию нейтрализации проводят в непрерывно действую-щем аппарате
- 34. 1- подогреватель кислоты; 2- подогреватель аммиака; З
- 35. Производство карбамида (мочевины). Занимает второе место по
- 36. Упрощенная технологическая схема получения карбамида с полны
- 37. Слайд 37
- 38. Производство сульфата аммонияСульфат аммония (NН4)2SО4 – б/ц
- 39. Производство нитрата кальция ( известковая или кальциевая
- 40. Получение нитрата кальция нейтрализацией азотной кислотой.В основе
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Минеральными удобрениями называют соли, содержащие элементы, необходимые для питания растений
Слайд 3 Классификация минеральных удобрений
Удобрения,
предназначенные для питания растений элементами, стимулирующими рост растений и требующимися
в весьма малых количествах, называются микроудобрениями, а содержащиеся в них питательные элементы – микроэлементами. Такие удобрения вносят в почву в очень небольших количествах. К ним относятся соли, содержащие бор, марганец, медь, цинк и другие элементы. По агрегатному состоянию удобрения подразделяют на твердые и жидкие (аммиак, водные растворы и суспензии). Большое значение имеют физические свойства удобрений. Водорастворимые удобрительные соли должны быть сыпучими, легко рассеиваться, не быть сильно гигроскопичными, не слеживаться при хранении; должны обладать такими, чтобы сохраняться на почве в течение некоторого времени, не слишком быстро вымываться дождевой водой и сдуваться ветром. Этим требованиям в наибольшей мере обладают крупнокристаллические и гранулированные удобрения. Гранулированные удобрения можно вносить не поля механизированными методами с использованием туковых машин и сеялок в количествах, строго соответствующих агрохимическим требованиям.Слайд 7Производство минеральных солей
Типовые процессы солевой технологии
Большинство МУ представляет различные минеральные
соли или твердые вещества с подобными солям свойствами. Технологические схемы
производства МУ весьма разнообразны, но, в большинстве случаев, складываются из одних и тех же типовых процессов, свойственных солевой технологии, цель которых – разделение сложных систем, состоящих из нескольких солевых компонентов.два типа процессов:
– термическая или термохимическая обработка, т.е. различные виды обжига сырья или шихты и
– растворение и перекристаллизация веществ, связанные с их химической обработкой, разделением и очисткой растворов от примесей.
Слайд 8при термохимической обработке с химическими превращениями различают:
– кальцинационный обжиг, цель
которого удаление из вещества летучих компонентов, чаще
всего оксида углерода и
конституционной воды. Например, обжиг известнякаСаСО3 = СаО + СО2
– окислительный обжиг, цель которого повышение степени окисления элемента, например
6FеО + О2 =2Fе3О4
– восстановительный обжиг, цель которого понижение степени окисления элемента, например,
Са3(РО4)2 +5С +3SiО2 = Р2 + 5СО + 3СаSiО3
Слайд 9Растворение и выщелачивание
Растворением твердого тела называется процесс разруше-ния его кристаллической
структуры под воздействием раст-ворителя с образованием гомогенной системы - раствора.
Растворение
может быть физическим, когда возможна об-ратная кристаллизация растворенного вещества из раст-вора и химическим, когда растворитель или содержащийся в нем реагент, химически взаимодействует с растворяемым веществом и делает невозможным его обратную кристал-лизацию.Частный случай растворения – выщелачивание. Это процесс извлечения (экстракции) жидким растворителем твердого компонента из системы, состоящей их двух и большего числа твердых фаз.
Как и растворение, выщелачивание может быть физически и химическим.
Слайд 10Кристаллизация из растворов и другие процессы.
Кристаллизацией называют процесс выделения твердой
фазы из растворов, происходящий при перенасыщении их по отношению к
образующейся твердой фазе. В зависи-мости от приема, с помощью которого достигается пере-сыщение раствора; различают два вида кристаллизации: политермическую и изотермическую.При политермической кристаллизации пересыщенный раствор образуется за счет охлаждения системы.
При изотермической кристаллизации пересыщенный раствор образуется в результате выпаривания части растворителя.
Частным случаем кристаллизации является высаливание, т.е. процесс выделения твердой фазы путем введения в концентрированный раствор веществ, понижающих растворимость растворенного вещества.
Слайд 11Производство калийных удобрений
Калийные удобрения подразделяются на:
1) сырые калийные соли
– размолотые природные водорастворимые калийные минералы;
2) концентрированные калийные удобрения
– продукты заводской переработки сырых солей; 3)калийные соли – продукты, получаемые смешением сырых солей, содержащих K и Na и концентрированных солей калия. В зависимости от природы аниона калийные удобрения подразде-ляются на хлоридные и бесхлорные.
Обычно в калийных удобрениях содержится 40-60% К2О, а в используемых в качестве удобрений природных солях –20%.
К калийным удобрениям хлоридного типа относят природные минералы (каинит, сильвинит),продукты промышленной переработки минералов (хлорид калия), смешанные калийные соли,полученные смешением природных минералов с хлоридом калия, злектролитные растворы (побочный продукт электролиза карналита).
К бесхлорным калийным удобрениям относятся сульфат калия и калимагнезия (двойная соль сульфата калия и сульфата магния).
Слайд 12
Удобрение Формула
Содержание, Уд.вес
действующего K2O % произв-вав-ва
Хлорид калия KCl 53.1-60.6 95.6
Калий электролит KCl 45.6 0.7
Каинит КСl∙МgSО4 9.5-10.5 -
Сульфат калия K2SO4 45-47 1.7
Калимагнезия К2SО4∙МgSО4 28-30 2,6
Качество хлористого калия регламентировано ГОСТом, которым предусмотрен выпуск продукта двух марок:
К – обогащенного кристаллизацией из растворов и
Ф– флотационным обогащением калийных руд.
KCl выпускается в гранулированном или крупнокристаллическом виде. По требованию потребителей м.б. и в порошкообразном виде.
Кристаллический KCl способен слеживаться, поэтому его
обрабатывают раствором солянокислых солей высокомолекулярных аминов.
По сравнению с хлористым калием K2SO4 обладает и лучшими физическими свойствами – он не гигроскопичен и не слеживается.
Слайд 13СЫРЬЕ. Сырьем для производства калия служит почти исключительно природный минерал
сильвинит – смесь сильвина КСl и галита NаСl с содержанием
калия 22-25%, считая на К2О. Значительно реже хлорид калия получают из карналлитаКСl ∙МgСl2 ∙ 6Н2О, содержащего около 17% К2О.
Сульфат калия получают из лангбейнита К2SО4 *2МgSО4, шенита К2SО4 ∙ 2МgSО4 ∙ 6 Н2О, каинита КСl ∙ МgSО4 ∙ 3 Н2О и других минералов.
Содержание КСl в добываемом сильвините колеблется от 23 до 30%, NаСl – от 65 до 75%, нерастворимых глинистых веществ от 0.5 до 3.0%
Потенциальным источником сырья для производства калийных удобрений может стать Мировой океан, в водах которого концентрация калия достигает 0.07%, что в пересчете на К2О составляет 7 ∙ 1014 тонн. Сгущенная путем испарения в бассейнах и бессточных водоемах морская вода может явиться источником для промышленного получения солей калия. Таким способом получают, например, хлористый калий из рапы Мертвого моря.
Слайд 14Переработку сильвинитовых и карналлитовых руд на хлористый калий осуществляют:
a. методами
растворения и раздельной кристаллизации, основанной на различии температурных коэффициентов растворимости
солевых составляющих руды (эти методы называют еще тепловыми или галлургическими;b. путем механического обогащения породы, главным образом флотацией;
c. комбинацией флотационного обогащения с растворением и кристаллизацией мелких фракций руды.
Аналогичными приемами перерабатываются и сульфатные породы.
В н.в. флотационным методом вырабатывается около 80% всего хлорида калия.
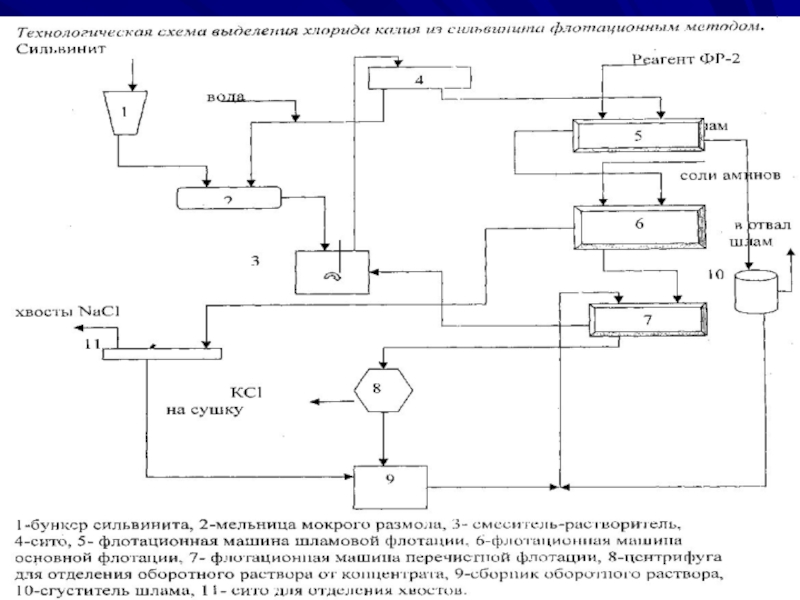
Слайд 15Флотационный способ производства
Флотационный способ выделения KCl из сильвинита основан на
флотогравитационном разделении водорастворимых минералов калийной руды в среде насыщенного ими
солевого раствора. Это достигается селективной гидрофобизацией поверхности частиц калийных минералов с помощью флотореагентов-собирателей.Технологические схемы флотационного производства KCl зависят от минералогического и гранулометрического состава флотируемого сильвинита: содержания примесей (шламов), размеров зерен компо-нентов и различаются методами обработки глинистых шламов.
Слайд 16Флотация включает следующие операции:
1. Измельчение сильвинитовой руды до размеров частиц
1-3 мм с последующим мокрым размолом до размера 0.5 мм.
2.
Отделение глинистого шлама-тонкодисперсных глинисто-карбонаных примесей методами флотации, гидравлической классификации, или гравитации.3. Флотационное разделение водорастворимых минералов руды (сильвина и галита) в
присутствии собирателей (основная флотация).
4. Перечистная флотация концентрата для удаления из него оставшихся примесей.
5. Обезвоживание концентрата методами сгущения и фильтрования с возвратом в процесс
оборотного раствора.
6. Сушка влажного концентрата.
Слайд 17Флотационный метод эффективен при извлечении хлорида калия из высококачественных сильвинитовых
руд, содержащих незначительное количество шлама. Степень извлечения хлорида
калия достигает 0.90-0.92
дол. ед., а готовый продукт содержит 93-95% соли. Степень извлечения может быть повышена, если в технологической схеме предусмотрена перечистная флотацияотделяемого глинистого шлама для извлечения из него хлорида калия.
Слайд 19Галургический способ производства KCl
Галургический способ выделения KCl из сильвинита или
метод избирательного растворения и раздельной кристаллизации основан на различии температурных
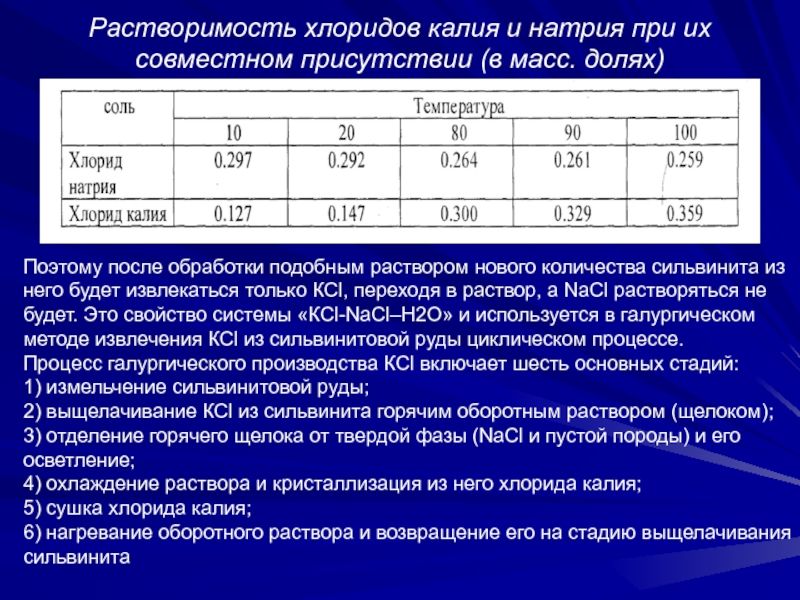
коэффициентов растворимости хлоридов калия и натрия при их совместном присутствии, т.е. в системе «КСl-NаСl –Н2О». В растворах, насыщенных обеими солями, при повышении температуры от 20-25 до 90-1000С содержание KCl возрастает примерно в два раза, а хлорида натрия несколько уменьшается. При охлаждении такого горячего раствора он становится пересыщенным относительно KCl, который будет кристаллизоваться, а хлорид натрия останется в растворе. При последующем нагревании этого раствора он останется насыщенным относительно хлорида натрия и становится ненасыщенным относительно хлорида калия.Слайд 20Растворимость хлоридов калия и натрия при их совместном присутствии (в
масс. долях)
Поэтому после обработки подобным раствором нового количества сильвинита из
него будет извлекаться только КCl, переходя в раствор, а NаСl растворяться не будет. Это свойство системы «КСl-NаСl–Н2О» и используется в галургическом методе извлечения КСl из сильвинитовой руды циклическом процессе.Процесс галургического производства КСl включает шесть основных стадий:
1) измельчение сильвинитовой руды;
2) выщелачивание КСl из сильвинита горячим оборотным раствором (щелоком);
3) отделение горячего щелока от твердой фазы (NаСl и пустой породы) и его
осветление;
4) охлаждение раствора и кристаллизация из него хлорида калия;
5) сушка хлорида калия;
6) нагревание оборотного раствора и возвращение его на стадию выщелачивания сильвинита
Слайд 21Получение сульфата калия
Известны следующие пути получения сульфата калия:
1) переработка галургическими
методами – растворением и кристаллизацией полиминеральных сульфатнокалийных руд;
2) конверсионный и
ионитный способы на основе взаимодействия хлоритсого калия и различных сульфатных солей;3) комбинирование флотационного обогащения сульфатнокалийных руд с переработкой концентрата галургическим способом;
4) при происзводстве соляной кислоты из хлористого калия и серной кислоты или сернистого газа;
5) гидротермический метод переработки полиминеральных руд или сульфатных солей и хлоритсого калия с получением в качестве побочного продукта HCl ;
6) переработка водонерастворимых калийных руд.
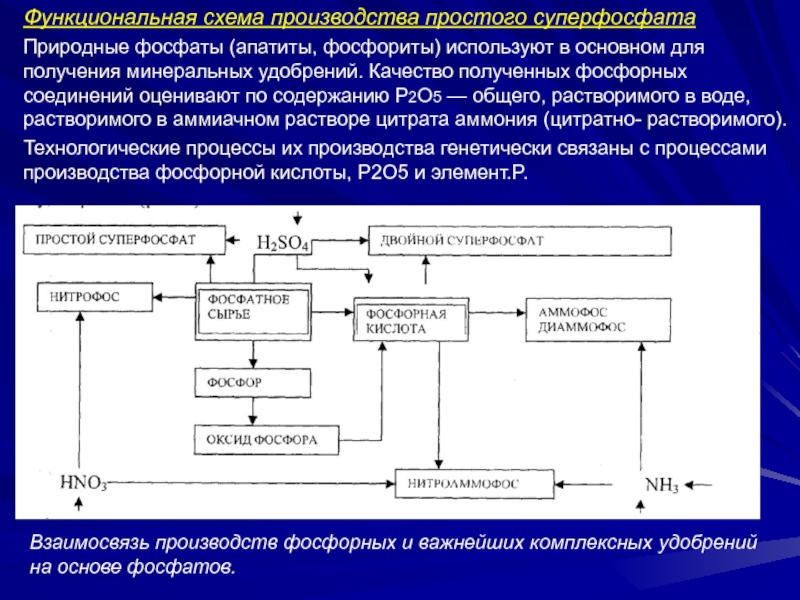
Слайд 22Функциональная схема производства простого суперфосфата
Природные фосфаты (апатиты, фосфориты) используют в
основном для получения минеральных удобрений. Качество полученных фосфорных соединений оценивают
по содержанию Р2О5 — общего, растворимого в воде, растворимого в аммиачном растворе цитрата аммония (цитратно- растворимого).Технологические процессы их производства генетически связаны с процессами производства фосфорной кислоты, P2O5 и элемент.P.
Взаимосвязь производств фосфорных и важнейших комплексных удобрений на основе фосфатов.
Слайд 23Существуют методы переработки природных фосфатов: механические, термические и методы кислотного
разложения.
Метод механической обработки - измельчение фосфатов. Полученная фосфоритная мука при
использовании в кислых почвах очень медленно растворяется в почвенных водах и т.о.становится долговременно действующим удобрением.Фосфорные удобрения могут быть получены термическим разложем фосфатов при Т 1200—1800°С. Так получают термофосфаты, обесфторенные
фосфаты, плавленые магниевые и термощелочные фосфаты.
Основным методом получения фосфорных удобрений является химическое р а з л о ж е н и е фосфатного сырья минеральными кислотами.
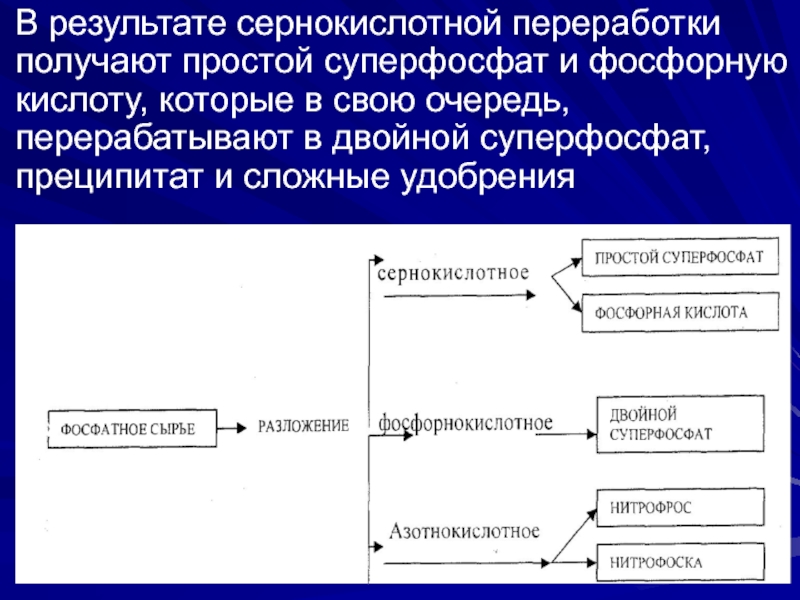
Слайд 24В результате сернокислотной переработки получают простой суперфосфат и фосфорную кислоту,
которые в свою очередь, перерабатывают в двойной суперфосфат, преципитат и
сложные удобренияСлайд 25Производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в
воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат
Са(Н2РО4)2.Процесс разложения может быть представлен следующим суммарным уравнением:
2Ca5F(PO4)3+7H2SO4+3H2O=3Са(Н2РО4)2*Н2О]+ 7[CaSO4*0,5H2O]+2HF;
ΔН-227,4кДж
Практически в процессе производства простого суперфосфата разложение протекает в две стадии. На первой стадии около 70% апатита реагирует с серной кислотой. При этом образуются фосфорная кислота и полугидрат сульфата кальция:
Ca5F(PO4)3+5H2SO4 +2,5H2O = 5 (CaSO4-0,5H2O) +3H3PO4 +HF
Эта стадия представляет собой химическое растворение, осложненное осаждением на зернах фосфата плотных, или сравнительно рыхлых пористых корок сульфата кальция. После полного израсходования серной кислоты начинается вторая стадия разложения, в которой оставшийся апатит (30%) разлагается фосфорной кислотой.
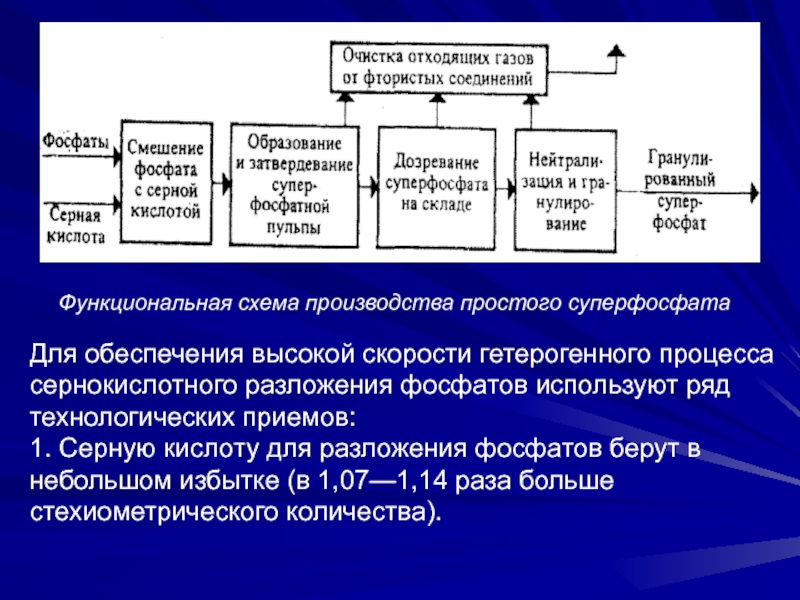
Слайд 26Функциональная схема производства простого суперфосфата
Для обеспечения высокой скорости гетерогенного процесса
сернокислотного разложения фосфатов используют ряд технологических приемов:
1. Серную кислоту для
разложения фосфатов берут в небольшом избытке (в 1,07—1,14 раза больше стехиометрического количества).Слайд 272. Используют 68,5—69,5%-ную серную кислоту: такая концентрация является оптимальной для
кристаллизации сульфата кальция и дальнейшего разложения фосфатов.
3. Температуру в суперфосфатной
камере поддерживают на уровне 115—120°С, что обеспечивает достаточную скорость разложения и в то же время позволяет получить продукт (суперфосфат), обладающий хорошими физическими свойствами.Для получения товарного продукта более высокого качества суперфосфат после дозревания подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т. п.) и гранулируют.
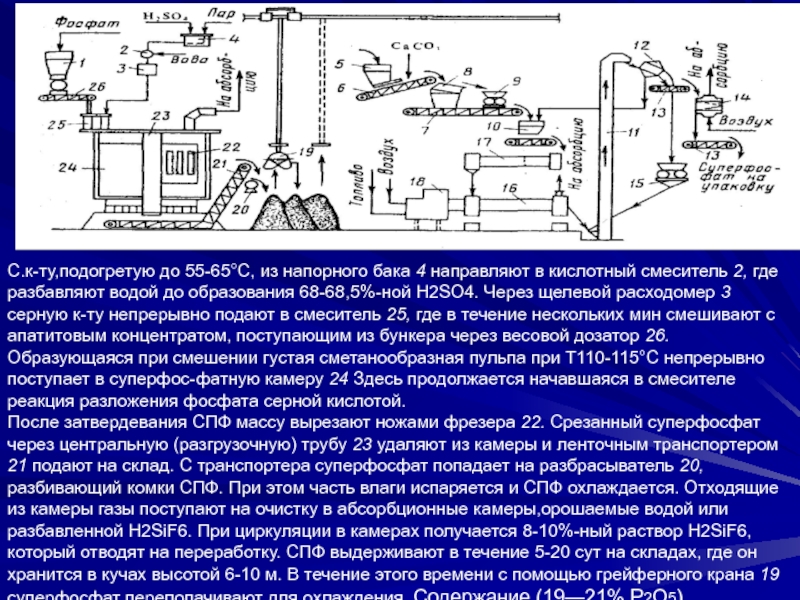
Слайд 28С.к-ту,подогретую до 55-65°С, из напорного бака 4 направляют в кислотный
смеситель 2, где разбавляют водой до образования 68-68,5%-ной H2SO4. Через
щелевой расходомер 3 серную к-ту непрерывно подают в смеситель 25, где в течение нескольких мин смешивают с апатитовым концентратом, поступающим из бункера через весовой дозатор 26. Образующаяся при смешении густая сметанообразная пульпа при Т110-115°С непрерывно поступает в суперфос-фатную камеру 24 Здесь продолжается начавшаяся в смесителе реакция разложения фосфата серной кислотой.После затвердевания СПФ массу вырезают ножами фрезера 22. Срезанный суперфосфат через центральную (разгрузочную) трубу 23 удаляют из камеры и ленточным транспортером 21 подают на склад. С транспортера суперфосфат попадает на разбрасыватель 20, разбивающий комки СПФ. При этом часть влаги испаряется и СПФ охлаждается. Отходящие из камеры газы поступают на очистку в абсорбционные камеры,орошаемые водой или разбавленной H2SiF6. При циркуляции в камерах получается 8-10%-ный раствор H2SiF6, который отводят на переработку. СПФ выдерживают в течение 5-20 сут на складах, где он хранится в кучах высотой 6-10 м. В течение этого времени с помощью грейферного крана 19 суперфосфат перелопачивают для охлаждения. Содержание (19—21% Р2О5).
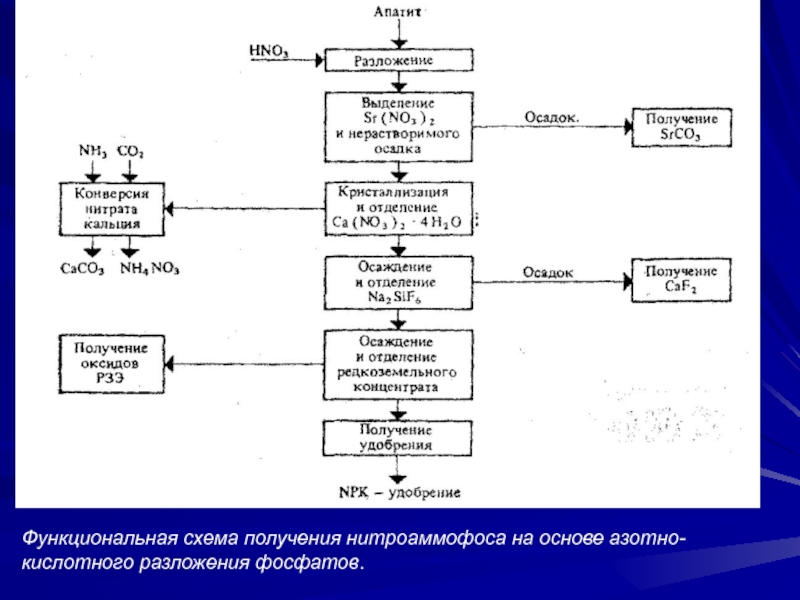
Слайд 29Азотнокислотное разложение фосфатов
Прогрессивным направлением в переработке фосфатного сырья является применение
метода азотнокислотного разло-жения апатитов и фосфоритов. Этот метод позволяет использовать
азотную кислоту не только как средство для разложения, нерастворимых средних фосфатов в растворимую форму, но и как дополнительный источник питательных элементов. На основе азотнокислотногоразложения фосфатов обычно получают сложные NP- или NPK-удобрения. В основе процесса разложения фосфатов азотной кислотой лежит реакция
Ca5F(PO4)3 +10HNO3 = 3H3PO4+ 5Ca(NO3)2+ HF в результате проведения которой образуется азотнокислотная вытяжка — раствор, содержащий нитрат кальция и свободная фосфорная к-та. Во многих процессах вытяжку нейтрализуют аммиаком, получая фосфаты
аммония (NP-удобрения). Если перед гранулированием нейтрализован-ной пульпы к ней добавляют соли калия (КСl, K2SO4), то получают тройное NPK-удобрение — нитроаммофоску. Во многих процессах азотнокислотной переработки фосфатов нитрат кальция Ca(NO3)2,образующийся по реакции, удаляют из реакционной смеси вымораживанием.
Азотнокислотный метод разложения фосфатов позволяет наряду с получением NPK-удобрений попутно выделить из сырья
такие ценные вещества, как стронций, редкоземельные элементы и др.
Слайд 30Функциональная схема получения нитроаммофоса на основе азотно-кислотного разложения фосфатов.
Слайд 31Производство азотных удобрений
Важнейшим видом минеральных удобрений являются азотные: аммиачная селитра,
карбамид,
сульфат аммония, водные растворы аммиака и др. Азоту принадлежит исключительно
важная роль вжизнедеятельности растений; он входит в состав хлорофилла, являющегося акцептором солнечной
энергии, и белка, необходимого для построения живой клетки. Растения могут потреблять только
связанный азот — в форме нитратов, солей аммония или амидов. Сравнительно небольшие количества связанного азота образуются из атмосферного за счет деятельности почвенных микроорганизмов.
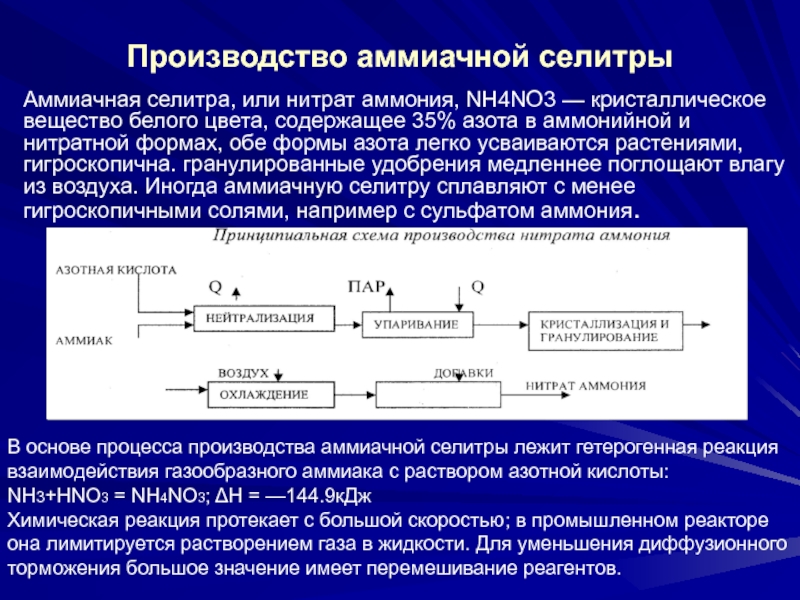
Слайд 32Производство аммиачной селитры
Аммиачная селитра, или нитрат аммония, NH4NO3 — кристаллическое
вещество белого цвета, содержащее 35% азота в аммонийной и нитратной
формах, обе формы азота легко усваиваются растениями, гигроскопична. гранулированные удобрения медленнее поглощают влагу из воздуха. Иногда аммиачную селитру сплавляют с менее гигроскопичными солями, например с сульфатом аммония.В основе процесса производства аммиачной селитры лежит гетерогенная реакция
взаимодействия газообразного аммиака с раствором азотной кислоты:
NH3+HNO3 = NH4NO3; ΔН = —144.9кДж
Химическая реакция протекает с большой скоростью; в промышленном реакторе она лимитируется растворением газа в жидкости. Для уменьшения диффузионного торможения большое значение имеет перемешивание реагентов.
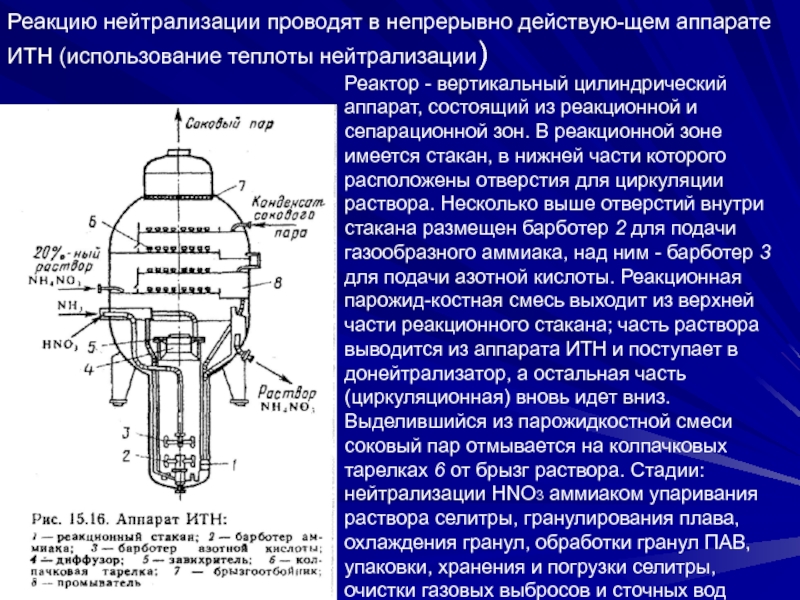
Слайд 33Реакцию нейтрализации проводят в непрерывно действую-щем аппарате ИТН (использование теплоты
нейтрализации)
Реактор - вертикальный цилиндрический аппарат, состоящий из реакционной и сепарационной
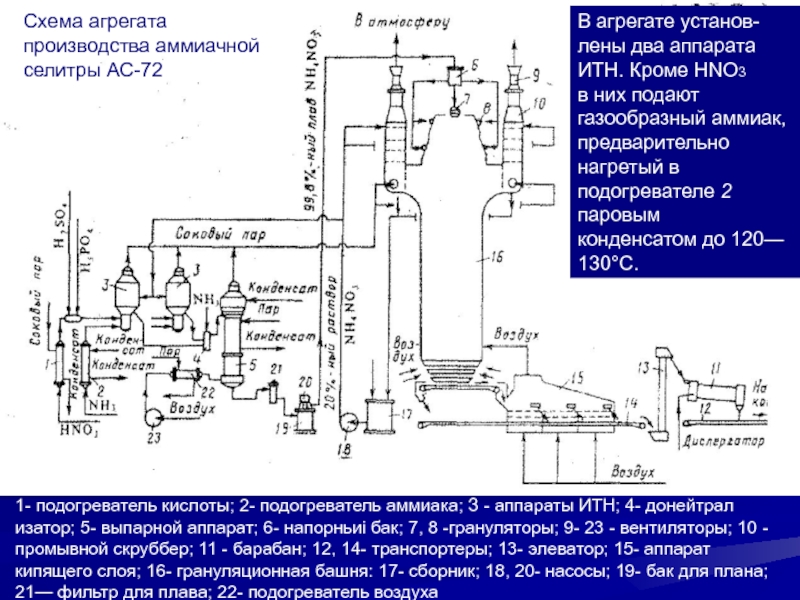
зон. В реакционной зоне имеется стакан, в нижней части которого расположены отверстия для циркуляции раствора. Несколько выше отверстий внутри стакана размещен барботер 2 для подачи газообразного аммиака, над ним - барботер 3 для подачи азотной кислоты. Реакционная парожид-костная смесь выходит из верхней части реакционного стакана; часть раствора выводится из аппарата ИТН и поступает в донейтрализатор, а остальная часть (циркуляционная) вновь идет вниз. Выделившийся из парожидкостной смеси соковый пар отмывается на колпачковых тарелках 6 от брызг раствора. Стадии: нейтрализации HNO3 аммиаком упаривания раствора селитры, гранулирования плава, охлаждения гранул, обработки гранул ПАВ, упаковки, хранения и погрузки селитры, очистки газовых выбросов и сточных водСлайд 341- подогреватель кислоты; 2- подогреватель аммиака; З - аппараты ИТН;
4- донейтрал изатор; 5- выпарной аппарат; 6- напорньиi бак; 7,
8 -грануляторы; 9- 23 - вентиляторы; 10 - промывной скруббер; 11 - барабан; 12, 14- транспортеры; 13- элеватор; 15- аппарат кипящего слоя; 16- грануляционная башня: 17- сборник; 18, 20- насосы; 19- бак для плана; 21— фильтр для плава; 22- подогреватель воздухаВ агрегате установ-лены два аппарата ИТН. Кроме HNO3
в них подают газообразный аммиак, предварительно нагретый в подогревателе 2 паровым
конденсатом до 120— 130°С.
Схема агрегата производства аммиачной селитры АС-72
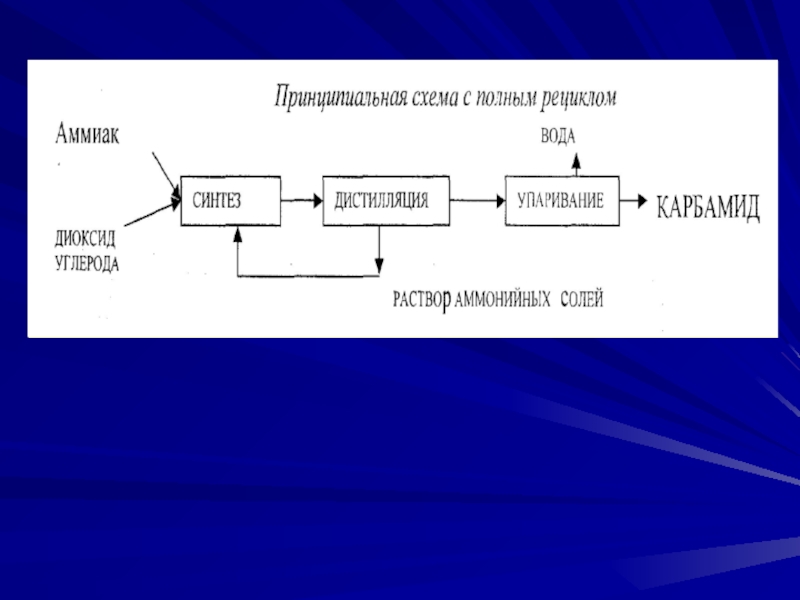
Слайд 35Производство карбамида (мочевины). Занимает второе место по объему производства после
аммиачной селитры. Рост производства обусловлен широкой сферой его применения в
с/х. Он обладает большей устойчивостью к выщелачиванию по сравнению с другими азотными удобрениями, т. е. менее подвержен вымыванию из почвы, менее гигроскопичен, может применяться не только как удобрение, но и в качестве добавки к корму КРС.Карбамид широко используется для получения сложных удобрений, удобрений с регулируемым сроком действия, а также для получения пластмасс, клеев, лаков и покрытий.
Карбамид CO(NH2)2 — белое кристаллическое вещество, содержащее 46,6% азота. Его получение основано на реакции взаимодействия аммиака с диоксидом углерода:
2NH3 + CO2↔ CO(NH2)2 + H2O; ΔН = —110.1 кДж (I)
Сырьем для производства карбамида служат аммиак и диоксид углерода, получаемый в качестве побочного продукта при производстве технологического газа для синтеза аммиака. Поэтому производство карбамида на химических заводах обычно комбинируют с производством аммиака.
Реакция в 2 стадии.На первой происходит синтез карбамата:
2NH3(г) + CO2(г) ↔ NH2СОО NH4(ж); ΔН =–125,6кДж (2)
На второй протекает эндотерм. процесс отщепления воды от молекул карбамата, в результате которого и происходит образование карбамида:
NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2 O (ж) ; ΔН =15,5кДж (3)
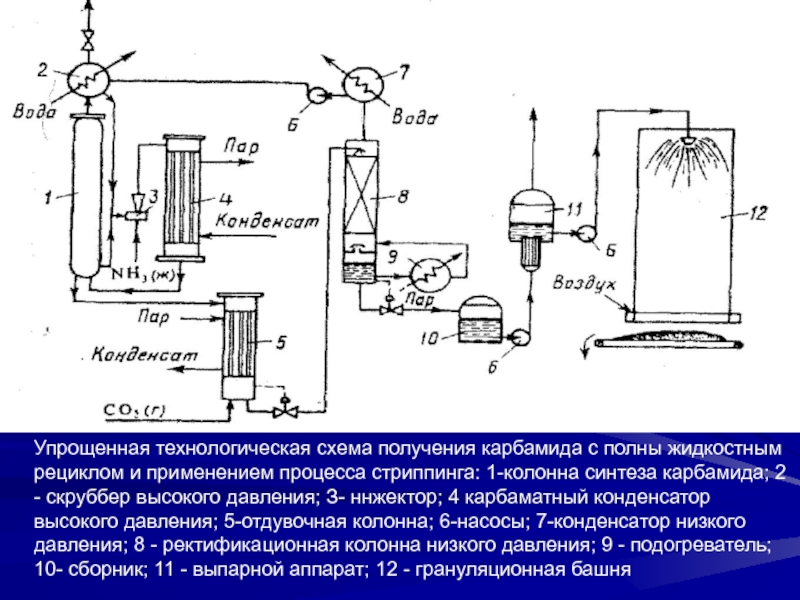
Слайд 36Упрощенная технологическая схема получения карбамида с полны жидкостным рециклом и
применением процесса стриппинга: 1-колонна синтеза карбамида; 2 - скруббер высокого
давления; З- ннжектор; 4 карбаматный конденсатор высокого давления; 5-отдувочная колонна; 6-насосы; 7-конденсатор низкого давления; 8 - ректификационная колонна низкого давления; 9 - подогреватель; 10- сборник; 11 - выпарной аппарат; 12 - грануляционная башняСлайд 38Производство сульфата аммония
Сульфат аммония (NН4)2SО4 – б/ц кристаллическое вещество, содержит
21.21% азота, при нагревании до 5130С полностью разлагается на аммиак
и серную кислоту; частичное разложение с образованием кислых солей начинается выше 2000С. (NН4)2SО4 применяется исключительно в качестве удобрения. Это удобрение обладает небольшой гигроскопичностью, мало слеживается, и вне-сение его в почву не вызывает затруднений. Недостатком является большая физиологическая кислотность.Основные промышленные способы производства (NН4)2SО4 базируются нанейтрализации серной кислоты аммиаком. Для производства сульфата аммония используют аммиак, содержащийся в газах сухой перегонки каменного угля в коксохимической и газовой промышленности, а также синтетический аммиак. Сульфат аммония получают также, обрабатывая гипс растворами карбоната аммония и из растворов, являющихся отходами производства капролактама, используемого для получения капрона.
Сульфат аммония получается по реакции
2NН3 (газ) +Н2SО4 =(NН4)2SО4 +280 кДж
путем нейтрализации газообразного аммиака серной кислотой. При мокром способе производства продукт кристаллизуется из пересыщенных растворов, при сухом – мелкие брызги серной кислоты нейтрализуются в газообразном аммиаке. При насыщении аммиаком серной кислоты в реакционном аппарате выделяется большое количество тепла, достаточное
для нагрева реакционной смеси до температуры кипения и для испарения из нее значительного количества воды. При сухом способе производства вода испаряется практически полностью.
При мокром способе важно обеспечить кристаллизацию из горячего реакционного раствора средней соли, не допуская выделения кислых солей.
Слайд 39Производство нитрата кальция ( известковая или кальциевая селитра)
Безводная соль плавится
при Т 5610С, при 5000С начинается ее разложение с потерей
кислорода и образованием нитрита кальция, который далее распадается на СаО и оксиды азота. Как безводная соль, так и кристаллогидраты нитрата кальция сильно гигроскопичны и на воздухе «расплываются».Кальциевая селитра является универсальным физиологически щелочным удобрением, пригодным для всех почв и, прежде всего, для почв нечерноземной полосы с недостаточным содержанием кальция. Кальциевую селитру получают различными способами:
1) взаимодействием мела или известняка с азотной кислотой;
2) поглощением нитрозных газов известковым молоком с последующей инверсией полученных растворов азотной кислотой;
3) в качестве побочного продукта при азотнокислотной переработке фосфатов.
Кислотность раствора понижается до 1.5-1.9% НNО3, его отводят на донейтрализацию аммиаком или известью-пушонкой Са(ОН)2. При нейтрализации аммиаком образуется некоторое количество нитрата аммония, примесь которого облегчает последующую кристаллизацию нитрата кальция из плава. Нейтрализованный вязкий раствор нитрата кальция фильтруют на фильтр-прессах. Раствор, содержащий 43-49% Са(NО3)2 и 3% NН4NО3, выпаривают в вакуум- аппаратах до концентрации 75-82% СаNО3. Получаемый плав кальциевой селитры, кристаллизуют на охлаждающих вальцах или в грануляционной башне.