Слайд 1ОСНОВЫ ДИЗАЙНА
ФУНКЦИОНАЛЬНЫХ МАТЕРИАЛОВ
Слайд 2Диза́йн (англ. design инженер-конструктор, от лат. designare отмерять) — творческая деятельность, целью которой
является определение формальных качеств промышленных изделий. Эти качества включают и
внешние черты изделия, но главным образом те структурные и функциональные взаимосвязи, которые превращают изделие
единое целое как с точки зрения потребителя, так и с точки зрения изготовителя. Дизайн стремится охватить все аспекты окружающей человека среды, которая обусловлена промышленным производством.
Слайд 3В сентябре 1969 года на конгрессе Международного совета организаций по
дизайну (ИКСИД) было принято следующее определение: «Под термином дизайн понимается
творческая деятельность, цель которой определение формальных качеств предметов, производимых промышленностью. Эти качества формы относятся не только к внешнему виду, но главным образом к структурным и функциональным связям, которые превращают систему в целостное единство с точки зрения, как изготовителя, так и потребителя».
Слайд 4Основные категории объекта дизайна
Образ — идеальное представление об объекте, художественно-образная модель,
созданная воображением дизайнера.
Функция — работа, которую должно выполнять изделие, а
также смысловая, знаковая и ценностная роли вещи.
Морфология — строение, структура формы изделия, организованная в соответствии с его функцией, материалом и способом изготовления, воплощающая замысел дизайнера.
Технологическая форма — морфология, воплощенная в способе промышленного производства вещи-объекта дизайн-проектирования в результате художественного осмысления технологии.
Эстетическая ценность — особое значение объекта, выявляемое человеком в ситуации эстетического восприятия, эмоционального, чувственного переживания и оценки степени соответствия объекта эстетическому идеалу субъекта.
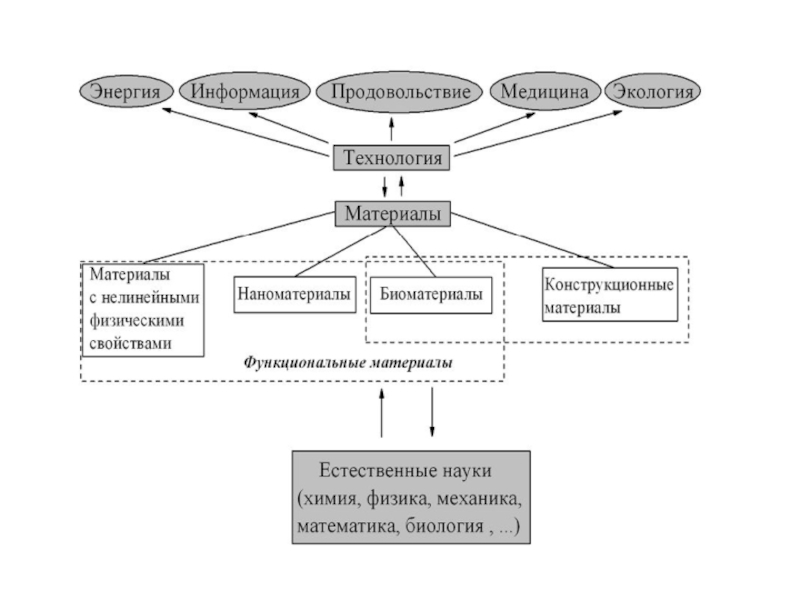
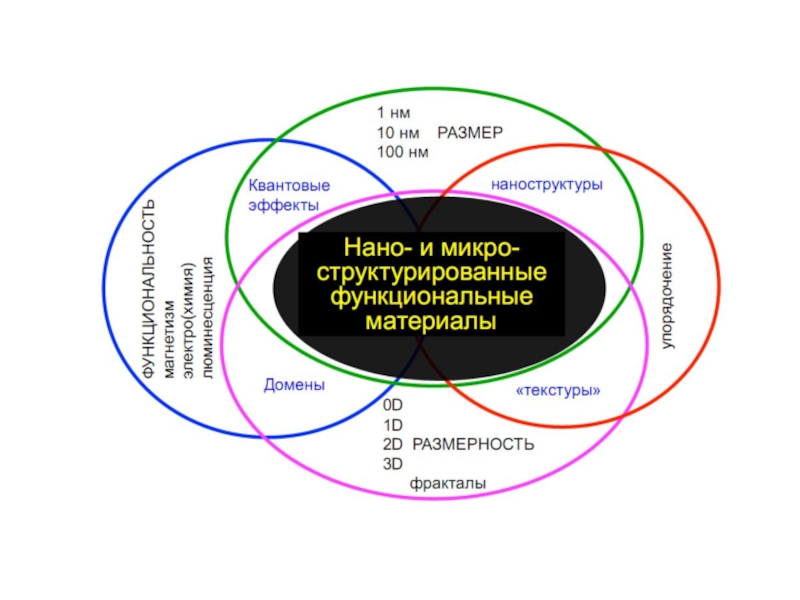
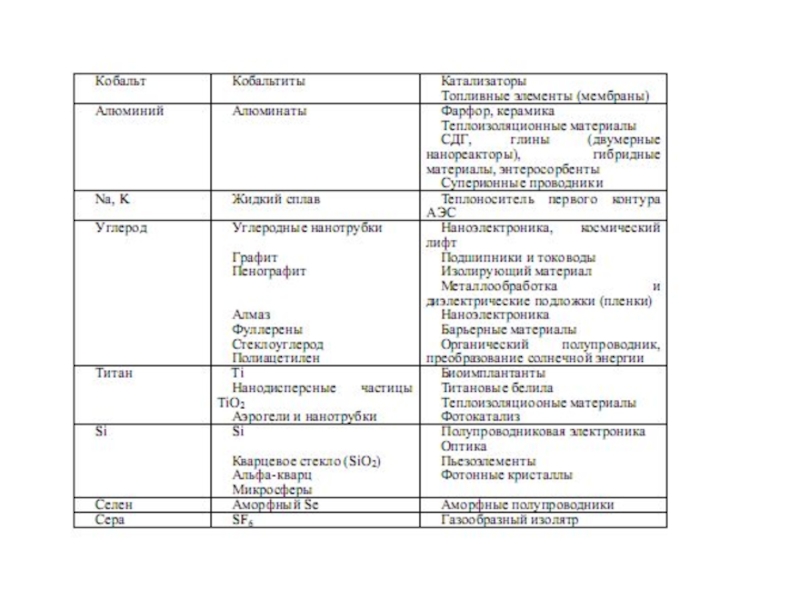
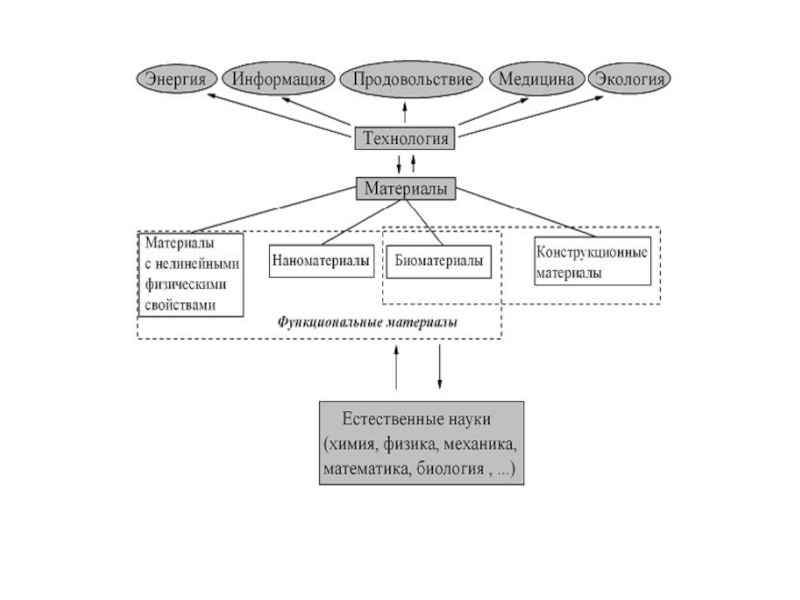
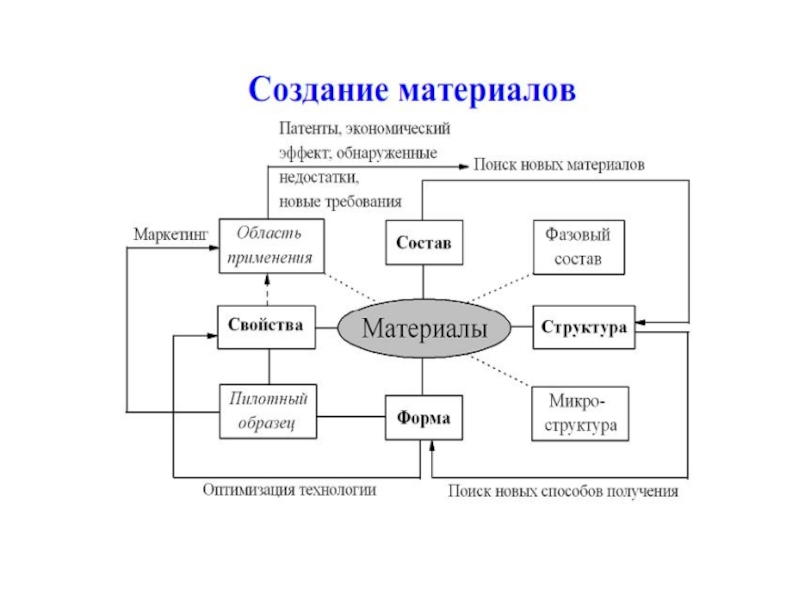
Слайд 5Наука о материалах – это современная междисциплинарная область знаний о
получении и свойствах веществ, обладающих практически –важными физическими, химическими и
биологическими свойствами, которая включает в себя фундаментальные знания о химии, физике, математике и механике, биологии и медицине, а также богатейший опыт их использования в конкретных практически важных ситуациях
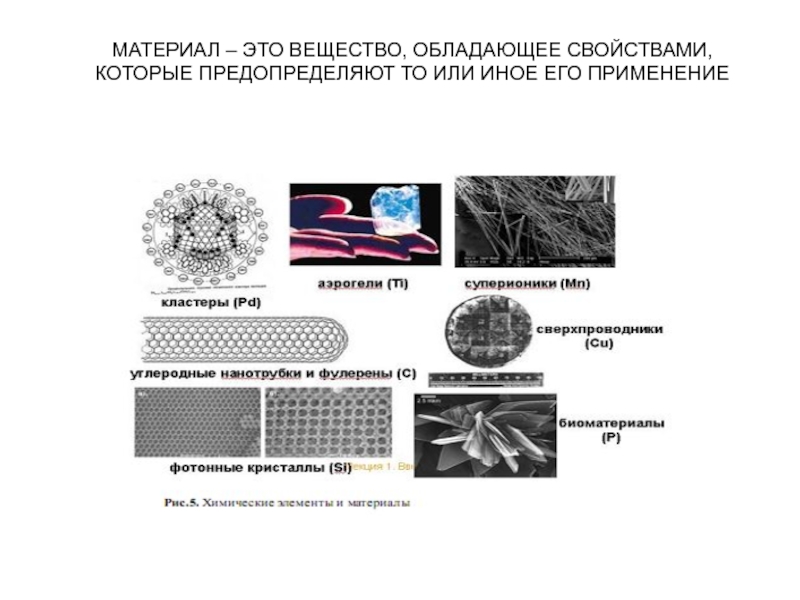
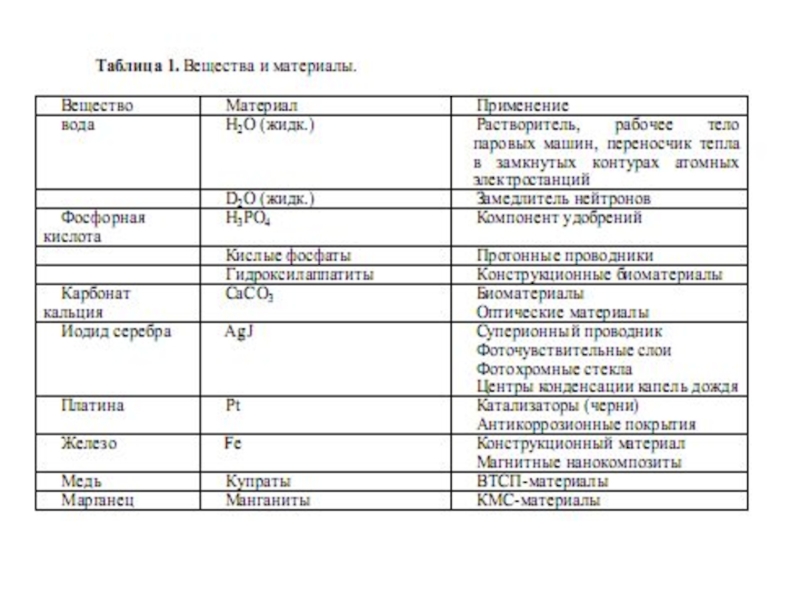
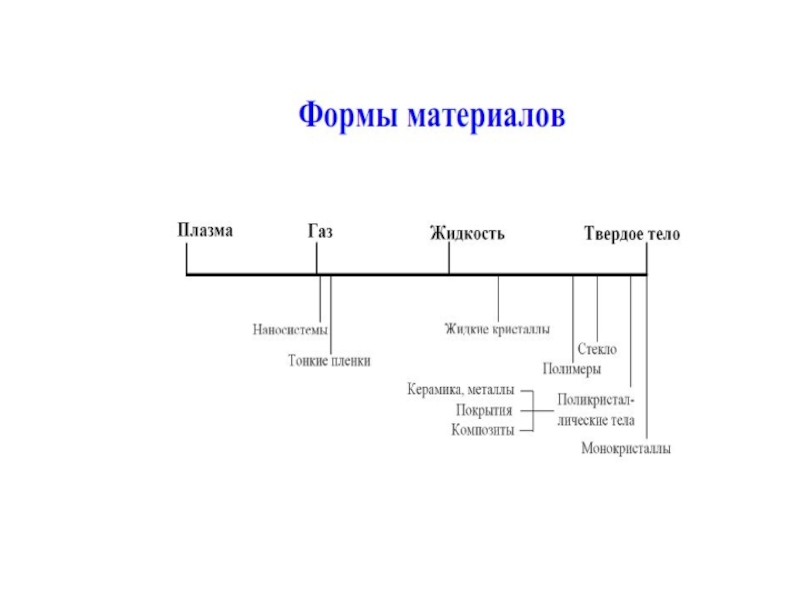
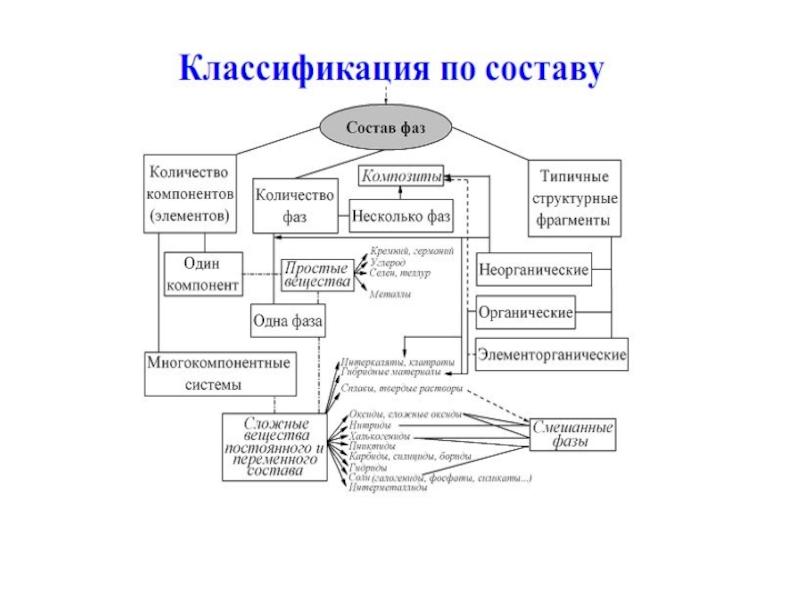
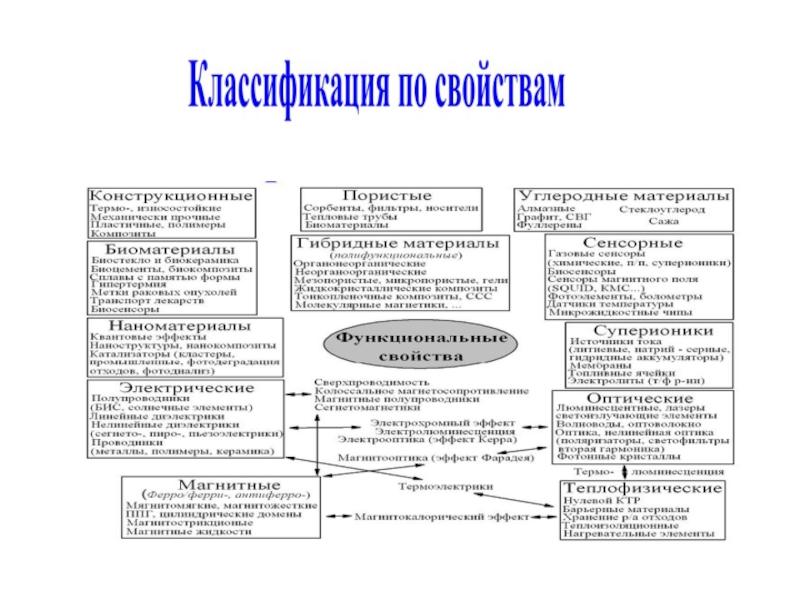
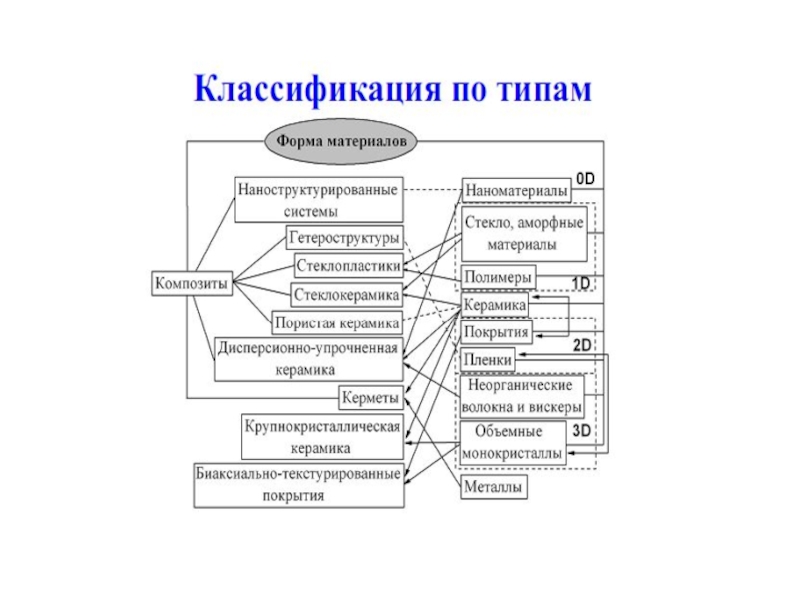
Слайд 6МАТЕРИАЛ – ЭТО ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ СВОЙСТВАМИ, КОТОРЫЕ ПРЕДОПРЕДЕЛЯЮТ ТО ИЛИ
ИНОЕ ЕГО ПРИМЕНЕНИЕ
Слайд 32Неравновесные процессы могут реализовываться в любых - изолированных, закрытых, открытых
- системах, отличающихся друг от друга отношением к окружающей среде
и, как следствие, характером эволюции. Для любой системы полное изменение энтропии складывается из двух величин: dS = deS + diS, где deS - изменение энтропии за счет обмена с окружающей средой, а diS - изменение энтропии внутри самой системы, которое для неравновесного состояния всегда положительно.
В изолированной системе, не способной обмениваться с окружающей средой ни веществом, ни энергией deS = 0, а dS = diS > 0. Следовательно, в изолированной системе самопроизвольность процесса определяется стремлением к увеличению энтропии, которая становится максимальной при достижении равновесия. Примером таких необратимых процессов, реализуемых в изолированных системах, могут служить процессы смешения, диффузии, загрязнения особо чистых веществ. Система становится «однородной» и в ней не образуются упорядоченные структуры.
Слайд 33В закрытых системах, способных обмениваться с окружающей средой энергией, но
не веществом, самопроизвольность происходящих процессов определяется стремлением к уменьшению энергии
Гиббса, dS = deS + diS, ΔG= ΔH - TΔS < 0. При прочих равных условиях увеличении энтропии в каком-либо процессе приводит к уменьшению свободной энергии. Это, в свою очередь, означает, что в закрытых системах при повышении температуры от 0 К неизбежны процессы дефектообразования, безразлично, что является источником увеличения энтропии - свободная поверхность, дислокации или точечные дефекты. В зависимости от конкретных условий формирующийся кристалл приобретает тот вид дефектов, который при наименьших энергетических затратах обеспечивает максимальное увеличение энтропии.
Слайд 34При понижении температуры в закрытой системе энтропия может понижаться, то
есть могут самопроизвольно происходить процессы упорядочения, процессы образования упорядоченных структур,
например, кристаллизация, рекристаллизация при спекании поликристаллических систем, мартенситовые превращения, спинодальный распад, образование магнитных или cегнето -электрических доменов при охлаждении соответствующих материалов, гидратация ионов, комплексообразование, кластеро -образование, образования молекулярных кристаллов в результате проявления сил Ван-дер-Ваальса, формирование клатратов и супрамолекулярных соединений, самосборка двойной спирали ДНК и т.д.
В открытых системах существует обмен с окружающей средой как веществом, так и энергией. В таких системах может возникать - стационарное состояние, которое может существовать бесконечно долго при достижении взаимного баланса различных кинетических процессов.
Слайд 35Если (отрицательный) поток энтропии в окружающую среду превышает ее производство
внутри системы, то полное изменение энтропии будет отрицательно
dSi
Локальное производство
энтропии
dSe
Поток энтропии
Слайд 41ксерогель (xerogel) — продукт сушки аква- или алкогелей при атмосферном
давлении в достаточно жестких условиях, приводящих к коллапсу (схлопыванию) макропор
и значительному увеличению плотности материала.
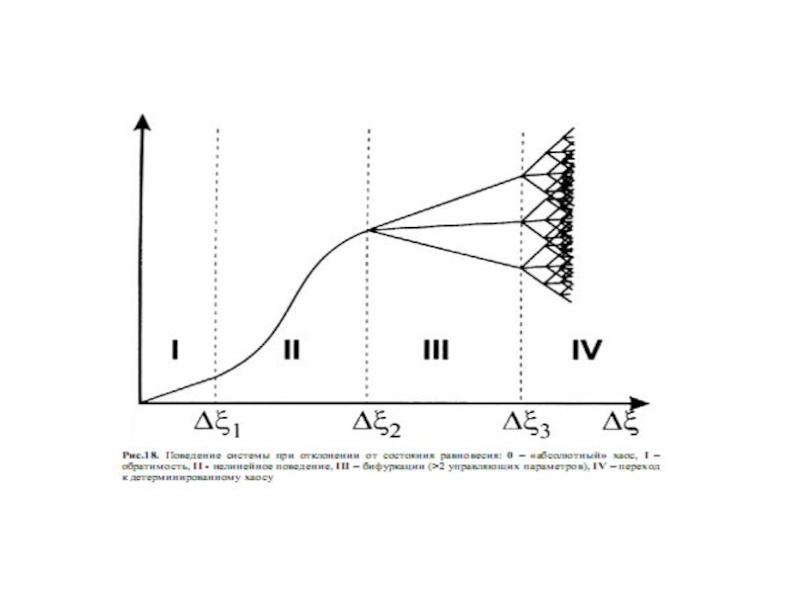
Слайд 47Диссипативные структуры могут образовываться только в открытых системах. Только в
них возможен приток энергии, компенсирующий потери за счет диссипации и
обеспечивающий существование более упорядоченных состояний. При этом отклонение от равновесия должно превышать критическое значение, должны существовать управляющие параметры или их набор, при критическом значении которых происходит бифуркация состояния системы.
Флуктуации в точке бифуркации возрастают до макроскопического уровня.
Диссипативные структуры возникают в макроскопических системах, то есть в системах, состоящих из большого числа элементов (атомов, молекул, макромолекул, клеток и т.д.).
Благодаря этому возможны коллективные - синергетические взаимодействия, необходимые для перестройки системы. Таким образом, объем системы должен быть достаточно велик и превосходить некоторую критическую величину, обеспечивающую необходимое количество незатухающих флуктуаций, взаимодействие которых создает упорядочение в системе. В ходе эволюции энтропия убывает - в этом основное содержание S-теоремы (Ю.Л.Климонтович).
Слайд 48Диссипативные структуры возникают лишь в системах, описываемых нелинейными уравнениями для
макроскопических функций. Примерами могут служить кинетические уравнения, например уравнение Больцмана,
уравнения газовой динамики и гидродинамики.
Для возникновения диссипативных структур нелинейные уравнения должны при определенных значениях управляющих параметров допускать изменение симметрии решения.
Переход диссипативной системы в упорядоченное состояние связан с неустойчивостью предыдущего, неупорядоченного, состояния. С переходом в упорядоченное структурное состояние система приобретает новый способ функционирования, обеспечивающий ее устойчивость.
Слайд 49Бифурка́ция
Бифурка́ция — термин происходит от лат. bifurcus — «раздвоенный» и
употребляется в широком смысле для обозначения всевозможных качественных перестроек или
метаморфоз различных объектов при изменении параметров, от которых они зависят.
Точка бифуркации — смена установившегося режима работы системы. Термин из неравновесной термодинамики и синергетики.
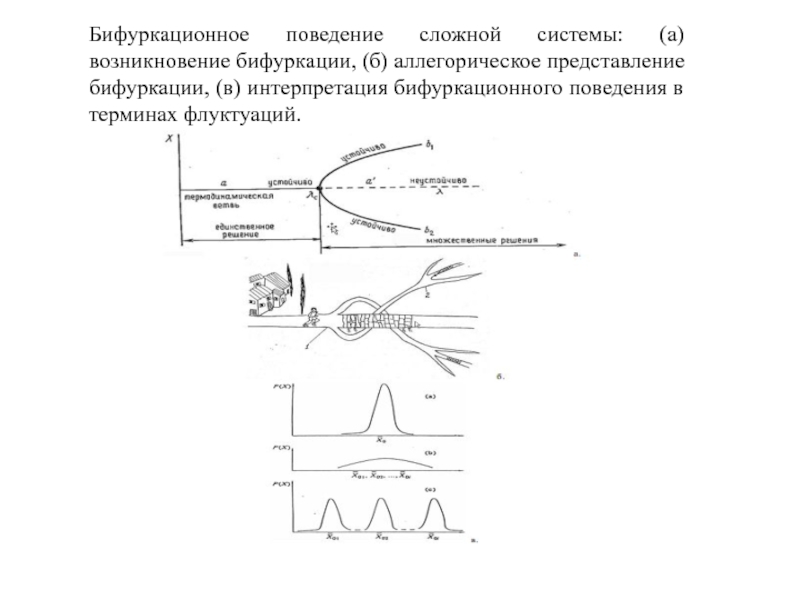
Слайд 52Бифуркационное поведение сложной системы: (а) возникновение бифуркации, (б) аллегорическое представление
бифуркации, (в) интерпретация бифуркационного поведения в терминах флуктуаций.
Слайд 59
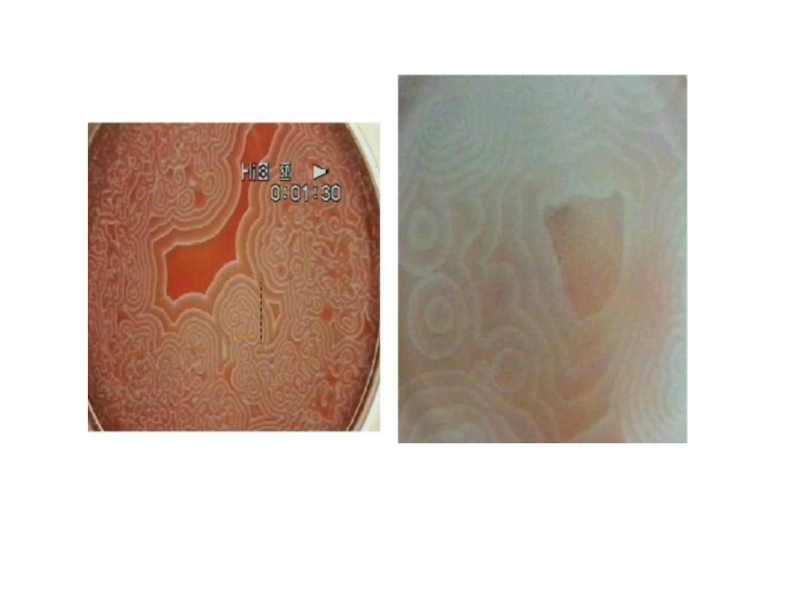
Реакция Белоусова—Жаботинского — класс химических реакций, протекающих в колебательном режиме,
при котором некоторые параметры реакции (цвет, концентрация компонентов, температура и
др.) изменяются периодически, образуя сложную пространственно-временную структуру реакционной среды.
В настоящее время под этим названием объединяется целый класс родственных химических систем, близких по механизму, но различающихся используемыми катализаторами (Ce 3+, Mn 2+ и комплексы Fe2+, Ru 2+), органическими восстановителями (малоновая кислота, броммалоновая кислота, лимонная кислота, яблочная кислота и др.) и окислителями (броматы, иодаты и др.). При определенных условиях эти системы могут демонстрировать очень сложные формы поведения от регулярных периодических до хаотических колебаний и являются важным объектом исследования универсальных закономерностей нелинейных систем. В частности, именно в реакции Белоусова — Жаботинского наблюдался первый экспериментальный странный аттрактор в химических системах и была осуществлена экспериментальная проверка его теоретически предсказанных свойств.
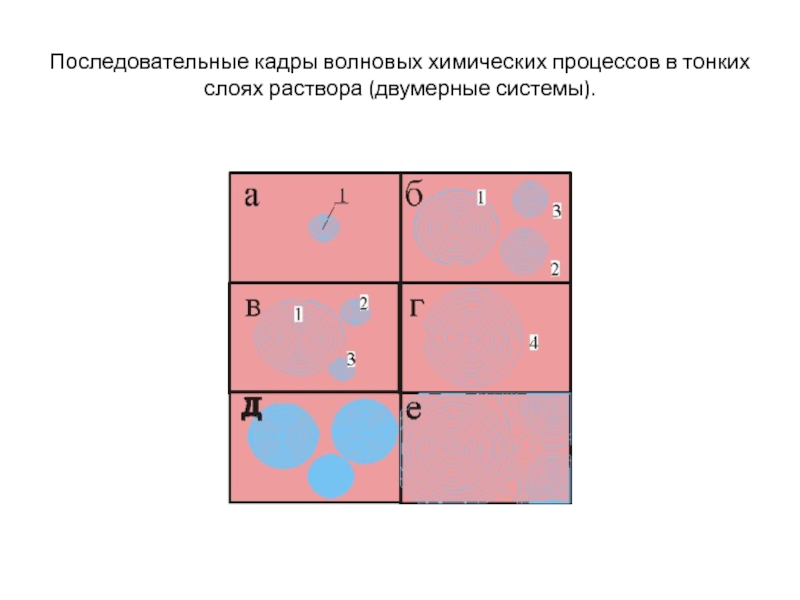
Слайд 60Последовательные кадры волновых химических процессов в тонких слоях раствора (двумерные
системы).
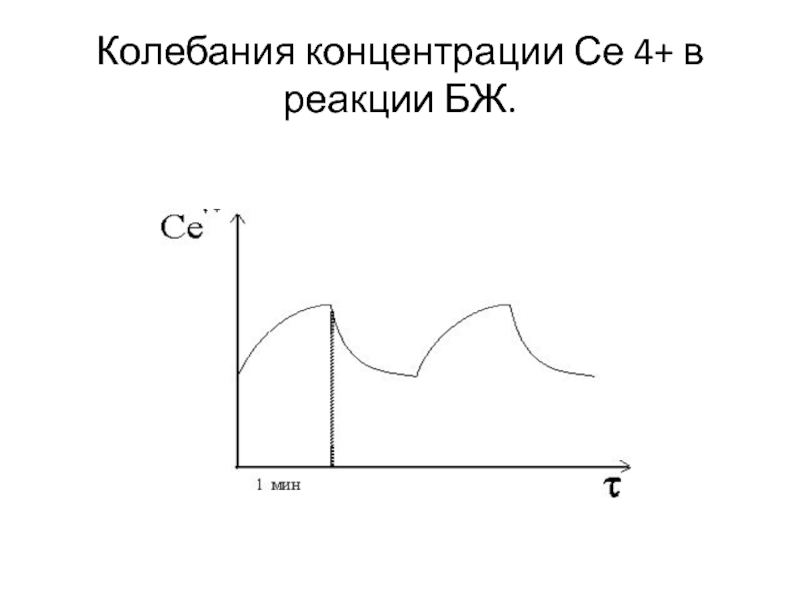
Слайд 61В упрощенной схеме реакция Белоусова состоит из двух стадий. В
первой стадии трехвалентный церий Ce3+ (розовый цвет) окисляется бромноватой кислотой
HBrО3, что приводит к избытку ионов Се4+ (голубой цвет): Се3+ →Се4+.
Во второй стадии четырехвалентный церий Се4+ восстанавливается органическим cоединением - малоновой кислотой (МК)
Периодический процесс прекращается после большого числа периодов из-за необратимого расходования бромата BrO3-.
Слайд 63Колебания концентрации Се 4+ в реакции БЖ.