Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы физики атома
Содержание
- 1. Основы физики атома
- 2. Основы физики атома Модель атома Томсона Опыты
- 3. Сэр Джозеф Джон Томсон (1856 —1940) —
- 4. Модель атома РезерфордаЭрнест Резерфорд Ernest Rutherford1871 -
- 5. Модель атома Резерфорда
- 6. Модель атома Резерфорда
- 7. Выводы:Атом практически “пустой”: его масса и положительный
- 8. Планетарная модель Резерфорда
- 9. Затруднения модели РезерфордаУравнение движения содержит два неизвестных:
- 10. Линейчатые спектры атомов. Формула Бальмерачастот спектральных линий:Длинноволновая
- 11. R = 3,29·1015 Гц – постоянная Ридберга. Для ультрафиолетовой серии
- 12. Комбинационный принцип РитцаСогласно экспериментальным данным, полученным к
- 13. Модель атома Бора. 1913 г. Нильс Бор
- 14. Постулаты Бора
- 15. Постулат стационарных состояний Атомная система
- 16. Условие квантования момента импульса (правило орбит)
- 17. Постулат частот При переходе атома
- 18. Опыт Франка-Герца1913 гТрехэлектродная лампа заполнена газом, например,
- 19. Опыт Франка-ГерцаПри T ~ 4.9 эВ происходят
- 20. Опыт Франка-ГерцаЛампа испускает ультрафиолетовый свет. Излучение начинается,
- 21. Модель атома Бора
- 22. Атом водорода по Бору
- 23. Спектральные закономерностиПереходы на общий нижний уровень образуют
- 24. Слайд 24
- 25. ВыводыВ связанных состояниях скорость вращения, радиус орбиты
- 26. Энергетический спектр атома водородаПоследовательность энергетических уровней, определяемых главным квантовым числом n.
- 27. Принцип соответствияПринцип соответствия законов микро- и макромира
- 28. Состояния атома, в котором один из электронов
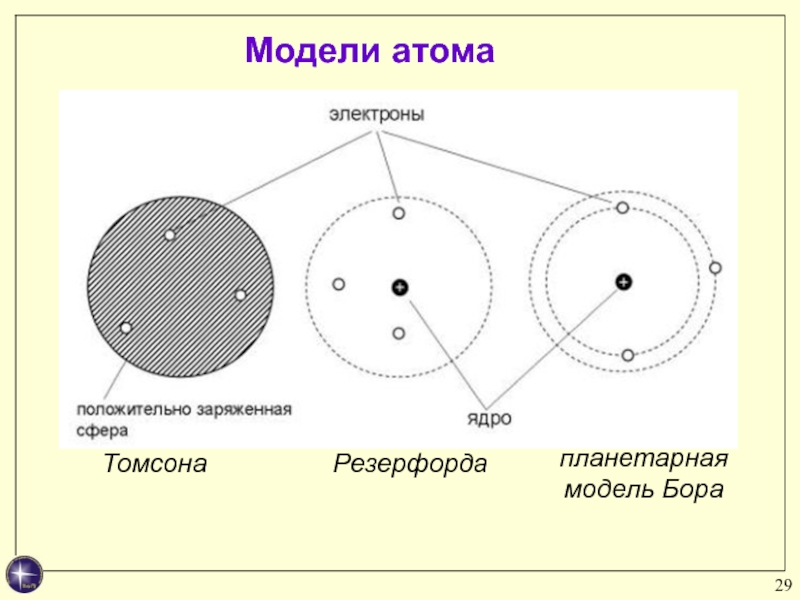
- 29. планетарная модель БораМодели атомаТомсонаРезерфорда
- 30. Модели атомаСовременная модель атома является развитием планетарной
- 31. ВыводыТеория Бора имеет историческое значение: пользуется классическими
- 32. Квантово-механическое описание атомовСтационарное уравнение Шредингера для атома
- 33. Стационарное уравнение Шредингера для атома водородаПотенциальная энергия
- 34. Стационарное уравнение Шредингера для атома водородаЭнергия ионизации
- 35. Волновые функции и квантовые числаудовлетворяют собственные функции
- 36. Волновые функции и квантовые числаОрбитальное квантовое число
- 37. Волновые функции и квантовые числаМагнитное квантовое число
- 38. Эффект ЗееманаРасщепление уровней энергии во внешнем электрическом
- 39. Квантовые числаСпиновое квантовое число sописывает собственный угловой
- 40. Схема установки, на которой Штерн и Герлах
- 41. ВыводыСостояние электрона в атоме однозначно определяется набором
- 42. Радиальная электронная плотность вероятности в виде
- 43. Совокупность электронов в многоэлектронном атоме, имеющих одно
- 44. Состояние электрона, характеризующееся квантовыми числами l =
- 45. Вид основных типов орбиталей
- 46. Распределение электронов по оболочкам и подоболочкам
- 47. Слайд 47
- 48. Физический смысл порядкового номера
- 49. Объяснение строения периодической
- 50. Периодическая система элементов Д. И. Менделеева (1869) http://ens.tpu.ru/POSOBIE_FIS_KUSN/%CA%E2%E0%ED%F2%EE%E2%E0%FF%20%EE%EF%F2%E8%EA%E0.%20%C0%F2%EE%EC%ED%E0%FF%20%E8%20%FF%E4%E5%F0%ED%E0%FF%20%F4%E8%E7%E8%EA%E0.%20%D4%E8%E7%E8%EA%E0%20%FD%EB%E5%EC%E5%ED%F2%E0%F0%ED%FB%F5%20%F7%E0%F1%F2%E8%F6/08-3.htm
- 51. Правила отбораограничивают число возможных переходов электронов в
- 52. В атоме водорода есть состояние (2s), переход
- 53. Квантовая теория прекрасно описывает экспериментальные результаты;
- 54. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Основы физики атома
Модель атома Томсона
Опыты Резерфорда. Ядерная модель
атома
Линейчатые спектры атомов. Формула Бальмера. Комбинационный принцип Ритца
Постулаты
Бора. Принцип соответствияОпыт Франка-Герца
Квантовые числа одноэлектронного атома и их физический смысл
Принцип Паули. Фермионы и бозоны
Рентгеновское излучение
Лекция 10
Слайд 3Сэр Джозеф Джон Томсон (1856 —1940) — английский физик, открывший
электрон, лауреат Нобелевской премии по физике 1906 года.
Томсон предположил, что
атомы состоят из положительно заряженной сферы, в которую вкраплены электроны. Эта модель атома получила среди ученых прозвище "сливовый пудинг", хотя не менее похожа и на булочку с изюмом (где "изюминки" - это электроны), или на "арбуз" с "семечками" - электронами.Модель атома Томсона
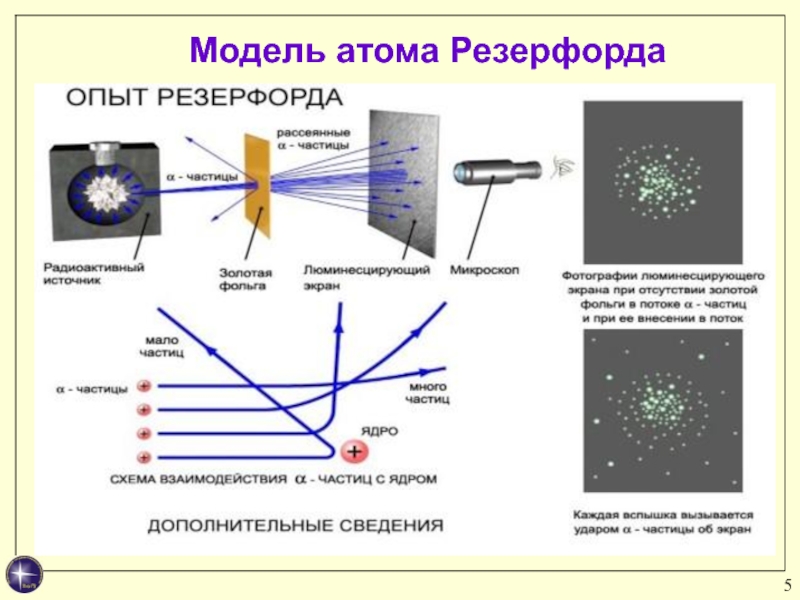
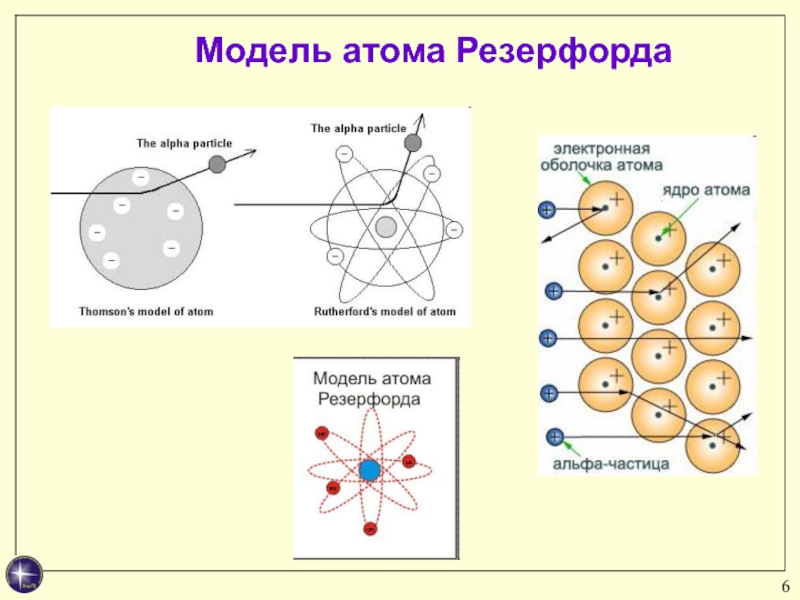
Слайд 4Модель атома Резерфорда
Эрнест Резерфорд
Ernest Rutherford
1871 - 1937
Английский физик, один
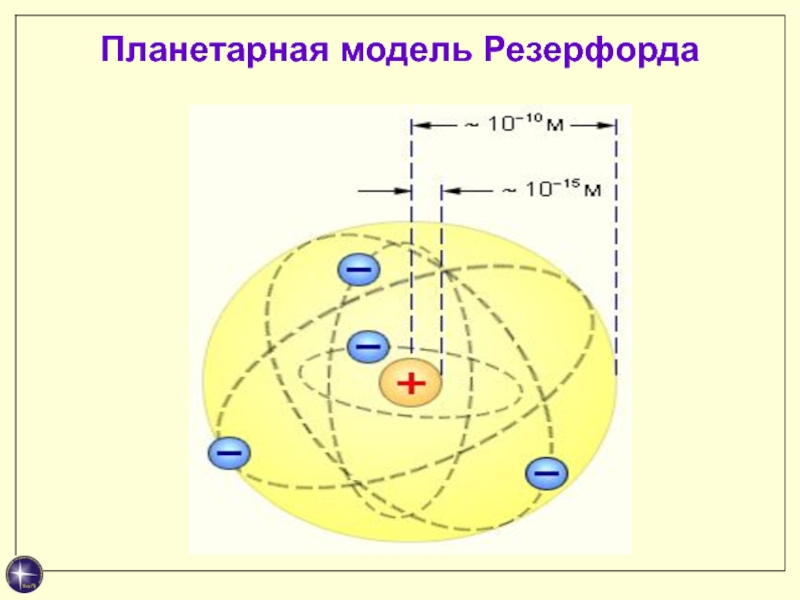
из создателей учения о радиоактивности и строении атома. Предложил (1911)
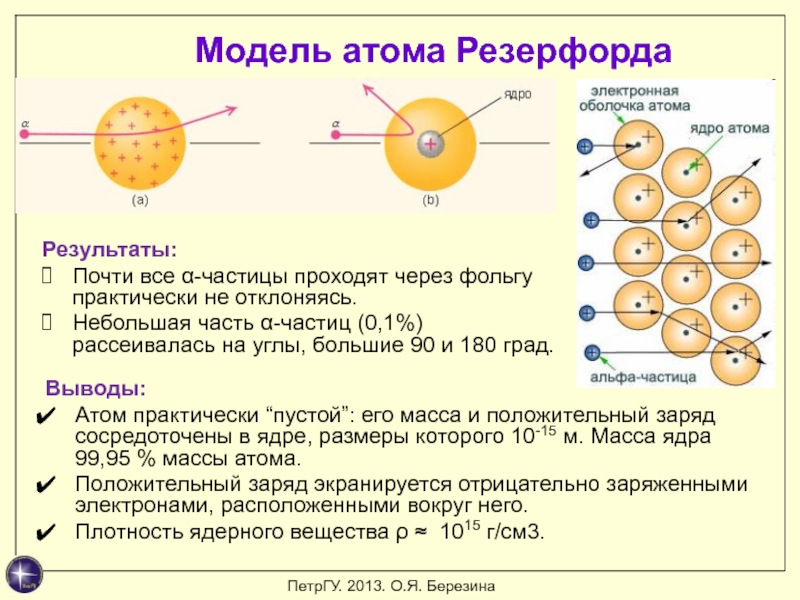
планетарную модель атома. Ноб. пр. по химии (1908).Слайд 7Выводы:
Атом практически “пустой”: его масса и положительный заряд сосредоточены в
ядре, размеры которого 10-15 м. Масса ядра 99,95 % массы атома.
Положительный
заряд экранируется отрицательно заряженными электронами, расположенными вокруг него. Плотность ядерного вещества ρ ≈ 1015 г/см3.
Модель атома Резерфорда
Результаты:
Почти все α-частицы проходят через фольгу практически не отклоняясь.
Небольшая часть α-частиц (0,1%) рассеивалась на углы, большие 90 и 180 град.
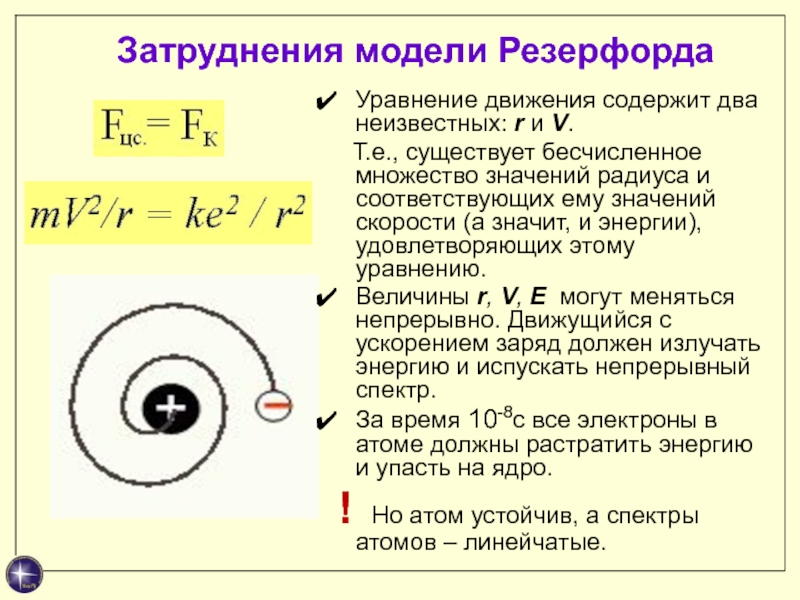
Слайд 9Затруднения модели Резерфорда
Уравнение движения содержит два неизвестных: r и V.
Т.е., существует бесчисленное множество значений радиуса и соответствующих
ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Величины r, V, Е могут меняться непрерывно. Движущийся с ускорением заряд должен излучать энергию и испускать непрерывный спектр.
За время 10-8с все электроны в атоме должны растратить энергию и упасть на ядро.
! Но атом устойчив, а спектры атомов – линейчатые.
Слайд 10Линейчатые спектры атомов. Формула Бальмера
частот спектральных линий:
Длинноволновая граница серии: n
= m+1
Коротковолновая граница : при n→∞.
n > m
Слайд 11R = 3,29·1015 Гц – постоянная Ридберга.
Для ультрафиолетовой серии (серия Лаймана) m = 1,
n = 2, 3, 4, ... .
Для серии Бальмера m = 2, n = 3, 4, 5, ... .
Формула Бальмера
Слайд 12Комбинационный принцип Ритца
Согласно экспериментальным данным, полученным к концу XIX века,
частоты спектральных линий данного атома
где T(n)- функция целого числа
(спектральный терм), n=1,2,3,... . Это соотношение выражает комбинационный принцип Ритца (W. Ritz). В частности, для спектра излучения атома водорода Бальмер (J. Balmer) в 1885 г. эмпирически нашел простую формулу где R - постоянная Ридберга (J. Rydberg).
В классической теории для периодического движения заряженных частиц частоты излучения кратны основной частоте:
- период. Таким образом, эта теория не может объяснить комбинационный принцип.
Слайд 13Модель атома Бора. 1913 г.
Нильс Бор (1885-1962) — датский
физик, один из создателей современной физики. Основатель и руководитель Института
теоретической физики в Копенгагене (Институт Нильса Бора); создатель мировой научной школы; иностранный член АН СССР (1929). В 1943-45 работал в США.Нильс Бор создал теорию атома, в основу которой легли планетарная модель атома, квантовые представления и предложенные им Бора постулаты. Важные работы по теории металлов, теории атомного ядра и ядерных реакций. Труды по философии естествознания. Активный участник борьбы против атомной угрозы. Нобелевская премия (1922).
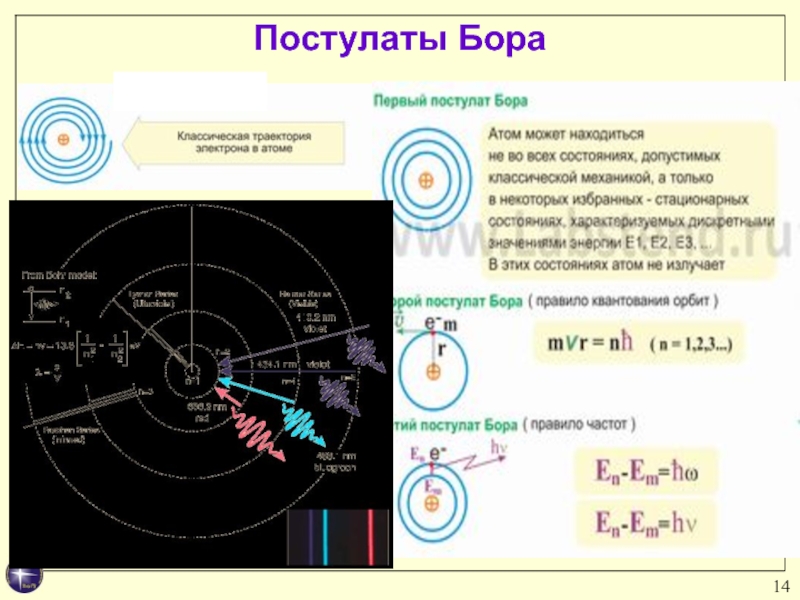
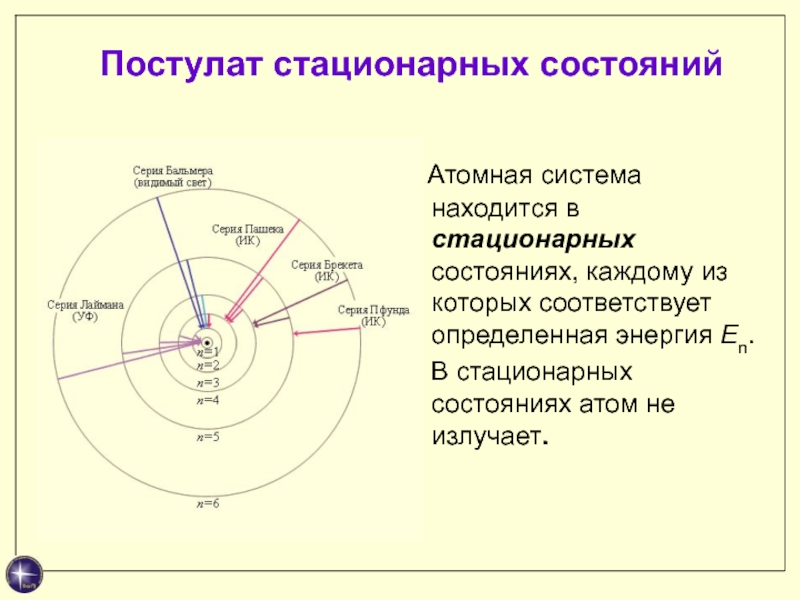
Слайд 15 Постулат стационарных состояний
Атомная система находится в
стационарных состояниях, каждому из которых соответствует определенная энергия En.
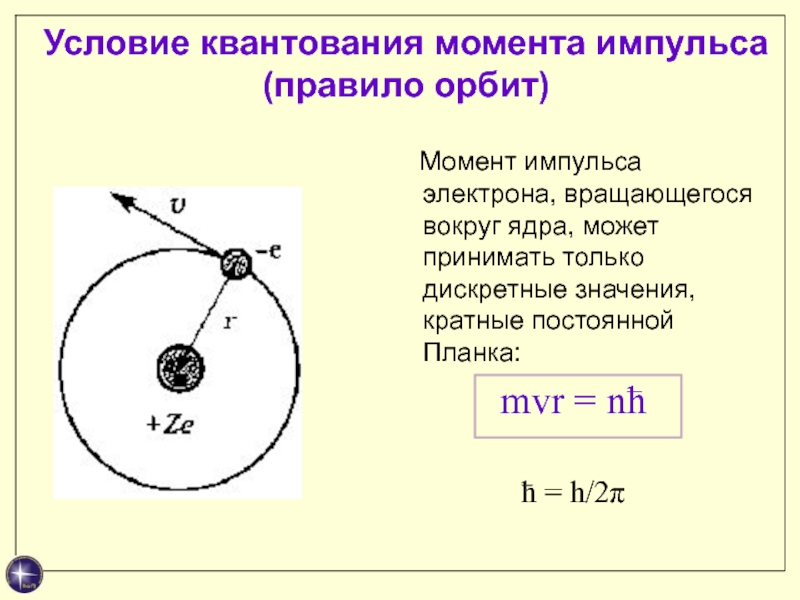
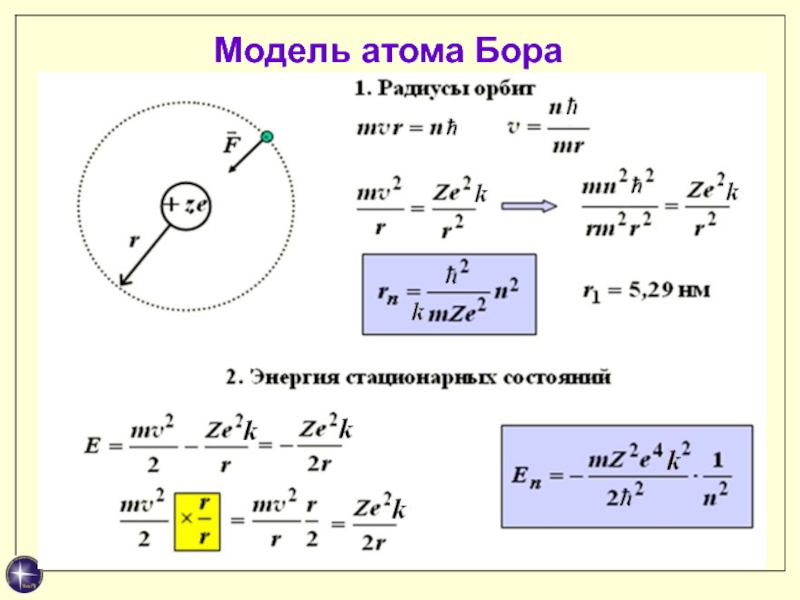
В стационарных состояниях атом не излучает.Слайд 16Условие квантования момента импульса (правило орбит)
Момент импульса
электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные
постоянной Планка:mvr = nћ
ћ = h/2π
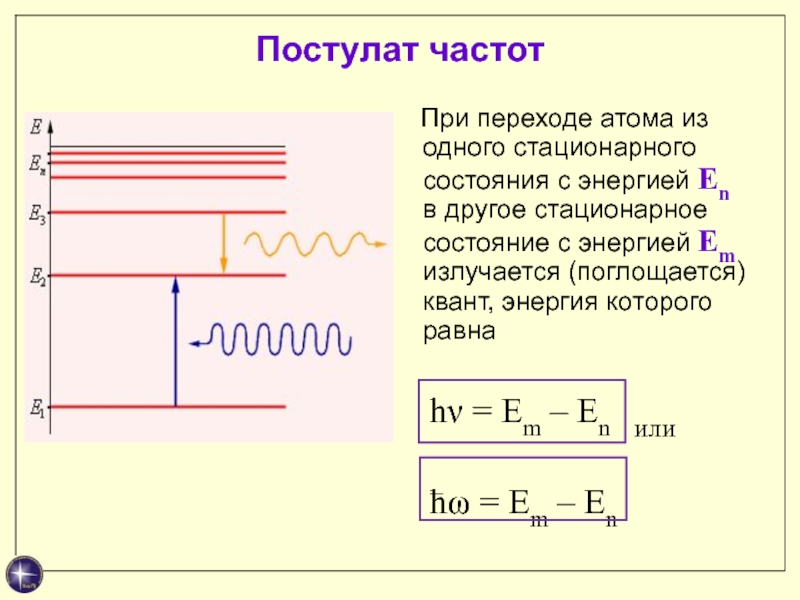
Слайд 17Постулат частот
При переходе атома из одного стационарного
состояния с энергией En в другое стационарное состояние с энергией
Em излучается (поглощается) квант, энергия которого равнаhν = Em – En или
ћω = Em – En
Слайд 18Опыт Франка-Герца
1913 г
Трехэлектродная лампа заполнена газом, например, парами ртути под
давлением 1 мм рт. ст.
Сетка С имеет положительный потенциал
Uуск относительно катода К и играет роль ускоряющего электрода. Между сеткой и анодом поле тормозящее (Uт ~ 0,5 В)
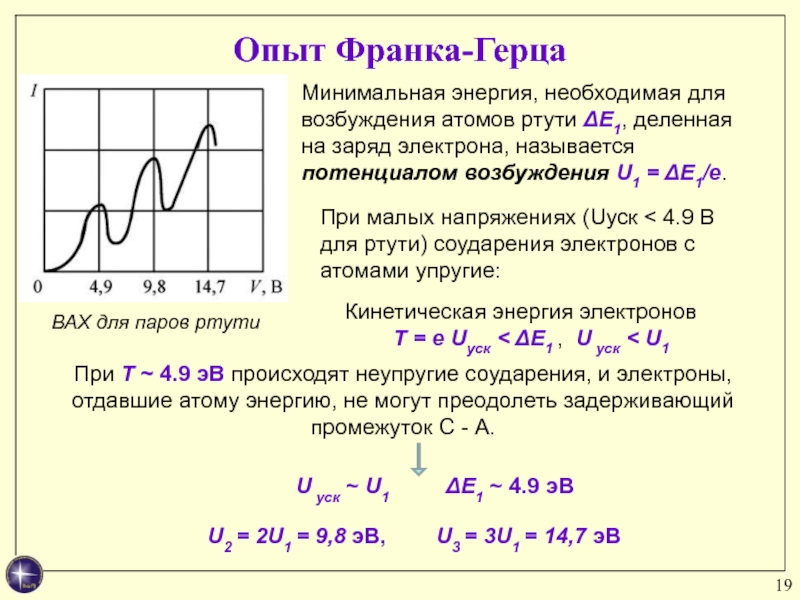
Слайд 19Опыт Франка-Герца
При T ~ 4.9 эВ происходят неупругие соударения, и
электроны, отдавшие атому энергию, не могут преодолеть задерживающий промежуток С
- А.ВАХ для паров ртути
Минимальная энергия, необходимая для возбуждения атомов ртути ΔE1, деленная на заряд электрона, называется потенциалом возбуждения U1 = ΔE1/e.
При малых напряжениях (Uуск < 4.9 В для ртути) соударения электронов с атомами упругие:
Кинетическая энергия электронов
T = e Uуск < ΔE1 , U уск < U1
ΔE1 ~ 4.9 эВ
U уск ~ U1
U2 = 2U1 = 9,8 эВ, U3 = 3U1 = 14,7 эВ
Слайд 20Опыт Франка-Герца
Лампа испускает ультрафиолетовый свет.
Излучение начинается, как только разность
потенциалов между катодом и сеткой достигает значения 4,9 В.
Такое
излучение объясняется тем, что возбужденные электронными ударами атомы ртути возвращаются в основное состояние путем испускания излучения с длиной волны λ = hc/ΔT = 253 нм.м
Дж
http://www.teachmen.ru/work/lectureFG/
Проведем опыт
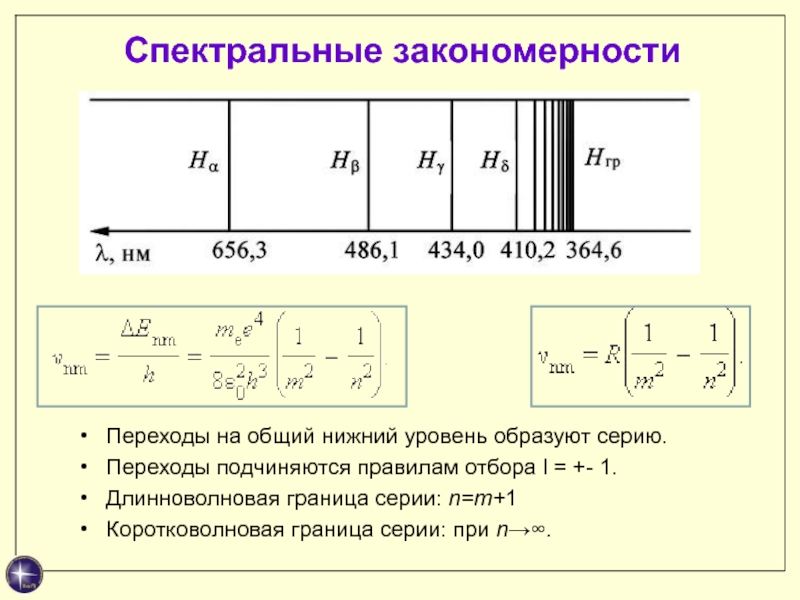
Слайд 23Спектральные закономерности
Переходы на общий нижний уровень образуют серию.
Переходы подчиняются правилам
отбора l = +- 1.
Длинноволновая граница серии: n=m+1
Коротковолновая граница серии:
при n→∞.
Слайд 25Выводы
В связанных состояниях скорость вращения, радиус орбиты и энергия электрона
принимают дискретный ряд значений и полностью определяются величиной главного квантового
числа n. Момент вращения квантуется всегда.Энергия отрицательна.
Минимальное значение энергии не равно нулю.
Состояние с минимальной энергией (n=1) – основное. Остальные (n>1) – возбужденные.
Ближайший к основному уровень, с которого разрешен переход вниз, – резонансный.
Уровень, вероятность перехода с которого очень мала, - метастабильный.
При возрастании n уровни сближаются к границе, n = .
Первый возбуждённый уровень значительно ближе к границе ионизации, чем к основному состоянию.
Бесконечно много уровней имеет только уединённый атом. В реальной среде различные взаимодействия с соседними частицами приводят к тому, что у атома остаётся только конечное число нижних уровней.
Состояния с положительной энергией называют свободными; они не квантуются, и все параметры электрона в них, кроме момента вращения, могут принимать любые значения, не противоречащие законам сохранения.
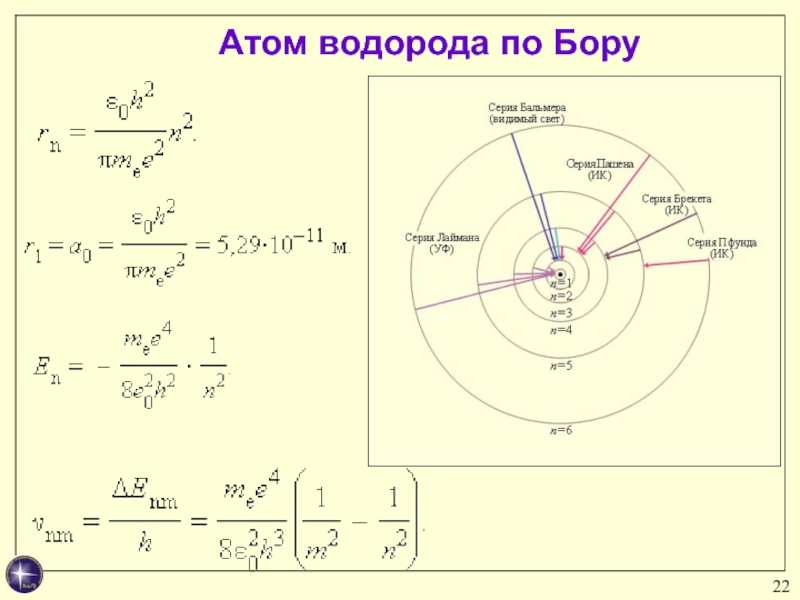
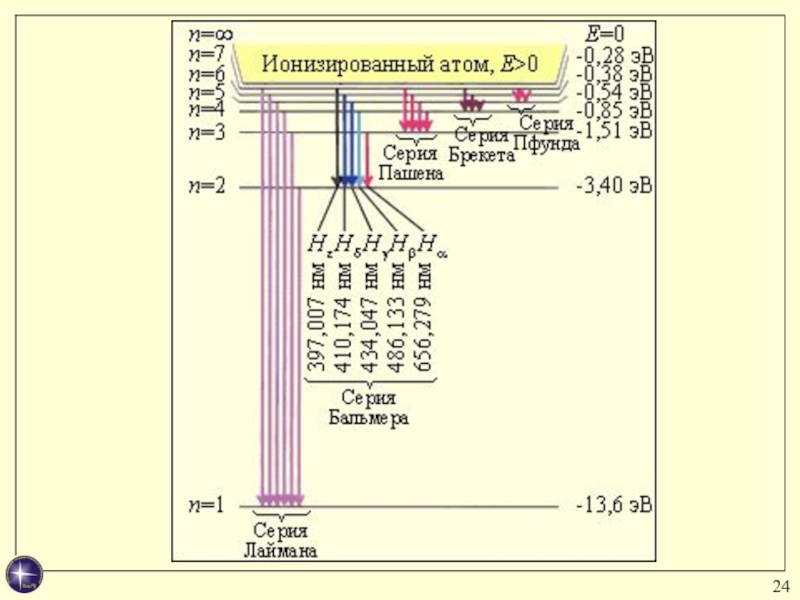
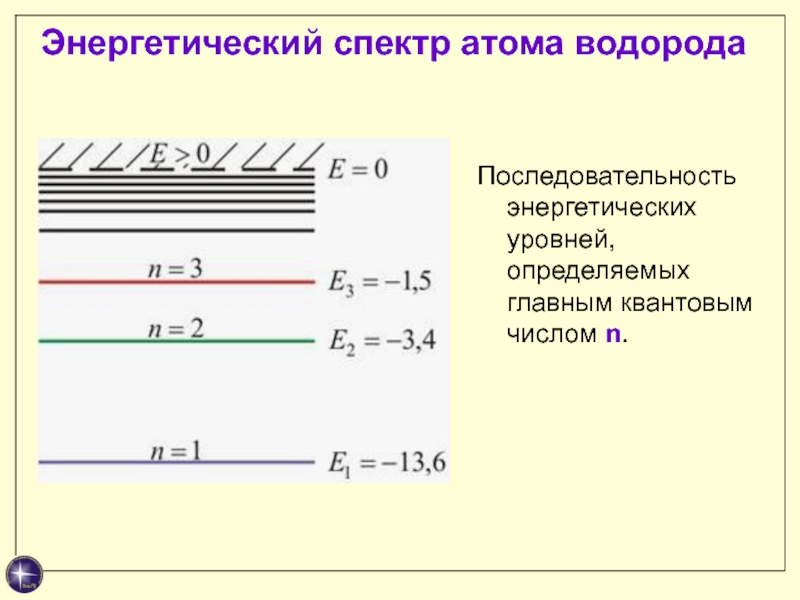
Слайд 26Энергетический спектр атома водорода
Последовательность энергетических уровней, определяемых главным квантовым числом
Слайд 27
Принцип соответствия
Принцип соответствия законов микро- и макромира в квантовой механике,
сформулированный Нильсом Бором в 1923 г., утверждает, что классическую механику
следует считать предельным случаем квантовой механики при определенных условиях.ПС вступает в силу на нечеткой границе между квантовой и классической механикой и демонстрирует, что в природе нет явных границ между явлениями
Квантовая механика отнюдь не отменяет и не подменяет собой классическую механику Ньютона, а лишь представляет собой предельный случай при переходе явлений в масштабы микромира.
Слайд 28
Состояния атома, в котором один из электронов находится на высоком
энергетическом уровне, называют высоковозбуждёнными, или ридберговскими. Положение уровней возбуждённого электрона
может быть описано в рамках модели Бора. Электрон с большим значением квантового числа n, далек от ядра и других электронов («оптический» электрон).При переходе между высокими (n >> 1) соседними орбитами n и n + 1, частота ωn,n+1 излучаемого кванта энергии равна частоте ωn вращения электрона на n-й орбите.
Здесь и начинается «стирание различий» между квантовомеханической моделью атома, где электрон может находиться лишь в фиксированных энергетических состояниях, поглощать и испускать энергию фиксированными порциями (квантами) и, соответственно, обитать на строго определенных орбитах, и классической моделью атома, где электрон обладает произвольной энергией и движется по произвольным орбитам. Иными словами, на больших удалениях от ядра атом начинает представлять собой классическую систему, подчиняющуюся законам механики Ньютона.
Принцип соответствия
Слайд 30Модели атома
Современная модель атома является развитием планетарной модели. Согласно этой
модели, ядро атома состоит из положительно заряженных протонов и не
имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).Слайд 31Выводы
Теория Бора имеет историческое значение:
пользуется классическими представлениями,
но основывается
на квантовых постулатах.
Она показала неприменимость классической физики к атомным
явлениям.Применима только к расчету атома водорода и легких ионов с одним электроном.
Позволила теоретически вычислить постоянную Ридберга
Слайд 32Квантово-механическое описание атомов
Стационарное уравнение Шредингера для атома водорода
Волновые
функции и квантовые числа
Эффект Зеемана
Опыт Штерна и
ГерлахаПериодическая система элементов
Правила отбора для квантовых переходов
http://fn.bmstu.ru/phys/bib/physbook/tom5/front.html
Слайд 33Стационарное уравнение Шредингера для атома водорода
Потенциальная энергия взаимодействия электрона с
ядром, обладающим зарядом Ze
r — расстояние между электроном и
ядромСостояние электрона в атоме водорода описывается волновой функцией ψ, удовлетворяющей стационарному уравнению Шредингера
т — масса электрона,
Е — полная энергия электрона в атоме
(1)
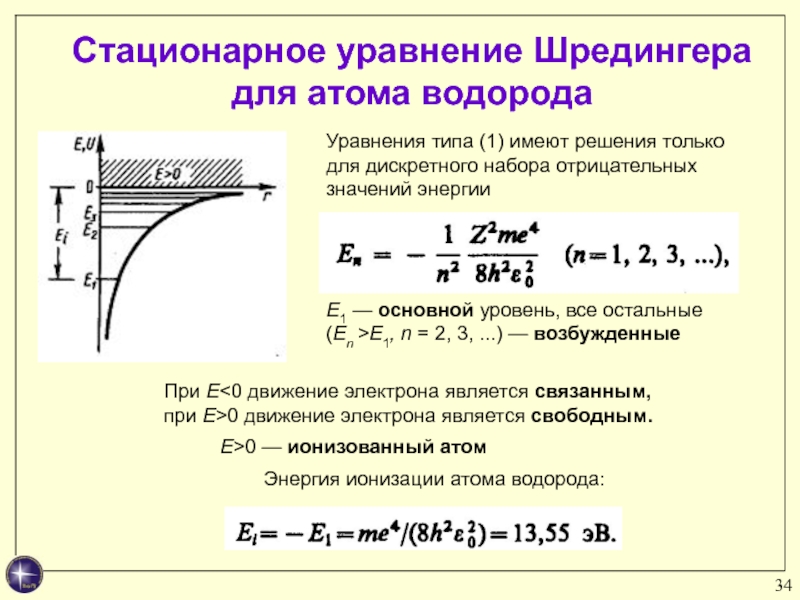
Слайд 34Стационарное уравнение Шредингера для атома водорода
Энергия ионизации атома водорода:
Уравнения типа
(1) имеют решения только для дискретного набора отрицательных значений энергии
Е1
— основной уровень, все остальные (Еn >Е1, n = 2, 3, ...) — возбужденныеПри Е<0 движение электрона является связанным, при Е>0 движение электрона является свободным.
Е>0 — ионизованный атом
Слайд 35Волновые функции и квантовые числа
удовлетворяют собственные функции ψnlm(r, θ, φ),
определяемые тремя квантовыми числами:
главным п, орбитальным l и магнитным
тl.Стационарному уравнению Шредингера
Главное квантовое число n
определяет энергетические уровни электрона в атоме
и может принимать любые целочисленные значения,
начиная с единицы: n = 1,2,3…
Слайд 36Волновые функции и квантовые числа
Орбитальное квантовое число l
определяет момент
импульса
(механический орбитальный момент) электрона в атоме.
l = 0, 1,
…, (n – 1) при заданном n. Движущаяся по классической орбите частица с определенной энергией может описывать как круговую орбиту, так и любую из бесконечного числа эллиптических орбит. Энергия частиц на каждой из таких орбит одна и та же, а момент импульса – различный.
Для данного значения энергии состояния круговая орбита имеет наибольший момент импульса. Наиболее вытянутая эллиптическая орбита имеет наименьший момент импульса.
В модели эллиптических орбит Зоммерфельда главное квантовое число n определяет только энергию состояния, а для характеристики орбитального момента импульса вводится новое квантовое число l
Слайд 37Волновые функции и квантовые числа
Магнитное квантовое число ml
определяет проекцию момента
импульса электрона на заданное направление.
Из решения уравнений Шредингера следует, что
вектор Ll момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направление z внешнего магнитного поля принимает квантованные значения, кратные ћ:при заданном l. Всего 2l +1 значений.
Квантовое число l определяет величину углового момента, но не дает его направление. В магнитном поле это направление является важным, так как орбитальный электрон также генерирует крошечное магнитное поле.
В любом эксперименте единовременно может быть измерена только одна компонента углового момента.
Слайд 38
Эффект Зеемана
Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное
экспериментально, называется эффектом Штарка.
Обнаружено в 1896 г. голландским физиком
П. Зееманом (1865—1945).Наличие квантового числа ml
приводит в сильном магнитном поле к расщеплению уровня с главным квантовым числом п на 2l +1 подуровней. Соответственно в спектре атома в сильном магнитном поле наблюдается расщепление спектральных линий.
Слайд 39Квантовые числа
Спиновое квантовое число s
описывает собственный угловой момент электрона, который
называется спином.
Спин электрона
где s =1/ 2 - спиновое квантовое число
Проекция
спина на выделенное направление zгде mS может принимать одно из двух значений
Все частицы имеют спиновое квантовое число. Частицы с целым спином называются бозонами (фотон, мезоны), частицы с полуцелым спином – фермионами (протон, нейтрон, электрон, нейтрино и т.д.).
Спин и орбитальный момент импульса электрона объединяются в полный момент импульса J.
Слайд 40Схема установки, на которой Штерн и Герлах проводили свой эксперимент.
Используются атомы серебра или др. металла.
Опыт Штерна и Герлаха
1922
Опыт подтвердил наличие у атомов спина и факт пространственного квантования направления их магнитных моментов.
Узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка.
Слайд 41Выводы
Состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
Принцип
Паули: в одном и том же атоме не может быть
более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тsдва электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
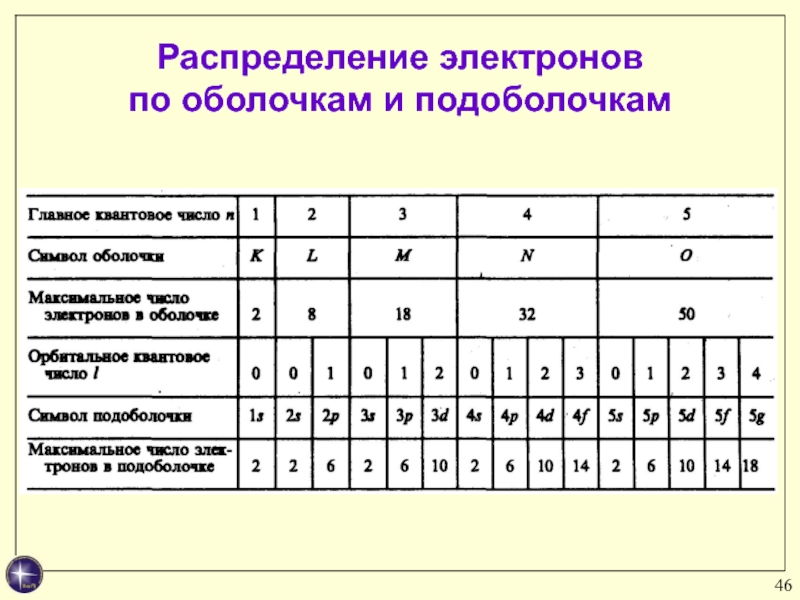
максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
Слайд 42 Радиальная электронная плотность вероятности в виде "облака", густота которого
в разных точках пространства пропорциональна этой плотности вероятности. Именно так,
в виде облака плотности вероятности может быть представлен образ атома в квантовой теории.Слайд 43Совокупность электронов в многоэлектронном атоме, имеющих одно и то же
главное квантовое число n, называется электронной оболочкой или слоем.
Вероятность обнаружения
электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью,соответствующей данному l.
Квантовые числа п и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
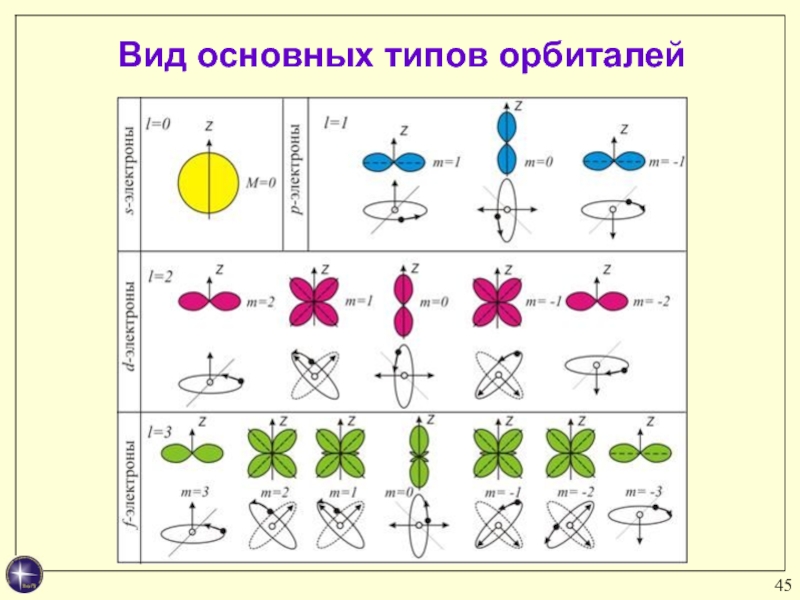
Распределение электронов в атоме по состояниям
. Вид основных типов орбиталей показан на рис.
Слайд 44Состояние электрона, характеризующееся квантовыми числами
l = 0, называют s-состоянием
(электрон в этом состоянии называют s-электроном),
l = 1
— p-состоянием, l = 2 — d-состоянием,
l = 3 — f-состоянием и т. д.
Значение главного квантового числа n указывается перед условным обозначением орбитального квантового числа.
распределение электронной плотности (формы электронного облака) для состояний атома водорода при n=1 и n=2
Распределение электронов в атоме по состояниям
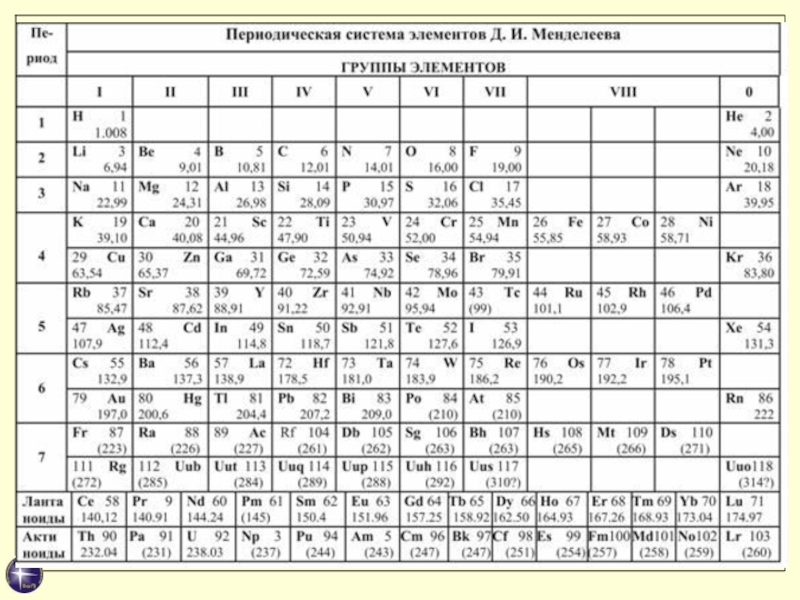
Слайд 48 Физический смысл порядкового номера Z элемента периодической
системы Менделеева был выяснен в ядерной модели атома Резерфорда. Порядковый
номер Z элемента совпадает с числом протонов – положительных элементарных зарядов в ядре. Это число совпадает с общим количеством электронов в атоме данного элемента.Химические свойства элементов, их оптические и некоторые другие физические свойства объясняются поведением внешних электронов, называемых валентными или оптическими. Периодичность свойств химических элементов связана с периодичностью в расположении валентных электронов атома различных элементов.
Периодическая система элементов Д. И. Менделеева (1869)
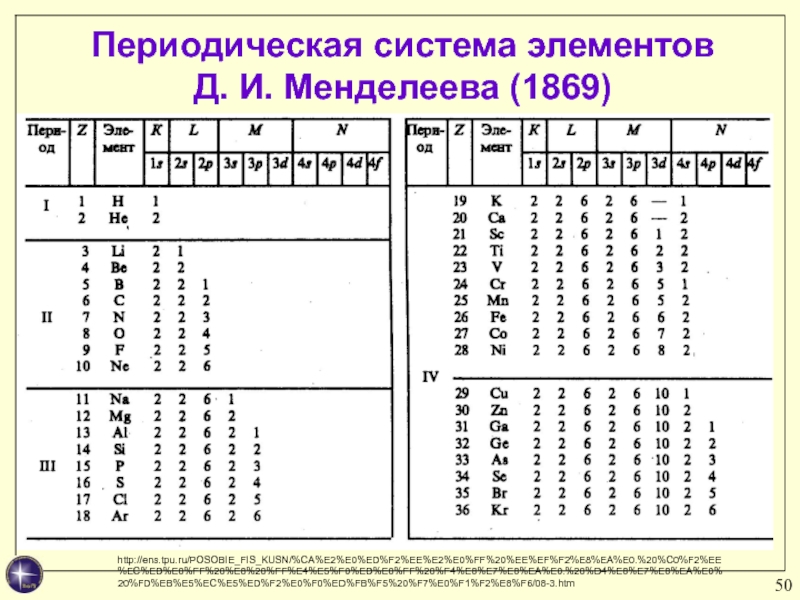
Слайд 49 Объяснение строения периодической системы элементов, теоретическое
истолкование периодической системы Менделеева было дано в квантовой теории Бором
в 1922 г. еще до появления квантовой механики.Последовательная теория периодической системы основывается на следующих положениях:
общее число электронов в атоме данного химического элемента равно порядковому номеру Z этого элемента;
состояние электрона в атоме определяется набором его четырех квантовых чисел: n, l, ml ,s ;
распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможные энергетические состояния с наименьшей энергией;
заполнение электронами энергетических уровней в атоме должно проходить в соответствии с принципом Паули.
Периодическая система элементов Д. И. Менделеева (1869)
Слайд 50Периодическая система элементов Д. И. Менделеева (1869)
http://ens.tpu.ru/POSOBIE_FIS_KUSN/%CA%E2%E0%ED%F2%EE%E2%E0%FF%20%EE%EF%F2%E8%EA%E0.%20%C0%F2%EE%EC%ED%E0%FF%20%E8%20%FF%E4%E5%F0%ED%E0%FF%20%F4%E8%E7%E8%EA%E0.%20%D4%E8%E7%E8%EA%E0%20%FD%EB%E5%EC%E5%ED%F2%E0%F0%ED%FB%F5%20%F7%E0%F1%F2%E8%F6/08-3.htm
Слайд 51Правила отбора
ограничивают число возможных переходов электронов в атоме, связанных с
испусканием и поглощением света.
1) изменение орбитального квантового числа Δl удовлетворяет
условию -следствие закона сохранения момента количества движения2) изменение магнитного квантового числа Δml удовлетворяет условию
Изменение главного квантового числа n может быть любое
Слайд 52В атоме водорода есть состояние (2s), переход из которого запрещен
правилами отбора. Атом в таком состоянии называют метастабильным. Время жизни
может быть очень продолжительным. У атома водорода ~2 мс. Метастабильные атомы могут накапливаться до относительно высоких концентраций 1012 - 1014 см-3, оставаясь возбужденными. Снятие возбуждений в таких системах происходит вследствие межатомных столкновений и может затягиваться на макроскопические времена.Возможные переходы в атоме водорода
Слайд 53 Квантовая теория прекрасно описывает экспериментальные результаты;
Энергия в атоме
квантована и значение ее пропорционально 1/n2;
n2 состояний имеют одну
энергию;У атома нет четкой границы;
В любом из состояний излучения нет, оно возникает только при переходах атома из одного состояния в другое;
Частоты в спектре излучения подчиняются простой закономерности;
Квантовая механика позволяет рассчитать вероятности переходов, т.е. определить интенсивности линий спектра;
Изучение водородоподобных систем актуально и в наше время.
Подведем итоги: