– пространственный.
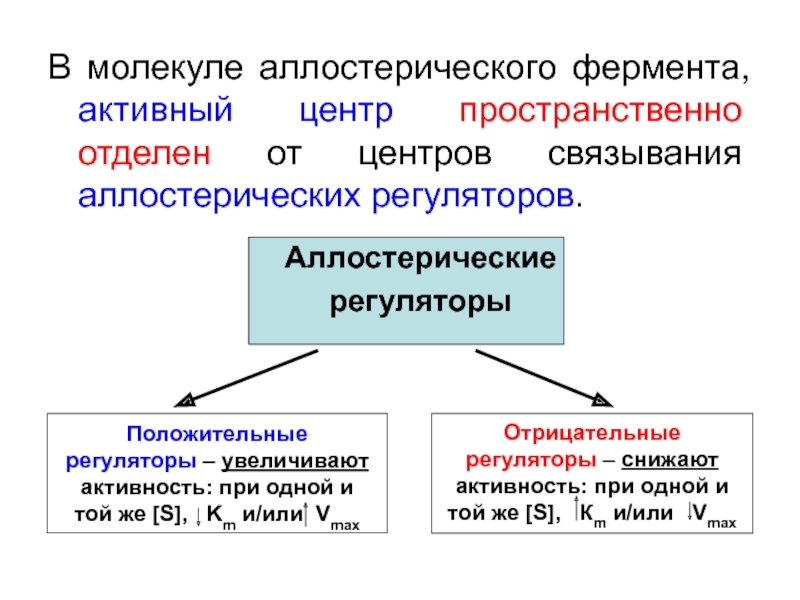
Аллостерические ферменты – особая категория ферментов,
их функция – регуляция активности метаболических путей («ключевые» ферменты). Активность аллостерических ферментов регулируется, в основном, с помощью аллостерических регуляторов (активаторов и ингибиторов). Эффект этих регуляторов проявляется чрезвычайно быстро. Возможна также регуляция активности под влиянием концентрации собственного субстрата.
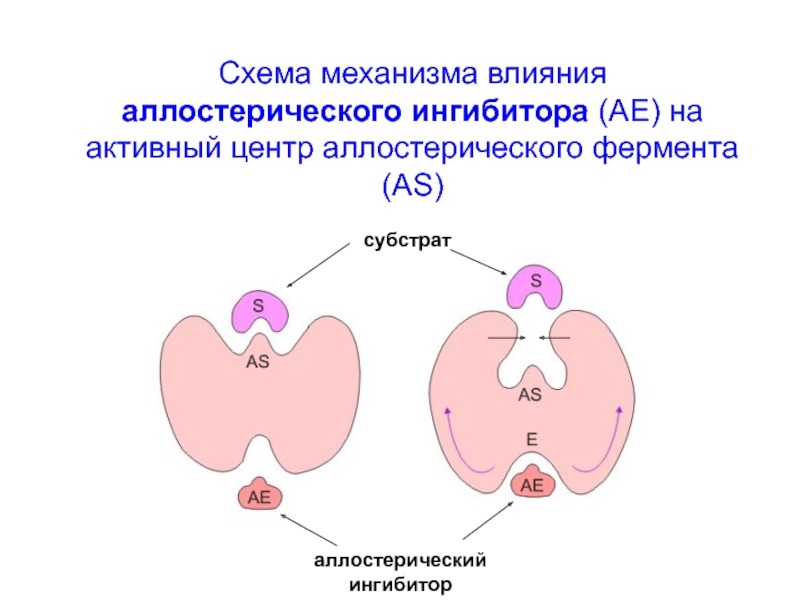
Аллостерические регуляторы не обладают структурным сход-ством с субстратом. Эти регуляторы с высоким сродством нековалентно (обратимо) связываются со специальными сайта-ми, лежащими за пределами активного (каталитического) центра молекулы аллостерического фермента. Регуляторы действуют в низких концентрациях.
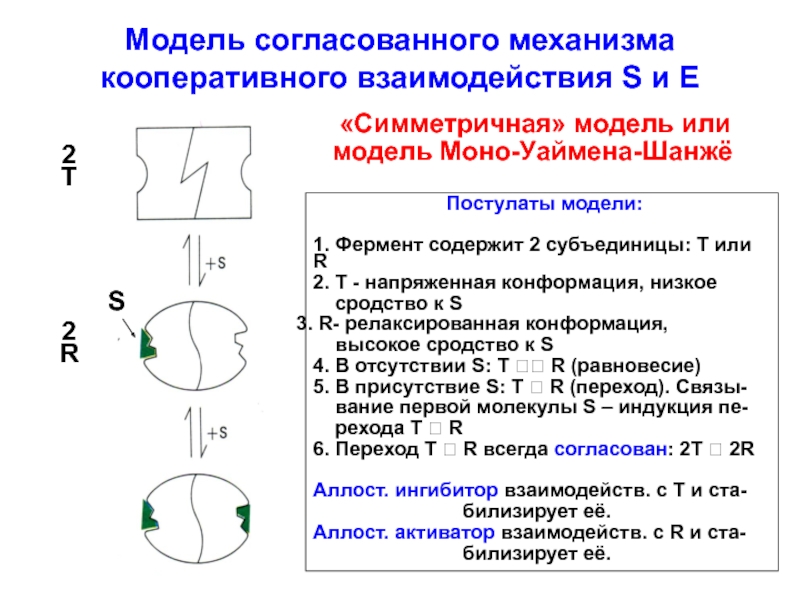
Теория аллостерических ферментов была разработана в 1956-1963 гг. Амбуржье, Моно, Шанжё и Жакобом.






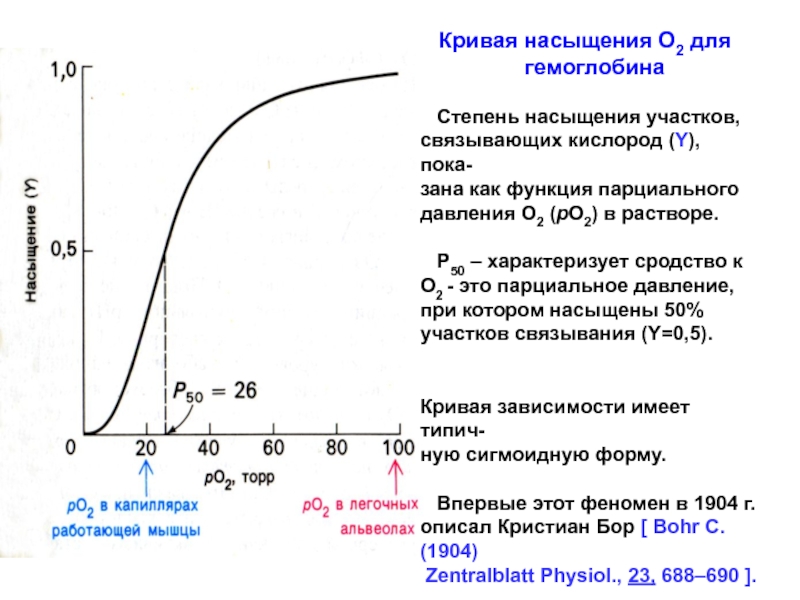
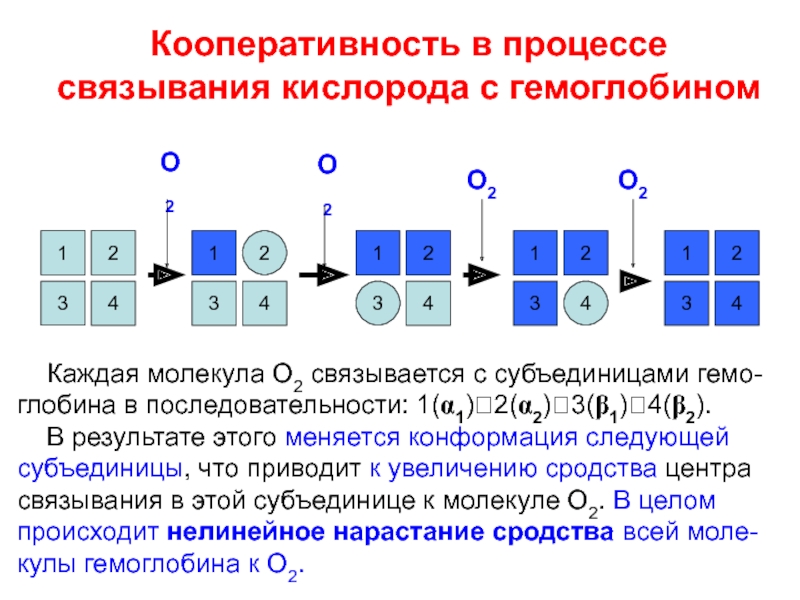
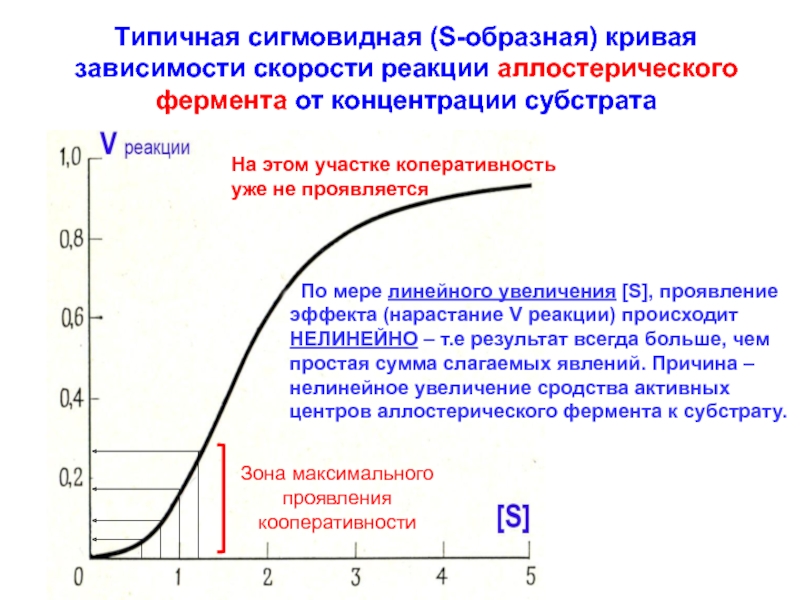


![Особенности кинетики аллостерических ферментов В случае аллостерического фермента, незначительные сдвиги [S] приводят к существенным изменениям В случае аллостерического фермента, незначительные сдвиги [S] приводят к существенным изменениям скорости ферментативной реакции – основное проявления](/img/thumbs/335ae9f0e21c5a3a2156e236f982e6dd-800x.jpg)







![Особенности кинетики аллостерических ферментов График Хиллаlg [S] ylg 1-yнаклон = n График Хиллаlg [S] ylg 1-yнаклон = n](/img/thumbs/0de9f473c7b47f62af847bfb54265257-800x.jpg)