Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН И
Содержание
- 1. ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН И
- 2. Почему ПСХЭ названа - ПЕРИОДИЧЕСКОЙ?ПСХЭ – это графическая запись ПЕРИОДИЧЕСКОГО ЗАКОНА!
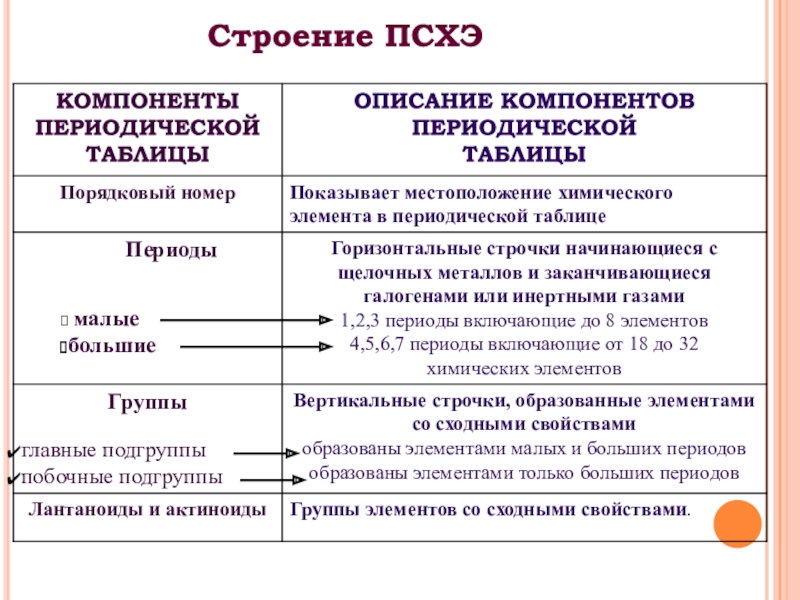
- 3. Строение ПСХЭ
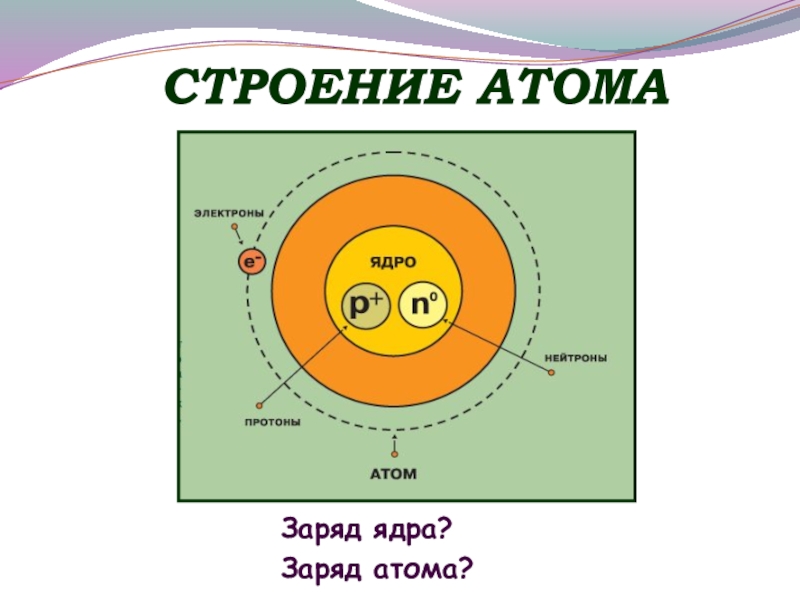
- 4. Строениеатома
- 5. СТРОЕНИЕ АТОМАЗаряд ядра?Заряд атома?
- 6. АТОМp и n - нуклоны, из их
- 7. Взаимосвязь положения элемента в ПСХЭ и
- 8. Характеристика серы S Порядковый номер равен ?,
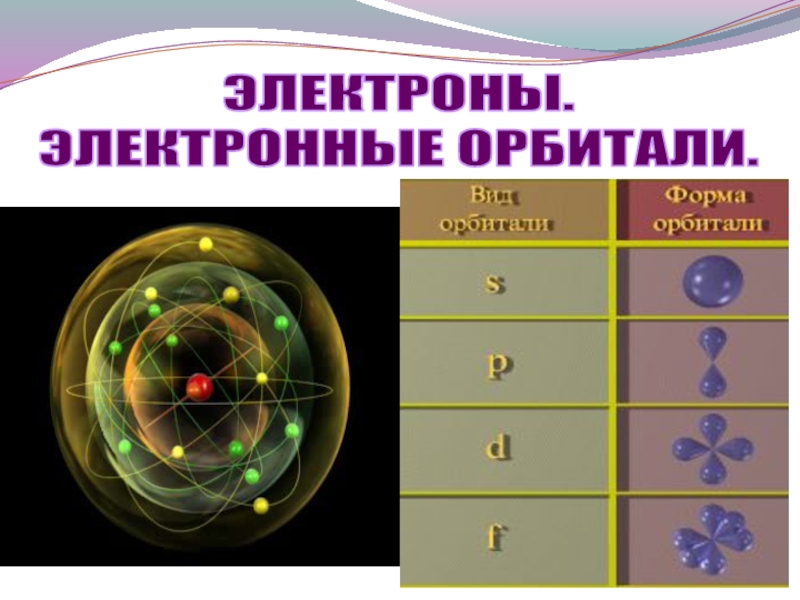
- 9. ЭЛЕКТРОНЫ. ЭЛЕКТРОННЫЕ ОРБИТАЛИ.
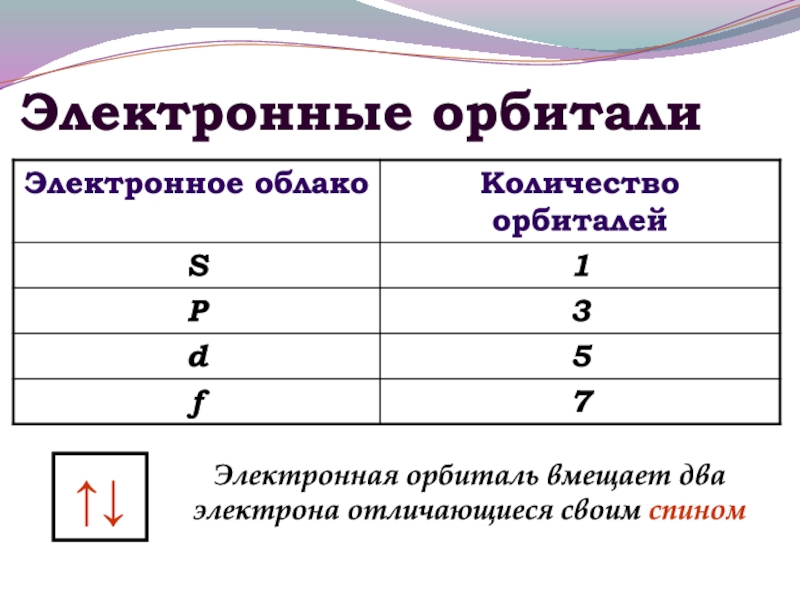
- 10. Электронные орбитали↑↓Электронная орбиталь вмещает два электрона отличающиеся своим спином
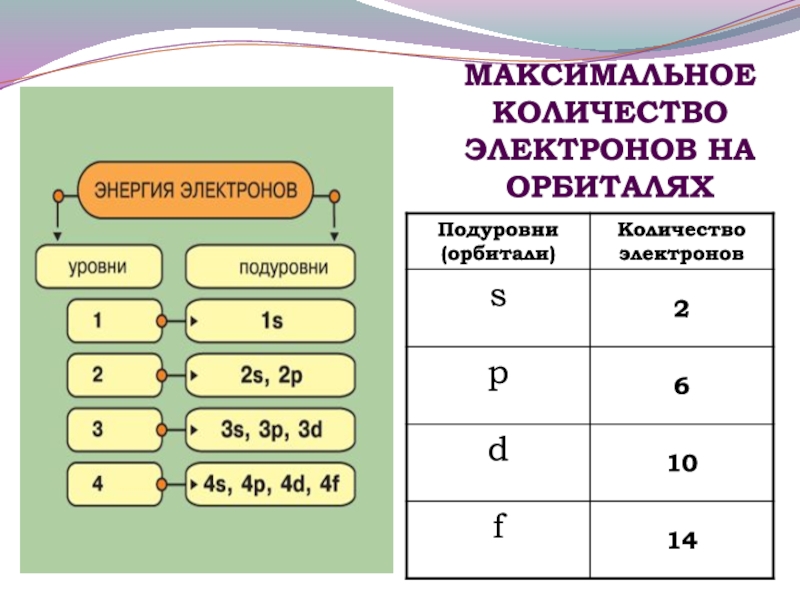
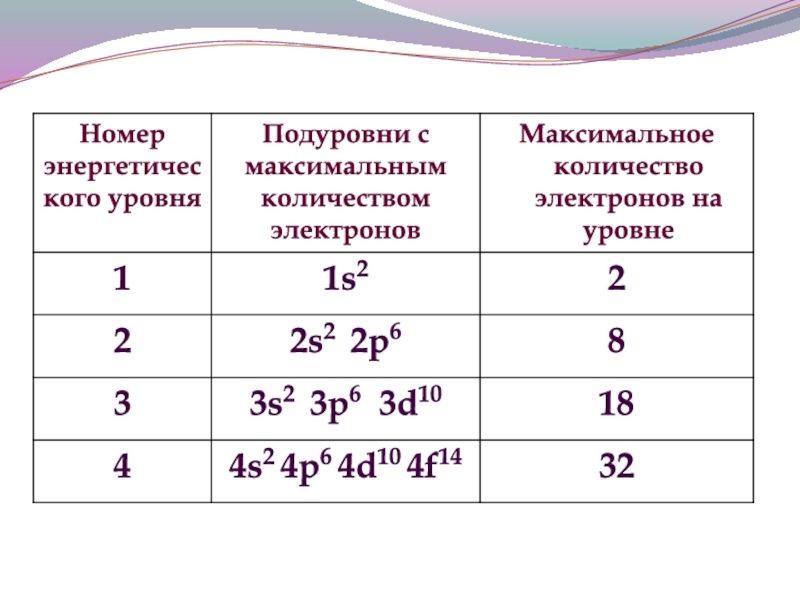
- 11. МАКСИМАЛЬНОЕ КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА ОРБИТАЛЯХ
- 12. Слайд 12
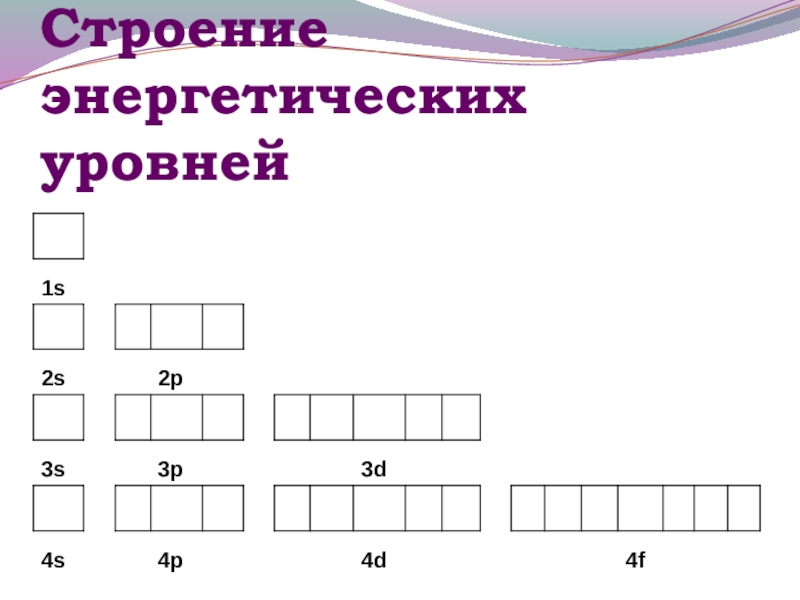
- 13. Строение энергетических уровней
- 14. ШКАЛА ЭНЕРГИИ1s
- 15. Взаимосвязь положения элемента в ПСХЭ с электронным
- 16. 1. Порядковый номер равен 12, следовательно, заряд
- 17. Строение электронных оболочек атомов
- 18. Ме - nẽ→ Ме+n неМе +
- 19. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВПО ПЕРИОДУПО ГРУППЕПо
- 20. ПЕРИОДИЧЕСКАЯ СИСТЕМАД.И. МЕНДЕЛЕЕВАПЕРИОДИЧЕСКИЙ ЗАКОН И
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 6АТОМ
p и n - нуклоны,
из их массы слагается
масса
атома.
Ядро атома ± p = новый атом
Ядро атома ±
n = ИЗОТОПИЗОТОП – разновидность одного
и того же атома с одинаковым
зарядом ядра но разной
массой атома.
Слайд 7Взаимосвязь положения элемента в ПСХЭ
и строением его атома
Порядковый номер
элемента соответствует заряду ядра атома и общему числу электронов и
протонов.Ar - порядковый номер = количеству нейтронов в ядре атома
Слайд 8Характеристика серы S
Порядковый номер равен ?, следовательно заряд ядра
+ ?, общее количество электронов ?, протонов, ?.
Ar (S) ?
– ? = ?нейтроновСлайд 15Взаимосвязь положения элемента в ПСХЭ с электронным строением его атома
1.
Порядковый номер элемента соответствует заряду ядра атома и общему числу
электронов.2. Номер периода соответствует количеству энергетических уровней.
3. Номер группы соответствует количеству электронов на последнем энергетическом уровне и высшей валентности элемента.
Слайд 161. Порядковый номер равен 12, следовательно, заряд ядра + 12,
ē =12, р=12 (n= 24-12=12). 2. Расположен в 3 периоде –
имеет 3 энергетических уровня. 3. Стоит во II группе – на последнем энергетическом уровне 2 электрона. + 12 Mg))) 282СТРОЕНИЕ АТОМА
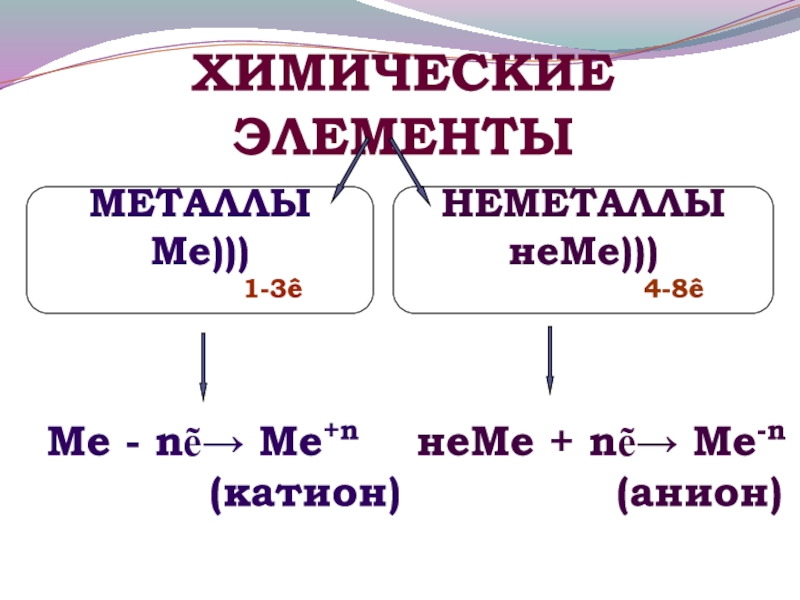
Слайд 18Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n
(катион)
(анион)ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
МЕТАЛЛЫ
Ме)))
1-3ê
НЕМЕТАЛЛЫ
неМе)))
4-8ê
Слайд 19ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПО ПЕРИОДУ
ПО ГРУППЕ
По периоду слева направо
металлическая
активность убывает, а неметаллическая возрастает.
Т.к. увеличивается количество электронов
на
последнем энергетическом уровне,атому становится легче присоединить
недостающие электроны, чем отдать имеющиеся.
По группе сверху в низ металлическая
активность возрастает, а неметаллическая убывает.
Т.к. увеличивается количество энергетических
уровней, следовательно радиус атома
увеличивается,атому становится легче отдать
электроны, чем присоединить недостающие.