Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Планетарная модель атома
Содержание
- 1. Планетарная модель атома
- 2. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА В 1911 г английский
- 3. Ядро атома состоит из нуклонов. Нуклоны –
- 4. ИЗОТОПЫ Изотопы – это атомы одного
- 5. Например, 146С, 126С –
- 6. КВАНТОВО- МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА. КВАНТОВЫЕ
- 7. Максимальное
- 8. При l = 0 орбиталь имеет сферическую
- 9. На первом энергетическом
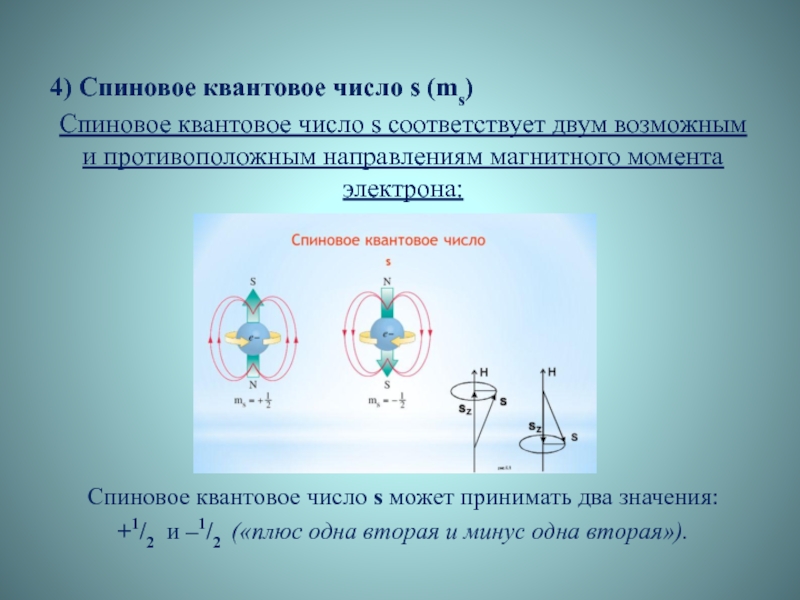
- 10. 4) Спиновое квантовое число s (ms)Спиновое квантовое
- 11. В атоме не может быть двух электронов
- 12. Правило Хунда Электроны размещаются
- 13. ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
- 14. Правила заполнения энергетических уровней:1. Порядок заполнения энергетических
- 15. Последовательность заполнения уровней и подуровней
- 16. УРОК ОКОНЧЕН!
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
В 1911 г английский ученый Э.Резерфорд предложил
планетарную модель строения атома
(похоже на строение солнечной системы).
В центре
атома находится ядро. Оно имеет положительный заряд (+). Вокруг ядра вращаются электроны (e), они имеют
отрицательный заряд (–).
Электроны образуют электронную оболочку.
Слайд 3 Ядро атома состоит из нуклонов. Нуклоны – это протоны (p),
которые имеют положительный заряд (+), и нейтроны (n) – частицы,
которые не имеют заряда (заряд "0").Силы, которые удерживают нуклоны одного ядра вместе, называются ядерными силами.
Положительный заряд ядра численно равен отрицательному заряду электронов, поэтому атом является электронейтральным (заряд = 0).
Масса электронов очень мала, поэтому массу атома считают равной массе ядра: A = N0 + Z
А – массовое число
N0 – число нейтронов в ядре атома
Z – заряд ядра ( число протонов в ядре атома).
Общее количество электронов в атоме равно числу протонов и равно порядковому номеру элемента в таблице Менделеева: ∑е = ∑р = Z
Слайд 4ИЗОТОПЫ
Изотопы – это атомы одного и того же
химического элемента, которые имеют одинаковое количество протонов и разное количество
нейтронов.Изотопы известны для всех химических элементов. Изотопы
изображают теми же символами, что и химические элементы:
АZЭ
Вверху пишется массовое число (А), внизу – заряд ядра (Z).
Слайд 5 Например, 146С, 126С – это изотопы одного
и того же элемента – углерода. Порядковый номер элемента равен
числу протонов в атоме углерода (Z = 6), а массовое число(относительная атомная масса Аr) различная. Число
нейтронов (N0 ) в этих изотопах определяют из формулы
A = N0 + Z : N0 = А - Z
для 146С (А= 14, Z = 6) число нейтронов равно
14 – 6 = 8;
для 126С (А= 12, Z = 6) число нейтронов равно
12 – 6 = 6.
Слайд 6 КВАНТОВО- МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА. КВАНТОВЫЕ ЧИСЛА. ОРБИТАЛЬ
Положение электрона в атоме описывают с помощью
четырёх квантовых чисел:1) Главное квантовое число n
Электроны в атоме образуют электронные слои (энергетические уровни), которые находятся на разных расстояниях от ядра. Уровни обозначают заглавными латинскими буквами (K, L…Q).
Главное квантовое число n может принимать
целые значения: n = 1, 2,…7
(соответствует номеру энергетического уровня).
Главное квантовое число n показывает,
на каком расстоянии от ядра атома
находится электрон.
Слайд 7 Максимальное количество электронов
на данном энергетическом уровне (Nе)
равно:Nе = 2n2
где n – номер уровня (главное квантовое число).
Например, для первого энергетического уровня (n=1), максимальное количество электронов: Nе = 2n2 = 2∙12 = 2;
На следующих уровнях максимальное число электронов равно:
n =2, Nе = 2∙22 = 8;
n =3, Nе = 18;
n =4, Nе =32
2) Орбитальное квантовое число l
Орбитальное квантовое число l определяет форму электронной орбитали.
Орбиталь – это пространство вокруг ядра, где нахождение электрона наиболее вероятно.
Орбитальное квантовое число может принимать значения от 0 до n –1:
l = 0…n –1
Слайд 8При l = 0 орбиталь имеет сферическую форму (s-орбиталь); При l
=1 орбиталь имеет форму гантели (p-орбиталь);
При l =2 и l
=3 орбитали имеют еще более сложную форму (d-, f-орбитали).Слайд 9 На первом энергетическом уровне (n=1) орбитальное
квантовое число имеет только одно значение: l=0, это значит, что
орбиталь имеет сферическую форму (s–орбиталь).На втором энергетическом уровне (n=2) l имеет два значения:
l1 = 0; lmax = n – 1 = 2 – 1 = 1. Значит, на втором энергетическом уровне орбитали могут иметь две формы: сферическую (s –орбиталь) и гантели (p – орбиталь).
На третьем энергетическом уровне (n=3) l имеет 3 значения:
l1 = 0; lmax = n – 1 = 3 – 1 = 2. Значит, на третьем энергетическом уровне орбитали могут иметь три формы: сферическую, гантели и сложную форму (s –, p – , d–орбитали).
3) Магнитное квантовое число m
Магнитное квантовое число m определяет положение орбитали относительно внешнего электромагнитного поля.
Магнитное квантовое число принимает следующие значения:
m = - l …0…+l
На втором энергетическом уровне (n=2) для l =1 m = -1, 0, +1 - следовательно, существует три p – орбитали, ориентированные вдоль координатных осей OХ, OY, OZ.
Слайд 104) Спиновое квантовое число s (ms)
Спиновое квантовое число s соответствует
двум возможным и противоположным направлениям магнитного момента электрона:
Спиновое квантовое число
s может принимать два значения: +1/2 и –1/2 («плюс одна вторая и минус одна вторая»).
Слайд 11В атоме не может быть двух электронов с одинаковым набором
всех четырех квантовых чисел.
В одном атоме
все электроны отличаются хотя бы одним квантовым числом. Если электроны находятся на одной орбитали, то они имеют одинаковое главное, орбитальное и магнитное квантовое число. Поэтому они должны различаться спиновыми числами s. Так как спиновых чисел только два (+ 1/2 и – 1/2 ), то
на одной орбитали не может быть больше двух электронов.
Принцип Паули
Слайд 12Правило Хунда
Электроны размещаются на одинаковых
орбиталях так, чтобы сумма их спиновых чисел была максимальна.
Например, допустим, существуют три одинаковые орбитали, на которых находится два электрона. Тогда есть четыре варианта размещения электронов на этих орбиталях.Найдем сумму спиновых чисел для каждого варианта:
Согласно правилу Хунда, электроны будут размещаться по варианту 1, так как при этом сумма их спиновых чисел максимальна (в данном случае она равна +1).
Слайд 13ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ
ЭЛЕКТРОНАМИ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
Каждый энергетический уровень имеет
подуровни. На одной орбитали находится не более двух электронов, т.е.
максимальное число электронов на подуровне: 2∙ (2 l +1). Электронная оболочка атомов заполняется электронами в соответствии с принципом Паули, правилом Хунда и
принципом наименьшей энергии:
Каждый электрон стремится занять такое положение, чтобы его энергия была минимальна.
Слайд 14Правила заполнения энергетических уровней:
1. Порядок заполнения энергетических уровней и подуровней
описывается правилом Клечковского:
а) Первыми заполняются подуровни, на которых электроны имеют
минимальную энергию.б) Минимальную энергию имеют электроны с минимальной суммой квантовых чисел (n + l ).
Пример:
Сначала заполняется подуровень 4s (n + l = 4 + 0 = 4), а затем подуровень 3d (n + l = 3 +2 = 5), т.к. 4<5.
в) Если сумма (n + l ) одинакова, то первыми заполняются подуровни с меньшим значением n.
Пример:
Сначала заполняется подуровень 5р (n + l = 5+ 1 = 6), а затем подуровень 6s (n + l = 6 + 0 = 6), т.к. значение n у него выше ( 6>5).
2. Электроны заполняют орбитали сначала по одному, а если электронов больше, чем орбиталей, то по два.
Слайд 15 Последовательность заполнения уровней и подуровней электронами
записывают в виде
шкалы энергии электронов:
1s2 | 2s22p6 | 3s23p6 | 4s23d104p6 |
5s24d105p6 | 6s24f145d106p6|Для каждого элемента можно сделать запись распределения электронов на энергетических уровнях. Такая запись называется электронной формулой.
Например: Напишем электронную формулу фтора (F). Число электронов у фтора равно его номеру в таблице Менделеева: 9. С помощью шкалы энергии электронов запишем распределение электронов на уровнях и подуровнях: 1s2 2s22p5.
Электронно-графическая формула F: Схема электронного строения F:
Напишем электронную формулу титана (Ti). Число электронов в атоме титана равно его номеру в таблице Менделеева: 22. С помощью шкалы энергии электронов запишем распределение электронов на уровнях и подуровнях:
1s2 2s22p6 3s23p6 3d2 4s2
Внимание! Электроны d – подуровня относятся к 3 энергетическому уровню, поэтому в электронной формуле записываются перед 4s2