Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
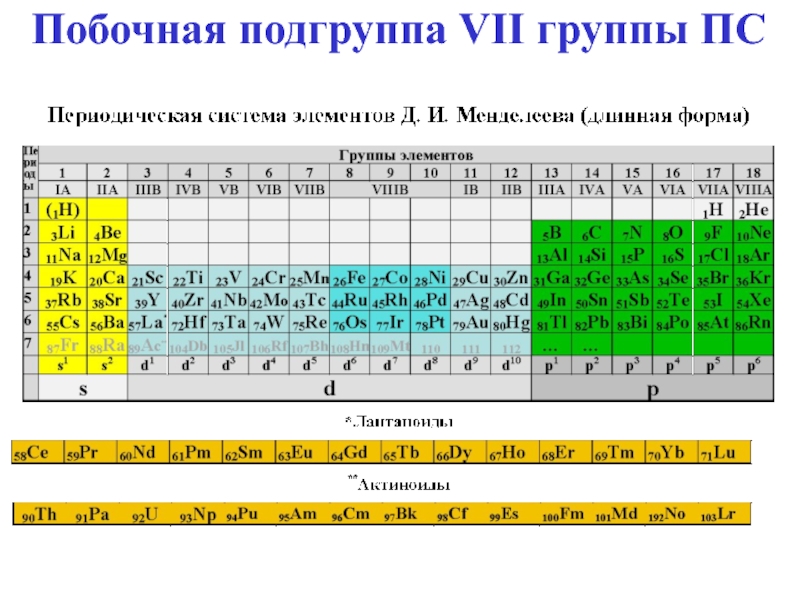
Побочная подгруппа VII группы ПС
Содержание
- 1. Побочная подгруппа VII группы ПС
- 2. Кислородные соединения M7+M2О7 + Н2О = 2НMО4
- 3. Соли M7+2KMnO4 = K2MnO4 + MnO2 +
- 4. KMnO4 как окислительКонпропорционирование3MnSO4 + 2KMnO4 + 2H2O = 5MnO2↓ + K2SO4 + 2H2SO4
- 5. Получение KMnO4 Две стадии:1) Щелочное плавление пиролюзита:3MnO2
- 6. Кислородные соединения Mn6+MnO3 и H2MnO4 – не
- 7. Кислородные соединения Mn6+ Манганаты – сильные окислители, особенно
- 8. Кислородные соединения Mn4+MnO2 – важнейшее соединениеСвойства окислителя
- 9. Кислородные соединения Mn4+Слабовыраженные амфотерные свойстваMnO2 + 4HF
- 10. Кислородные соединения Mn2+MnO – серо-зеленый, не растворим
- 11. Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O –
- 12. ПрименениеMn – марганцовые стали (твердость, износоустойчивость). МикроудобренияTc – радиодиагностикаRe – сплавы (жаропрочность, кислотоустойчивость), катализатор гидрирования
- 13. Побочная подгруппа VII группы ПС
- 14. Главная подгруппа – инертные газыHe,
- 15. Общая электронная формула: […] ns 02 (n–1)d 610
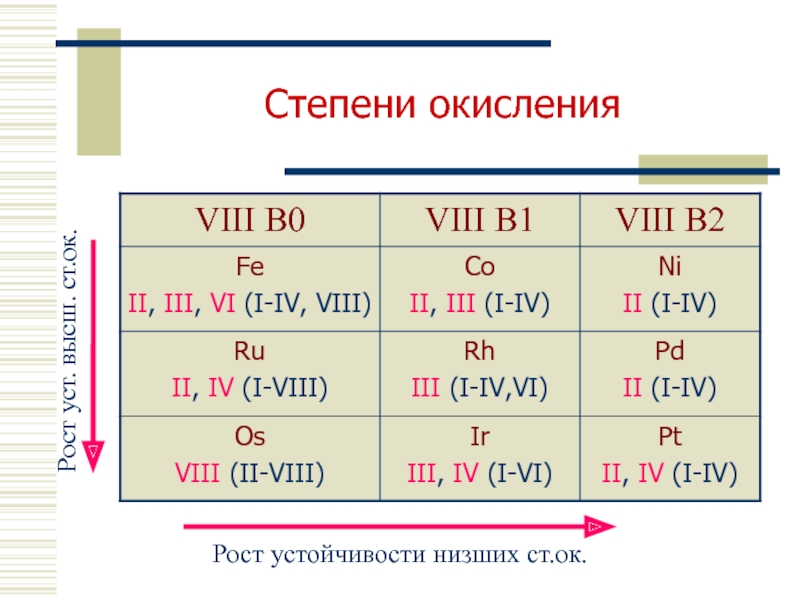
- 16. Степени окисления
- 17. Активность металлов
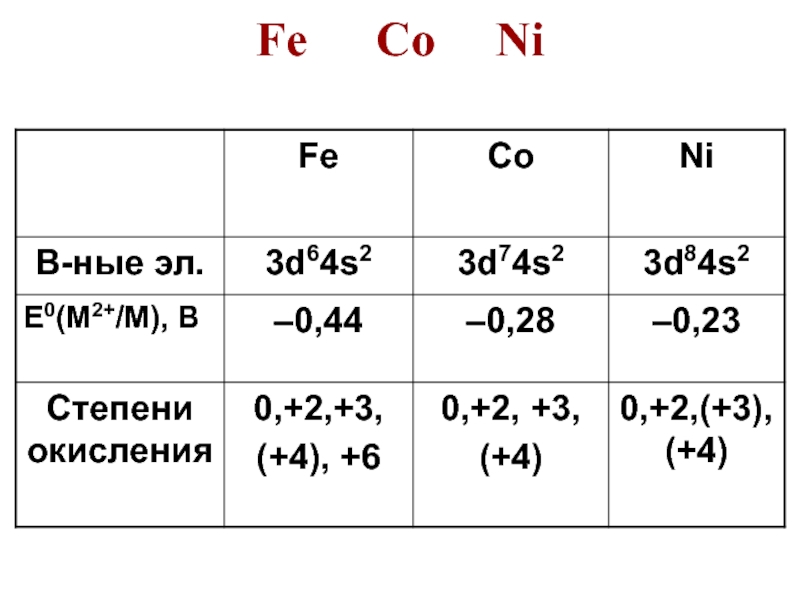
- 18. Fe Co Ni
- 19. Распространенность и минералыFe – 4 место; Fe2O3
- 20. Открытие элементовFe – известно с древнейших времен,
- 21. Получение В промышленности железо в основном
- 22. ПолучениеМировое производство чугуна ~ 1 000 000
- 23. Сплавы железа Чугун (2-5% углерода) т-ра
- 24. Алюминий используется для получения некоторых металлов. Этот
- 25. Получение Co и NiОбжиг: 3CoS + 5O2
- 26. Свойства простых веществМеталлы реагируют с кислотами,
- 27. Коррозия По отношению к воздуху и воде компактные
- 28. Взаимодействие с O2:Fe + O2 (150 °C)
- 29. Соединения М2+Оксиды: FeO CoO
- 30. Соединения М2+ Цвет кристаллогидратов обусловлен наличием [M(H2O)6]2+ и
- 31. Окисление М2+ кислородом в различных средах Щелочная
- 32. Окисление М2+ кислородом в различных средахКислая среда:M3+
- 33. Получение Co3+ и Ni3+Co(OH)3 и Ni(OH)3 (NiO(OH))
- 34. Соединения M3+Оксиды и гидроксиды M2O3 и M(OH)3
- 35. Соединения M3+В водных растворах соли Fe3+ сильно
- 36. Соединения Fe6+FeO3 – нет, H2FeO4 – нетСуществуют
- 37. ПЛАТИНОВЫЕ МЕТАЛЛЫ
- 38. Ru Rh PdНаряду с серебром и золотом, эти металлы
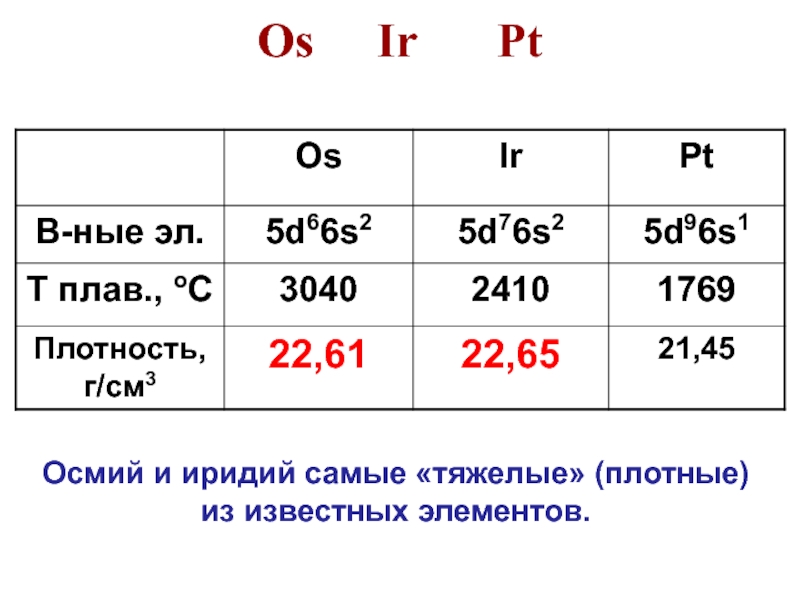
- 39. Os Ir PtОсмий и иридий самые «тяжелые» (плотные) из известных элементов.
- 40. Распространенность и минералыСодержание платиновых металлов в земной
- 41. На долю вторичных источников платиновых металлов (лом,
- 42. ПЛАТИНОВЫЕ МЕТАЛЛЫ В ОТРАБОТАННОМ ЯДЕРНОМ ТОПЛИВЕ (ОЯТ)
- 43. Ru, Rh, PdРеакторы на тепловых нейтронах (РТН)
- 44. ДИНАМИКА НАКОПЛЕНИЯ ПЛАТИНОВЫХ МЕТАЛЛОВ В ОЯТ
- 45. Антонио де Ульоа (1716 – 1795) –
- 46. Наиболее крупные самородки Pt найдены на Среднем Урале, самый тяжелый - 9635 г.
- 47. Палладий (Pd) в честь астероида ПалладаРодий (Rh)
- 48. Основные степени окисления
- 49. Простые вещества Ru, Os, Rh, Ir – не
- 50. Pd 3Pd + 18HCl + 4HNO3 =
- 51. Все платиновые металлы можно перевести в растворимое
- 52. Простые соединения менее характерны, чем комплексные.2Pd +
- 53. Доминируют квадратные комплексы.[MX4]2– (X = Cl, Br,
- 54. Галогениды Pd: PdF4 и (PdF3 – PdII[PdIVF6])Pd
- 55. Множество термодинамически стабильных и кинетически инертных октаэдрических
- 56. Pt(V) и Pt(VI)Pt + 3F2 = PtF6
- 57. M + X2 = MX3 (при t
- 58. Известно очень много комплексов, в основном октаэдрические.Нитритные
- 59. Os(VIII): OsO4, молекулярная решетка, tпл=40оС, tк= 130оСRu(VIII):
- 60. Мировые запасы платиновых металлов ~56 тыс. тоннВ
- 61. Структура потребления платиновых металлов в 2010 году
- 62. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Кислородные соединения M7+
M2О7 + Н2О = 2НMО4 Сильные кислоты, сила
уменьшается в ряду Mn–Tc–Re
(до 20%)Слайд 3Соли M7+
2KMnO4 = K2MnO4 + MnO2 + O2↑ (разложение при
нагр.)
2MnO4– + 5H2S + 6H+ = 2Mn2+ + 5S +
8H2O (ОВР)2ReO4– + 7H2S +2H+ = Re2S7↓ + 8H2O (нет ОВР)
Слайд 5Получение KMnO4
Две стадии:
1) Щелочное плавление пиролюзита:
3MnO2 + KClO3 +
6KOH = 3K2MnO4 + KCl + 3H2O
2) Окисление до перманганата
: Cl2, O3, PbO2, (NH4)2S2O8, KBiO3, XeF4
Экономично электрохимическое окисление:
КАТОД: 2H2O + 2e = H2 + 2OH–
АНОД: MnO42– – e = MnO4–
2K2MnO4 + 2H2O = 2KMnO4 +2KOH +H2↑
Слайд 6Кислородные соединения Mn6+
MnO3 и H2MnO4 – не известны
Соли – манганаты
(зеленый цвет)
Манганаты склонны диспропорционировать, особенно в кислой среде
3MnO42– +
4H+ = 2MnO4– + MnO2↓ + 2H2O(пропускание CO2)
Слайд 7Кислородные соединения Mn6+
Манганаты – сильные окислители, особенно в кислой среде,
где восстанавливаются до Mn2+; в щелочной среде восстанавливаются до MnO2
Окисление
органики6K2MnO4 +C2H5OH + H2O = 6MnO2↓+ 2K2CO3 + 8KOH
Слайд 8Кислородные соединения Mn4+
MnO2 – важнейшее соединение
Свойства окислителя (при нагревании):
MnO2 +
4HClконц = MnCl2 + Cl2↑ + 2H2O
2MnO2 + 2H2SO4 =
2MnSO4 + O2↑ +2H2OОкисление до манганатов:
(сплавление)
3MnO2 + KClO3 + 3K2CO3 = 3K2MnO4 + KCl + 3CO2
(KNO3)
Слайд 9Кислородные соединения Mn4+
Слабовыраженные амфотерные свойства
MnO2 + 4HF = MnF4 +
2H2O
MnO2 + CaO = CaMnO3 (метаманганат (IV))
CaMnO3 + CaO =
Ca2MnO4 (ортоманганат (IV))Слайд 10Кислородные соединения Mn2+
MnO – серо-зеленый, не растворим в воде
MnCO3 =
MnO + CO2 (при нагревании)
MnCO3 встречается в природе в виде
минерала (розовые кристаллы) родохрозита (марганцевый шпат). MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
Mn(OH)2 – белый, окисляется на воздухе, легко растворим в кислотах, растворим в крепких щелочах
Mn(OH)2 + H2SO4 = MnSO4 + 2H2O
Mn(OH)2 + KOH = K[Mn(OH)3]
Слайд 11Соли Mn2+
Водорастворимые соли:
MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O –
в водных растворах
[Mn(H2O)6]2+
Нерастворимые соли:
MnCO3, MnS, MnC2O4
MnCl2 + (NH4)2S = MnS↓ + 2NH4Cl
MnS
– темный, при стоянии зеленыйПРMnS = 10–10, но легко растворим в кислотах, поэтому не осаждается H2S
Слайд 12Применение
Mn – марганцовые стали (твердость, износоустойчивость). Микроудобрения
Tc – радиодиагностика
Re –
сплавы (жаропрочность, кислотоустойчивость), катализатор гидрирования
Слайд 14 Главная подгруппа – инертные газы
He,
Ne, Ar, Kr, Xe, Rn
1s2 ns2np6Побочная подгруппа –
3 триады
Fe, Co, Ni – семейство железа
Ru, Rh, Pd платиновые
Os, Ir, Pt металлы
Слайд 19Распространенность и минералы
Fe – 4 место; Fe2O3 (гематит, красный железняк),
Fe3O4 или (FeIIFe2III)O4 (магнетит, магнитный железняк), FeCO3 (сидерит)
Сo –
34 место; CoAs2(смальтин),
CoAsS (кобальтин),
Co3S4 (линнеит)
Ni – 27 место;
(FeNi)9S8 (пентландит)
(В России добывается 21% мирового объема Ni)
Слайд 20Открытие элементов
Fe – известно с древнейших времен, от лат. Ferreus
– твердый.
Со – 1735 г., швед Г. Брандт,
от нем.
«Кобольд» – имя злого горного духа. Ni – 1751 г., швед А. Кронстедт, от нем. «Ник» – имя насмешливого гнома.
Слайд 21Получение
В промышленности железо в основном (95%) выплавляют из
руд в виде чугунов и сталей:
3Fe2O3 + C =
2Fe3O4 + CO22Fe3O4 + 2CO = 6FeO + 2CO2
FeO + CO = Fe + CO2
Слайд 22Получение
Мировое производство чугуна ~ 1 000 000 000 тонн!
~ 1012
кг или ~ 100 кг/чел. в год!
Слайд 23
Сплавы железа
Чугун (2-5% углерода) т-ра плавления 1100-1200 0С;
Серый чугун –
углерод в виде пластинок графита;
Ковкий чугун – углерод в виде
зерен графита;Белый чугун (хрупкий) – цементит Fe3C (6,68% С);
Ковкое железо (0,04-1,5% углерода);
Сталь (0,5-1,7% углерода).
Слайд 24Алюминий используется для получения некоторых металлов. Этот метод называется алюминотермией.
Метод основан на том, что порошкообразный алюминий при воспламенении восстанавливает
оксиды многих металлов. При этом образуется очень чистый, свободный от углерода металл. Смесь порошкообразного алюминия и оксидов железа называется термитом. При горении термита алюминий восстанавливает железо из его оксида.Fe2O3 + 2Al = Al2O3 + 2Fe
Железо образуется на дне тигля в виде застывших капель.
Металл притягивается к магниту.
Получение Fe алюминотермией
Слайд 25Получение Co и Ni
Обжиг:
3CoS + 5O2 = Co3O4 +
3SO2
2Ni3S2 + 7O2 = 6NiO + 4 SO2
Восстановление:
Co3O4 + 4С
= 3Сo + 4CONiO + C = 4Ni + CO
Для удаления образующихся карбидов добавляют избыток Co3O4 или NiO
Слайд 26Свойства простых веществ
Металлы реагируют с кислотами,
железо легче, Co и
Ni очень медленно:
M + H+ = M2+ + H2
Концентрированные
HNO3 и H2SO4 пассивируют эти металлы (при комн. т-ре), повышение т-ры снимает пассивацию:2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Растворы и расплавы щелочей не действуют на компактные металлы.
Слайд 27Коррозия
По отношению к воздуху и воде компактные Co, Ni и
химически чистое Fe устойчивы. Однако, обычное Fe подвергается коррозии с
образованием ржавчины:Fe2O3(H2O)x (рыхлый пористый слой на поверхности, который не предохраняет металл от дальнейшего окисления).
Слайд 28Взаимодействие с O2:
Fe + O2 (150 °C) «Fe3O4»
(FeIIFe2III)O4
Co + O2 (900 °C) «Co3O4» (CoIICo2III)O4
Ni +
O2 NiOВ ЭХРН: Ga, Fe, Cd … Co, Ni … Sn… H
Взаимодействие с кислотами-неокислителями:
M + 2 H3O+ + 4 H2O = [M(H2O)6]2+ + H2
С конц. р-рами щелочей (Fe, Co):
M + 2 OH– + 4 H2O = [M(OH)4]2– + H2
[M(OH)6]4–
Химические свойства Fe, Co и Ni
Слайд 29Соединения М2+
Оксиды: FeO CoO NiO
Гидроксиды: Fe(OH)2
(белый)
Со(ОН)2 (розовый, синий)
Ni(OH)2 (зеленый)
Только основные свойства:
M(OH)2 + 2H+
= M2+ + 2H2OСоли растворимые в воде:
MSO4, M(NO3)2, MCl2 обычно кристаллизуются с 6 молекулами H2O.
Слайд 30Соединения М2+
Цвет кристаллогидратов обусловлен наличием [M(H2O)6]2+ и совпадает с цветом
растворов: Fe – светлозеленый
Co - розовый
Ni – зеленый
Соли нерастворимые в воде:Сульфиды MS (черные)
Карбонаты МСО3
(Fe(белый), Со, Ni)
Слайд 31Окисление М2+ кислородом в различных средах
Щелочная среда:
M(OH)3 + e
= M(OH)2 + OH– (EoM3+/M2+)
O2 + 2H2O
+ 4e = 4OH– (Eo = +0,4 B)2M(OH)2 + ½O2 + H2O = 2M(OH)3 (Eo)
Слайд 32Окисление М2+ кислородом в различных средах
Кислая среда:
M3+ + e =
M2+ (EoM3+/M2 )
O2 + 4H+ + 4e = 2H2O
(Eo = +1,23 B)4M2+ + O2 + 4H+ = 4M3+ + 2H2O (Eo)
Слайд 33Получение Co3+ и Ni3+
Co(OH)3 и Ni(OH)3 (NiO(OH)) получают действием более
сильных окислителей:
2M(OH)2 + Br2 + 2OH– = 2M(OH)3 + 2Br–
(Eo) Br2 + 2e = 2Br– (Eo = +1,09 B)
Eo = +0,92 В (Co) Eo = +0,6 В (Ni)
Простые соли можно получить действием фтора в отсутствии воды:
2Co + 3F2 = 2CoF3 (Ni)
Слайд 34Соединения M3+
Оксиды и гидроксиды M2O3 и M(OH)3 обладают только основными
свойствами
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Однако:
Fe(OH)3 + 3HI =
FeI2 + ½I2 + 3H2OВ случае Co и Ni Ox-свойства выше:
Co(OH)3 + 3HCl = CoCl2 + ½Cl2 + 3H2O
2Co(OH)3 + 2H2SO4 = 2CoSO4 + ½O2 + 5H2O
2Co(OH)3 + 4HNO3 = 2Co(NO3)2 + ½O2 + 5H2O
Простые соли M3+ характерны только для Fe
Слайд 35Соединения M3+
В водных растворах соли Fe3+ сильно гидролизованы, поэтому все
растворы этих солей окрашены в бурый цвет и имеют кислую
среду:[Fe(H2O)6]3+ = [Fe(H2O)5(OH)]2+ + H+
Молекула воды сильно увеличивает свои кислотные свойства в поле иона Fe3+
Слайд 36Соединения Fe6+
FeO3 – нет, H2FeO4 – нет
Существуют соли:
Na2FeO4 – растворима
в воде,
BaFeO4 – нерастворима в воде.
Окисление Fe3+ до Fe6+:
2FeCl3
+ 16KOH + 3Br2 = 2K2FeO4 + 6KBr + 6KCl +8H2OFe6+ – сильный окислитель:
2K2FeO4 + 5H2SO4(p) = Fe2(SO4)3 + 3/2O2 + 5H2O + 2K2SO4
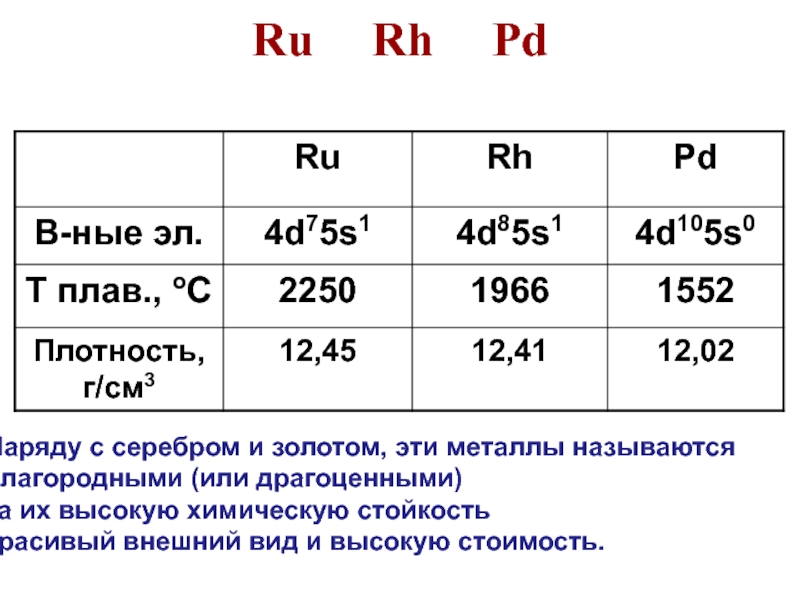
Слайд 38Ru Rh Pd
Наряду с серебром и золотом, эти металлы называются
благородными (или драгоценными)
за
их высокую химическую стойкость
красивый внешний вид и высокую стоимость.
Слайд 40Распространенность и минералы
Содержание платиновых металлов в земной коре:
Pd – 71
место, Pt – 72 место, Rh – 75 место,
Ir
– 76 место, Ru – 73 место, Os – 74 место(в природе 82 «стабильных» элемента).
Собственные минералы платиновых металлов практически не образуют месторождений, перспективных для промышленной разработки. Эти минералы преимущественно вкраплены в основные рудообразующие сульфидные минералы меди, никеля, железа.
Слайд 41На долю вторичных источников платиновых металлов (лом, отработанные катализаторы и
др.) приходится от 10 до 33% ежегодного мирового производства этих
металлов.Слайд 43Ru, Rh, Pd
Реакторы на тепловых нейтронах (РТН) (топливо – UO2
(235U), глубина выгорания топлива – 33 ГВт·сут/т, 10 лет выдержки
ОЯТ): ~2,1 кг Ru, ~0,4 кг Rh, ~1,3 кг Pd в среднем на одну тонну топлива.Для реакторов на быстрых нейтронах (РБН) содержание осколочных платиновых металлов возрастает на порядок.
Слайд 45Антонио де Ульоа (1716 – 1795) – испанский морской офицер,
физик и математик, которого не вполне заслуженно иногда называют первооткрывателем
платины. Считается, что он первым привез в Европу (в Испанию) из Южной Америки, с золотоносных месторождений Перу, образцы самородной платины. Известен же этот металл с незапамятных времен: его белые тяжелые зерна нередко находили при добыче золота.Pt – известна давно. Plata – исп., серебро.
Белые тяжелые зерна платины, которые иногда находили при добыче золота, никак не могли обработать и вплоть до XVIII века выбрасывали. На Урале и в Сибири зерна самородной платины использовали как дробь при стрельбе. Во второй половине XVIII века платина ценилась в два раза ниже, чем серебро. А удельный вес ее велик (21,5 г/см3); с золотом и серебром она хорошо сплавляется, поэтому нечистые на руку ювелиры и фальшивомонетчики подмешивали ее к золоту и серебру в украшениях и в монетах. Дознавшись, испанское правительство объявило войну платиновой "порче". Был издан указ, предписывающий уничтожать всю платину, добываемую попутно с золотом.
Только в 1778 году этот закон был отменен, и испанское правительство стало само подмешивать платину к золоту монет.
Слайд 47Палладий (Pd) в честь астероида Паллада
Родий (Rh) от греч. ροδον
– розовый
(типичные соединения Rh(III) имеют тёмно-красный цвет)
Выделены в 1803-1804 г.г.
из «сырой» платиныангличанин Уильям Гайд Волластон
Иридий (Ir) от греч. ιριδιοσ – радуга
(разнообразная окраска солей)
Осмий (Os) от греч. οσμη – запах
(стойкий запах OsO4, похожий на запах хлора или гнилой редьки)
Выделены в 1804 г. из «сырой» платины
англичанин
Смитсон Теннант
Рутений (Ru) от лат. Ruthenia – Россия
Выделен в 1844 г. из «сырой» платины
Карл Карлович Клаус – профессор
Казанского университета
Слайд 49Простые вещества
Ru, Os, Rh, Ir – не растворимы в индивидуальных
кислотах и их смесях.
Pt – растворяется только в «царской водке»
с образованием платинохлористоводородной кислоты3Pt + 18HCl + 4HNO3 = 3H2[PtCl6] + 4NO + 8H2O
Слайд 50Pd
3Pd + 18HCl + 4HNO3 = 3H2[PdCl6] + 4NO+
8H2O
Pd + 4HNO3(конц.) = Pd(NO3)2 + 2NO2 + 2H2O
при
нагревании:Pd + 2H2SO4(конц.) = PdSO4 + SO2 + 2H2O
Простые вещества
Слайд 51 Все платиновые металлы можно перевести в растворимое состояние:
1. окислительным
щелочным плавлением (t = 500-700оС)
M + 3Na2O2 = Na2MO4 +
2Na2O (M = Ru, Os)2. гетерофазным хлорированием (t = 600-900oC):
2Rh + 6NaCl + 3Cl2 = 2Na3RhCl6
Ir + 2NaCl + 2Cl2 = Na2IrCl6
Pd хорошо растворяет водород:
1 объём губчатого Pd растворяет 900 объёмов H2 (возможно, в атомарном виде) – водородные мембраны, катализаторы топливных элементов.
Простые вещества
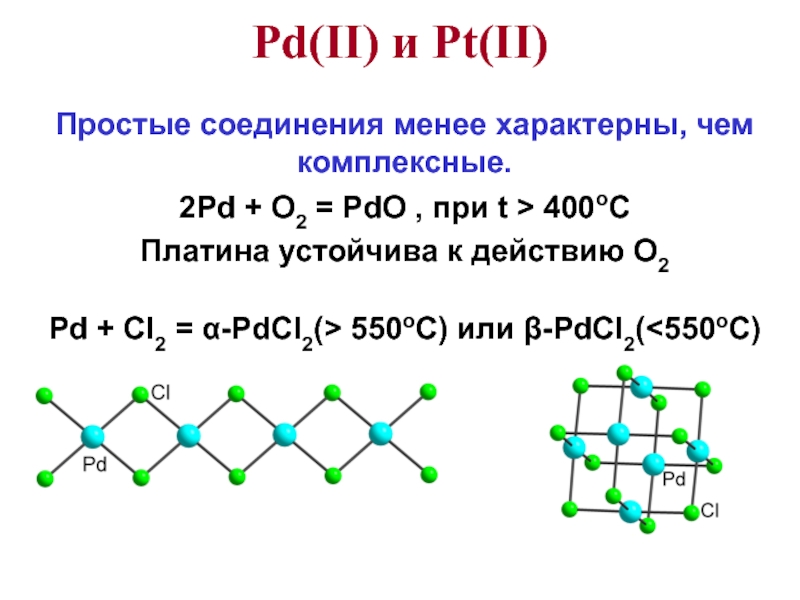
Слайд 52Простые соединения менее характерны, чем комплексные.
2Pd + O2 = PdO
, при t > 400oC
Платина устойчива к действию O2
Pd +
Cl2 = -PdCl2(> 550оС) или -PdCl2(<550oC)Pd(II) и Pt(II)
Слайд 53Доминируют квадратные комплексы.
[MX4]2– (X = Cl, Br, I, SCN, CN)
[MX2L2]
(L = NH3, NR3, Py )
[ML4]2+ (L = NH3, NR3,
CH3CN)Зеленая соль Магнуса:
[Pt(NH3)4][PtCl4]
Бесцветный [Pt(NH3)4]2+ и
розовый [PtCl4]2–
Комплексы Pd(II) и Pt(II)
Слайд 54Галогениды Pd: PdF4 и (PdF3 – PdII[PdIVF6])
Pd + 2F2 =
PdF4 (при t = 120 оС )
Галогениды Pt: PtX4 (X
= F, Cl, Br, I)Pt + Сl2 = PtCl4 (при t = 300 оС )
H2 [PtCl6] = PtCl4 + 2HCl (при t = 300 оС )
Оксиды – только PtO2 или PtO2.xH2O
PtO2 + 6HCl = H2[PtCl6] + 2H2O
Pd(IV) и Pt(IV)
Слайд 55Множество термодинамически стабильных и кинетически инертных октаэдрических комплексов.
Например синтезирован весь
ряд от
[PtCl6]2– ….. [PtClx(NH3)6–x] ….. [Pt(NH3)6]4+
[PtCl6]2– + 6NH3
= [Pt(NH3)6]4+ + 6Cl– (в жидком NH3)Характерны реакции окислительного присоединения: [Pt(NH3)4]2+ + Cl2 = транс-[Pt(NH3)4Cl2]2+
Комплексообразование стабилизирует Pd4+:
PdCl4 – не существует при комнатной температуре
K2[PdCl6] = K2[PdCl4] + Cl2 (разлагается выше 150оС)
Комплексы Pd(IV) и Pt(IV)
Слайд 56Pt(V) и Pt(VI)
Pt + 3F2 = PtF6
– при 200
оС и повышенном давлении фтора; молекулярная структура,
темно-красное вещество, tпл. =
61 оС, tкип. = 69 оССильнейший окислитель:
окисляет инертный газ ксенон и дикислород
PtF6 + Xe = Xe+[PtF6]–
PtF6 + O2 = [O2]+[PtF6]–
Слайд 57M + X2 = MX3 (при t > 400 oC
; X = Cl, Br, I)
2RhCl3 + 3F2 = 2RhF3
+ 3Cl2 (при t > 350oC)Ir +IrF6 = 2IrF3 (при t > 300oC)
Коммерческие препараты – RhCl3·3H2O (темно-красный) и IrCl3·3H2O (темно-зеленый).
Оксиды получают косвенным путем, поскольку металлы устойчивы к нагреванию в кислороде
RhCl3 + 3/2O2 = Rh2O3 + 3Cl2
Ir2O3 – в чистом виде не получен
Rh2O3 – хорошо охарактеризован
Соединения Rh(III) и Ir(III)
Слайд 58Известно очень много комплексов, в основном октаэдрические.
Нитритные комплексы широко используются
при получении и очистке родия:
[RhCl6]3– + 6NO2– = [Rh(NO2)6]3– +
6Cl–неблагородные металлы выпадают в осадок в виде гидроксидов
Na3[Rh(NO2)6] – хорошо растворим
(NH4)2Na[Rh(NO2)6] – плохо растворим
Комплексы Rh(III) и Ir(III)
Слайд 59Os(VIII): OsO4, молекулярная решетка, tпл=40оС, tк= 130оС
Ru(VIII): RuO4, молекулярная решетка
tпл=25оС, tк= 130оС
Os + 2O2 = OsO4 (при t
> 300 oC, медленно уже 20 оС),
очень устойчив RuO2 + 2NaIO4 = RuO4 + 2NaIO3
неустойчив, разлагается при 180 оС со взрывом:
RuO4 = RuO2 + O2
Особенности Ru и Os
Слайд 60Мировые запасы платиновых металлов ~56 тыс. тонн
В мире в 2010
г. было добыто ~433 тонны (~29 м3)
платиновых металлов
по
сравнению с 2500 тоннами золота Пенная флотация – один из
способов извлечения платины
из руды
Флотационные ячейки
на комбинате Норилький никель
Слайд 61Структура потребления платиновых металлов в 2010 году
ПЛАТИНА (187 тонн)
40%
- автокатализаторы
32% - ювелиры
6% - инвестиции
6% - химия
5% - стекловарение
4%
- медицинаПАЛЛАДИЙ (203 тонн)
58% - автокатализаторы
16% - электротехника
8% - инвестиции
7% - ювелиры
7% - стоматология
4% - химия
РОДИЙ (17 тонн)
83% - автокатализаторы
8% - химия
4% - стекловарение
Platinum 2010 Interim Review










![Побочная подгруппа VII группы ПС Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных растворах [Mn(H2O)6]2+Нерастворимые соли:MnCO3, Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных растворах [Mn(H2O)6]2+Нерастворимые соли:MnCO3, MnS, MnC2O4MnCl2 + (NH4)2S](/img/thumbs/7e9430a7be0572a76eb3b0b39c3cea41-800x.jpg)


![Побочная подгруппа VII группы ПС Общая электронная формула: […] ns 02 (n–1)d 610 Общая электронная формула: […] ns 02 (n–1)d 610](/img/thumbs/b6c21e343bc6a6caf62505fdaf58f414-800x.jpg)












![Побочная подгруппа VII группы ПС Соединения М2+ Цвет кристаллогидратов обусловлен наличием [M(H2O)6]2+ и совпадает с цветом растворов: Соединения М2+ Цвет кристаллогидратов обусловлен наличием [M(H2O)6]2+ и совпадает с цветом растворов: Fe – светлозеленый Co - розовый Ni –](/img/tmb/3/228536/40b4de4acca296ef2c95c187b376c900-800x.jpg)
















![Побочная подгруппа VII группы ПС Pd 3Pd + 18HCl + 4HNO3 = 3H2[PdCl6] + 4NO+ 8H2OPd Pd 3Pd + 18HCl + 4HNO3 = 3H2[PdCl6] + 4NO+ 8H2OPd + 4HNO3(конц.) = Pd(NO3)2 + 2NO2](/img/thumbs/db96cf27456cb68a275b71bffce2c70b-800x.jpg)

![Побочная подгруппа VII группы ПС Доминируют квадратные комплексы.[MX4]2– (X = Cl, Br, I, SCN, CN)[MX2L2] (L Доминируют квадратные комплексы.[MX4]2– (X = Cl, Br, I, SCN, CN)[MX2L2] (L = NH3, NR3, Py )[ML4]2+ (L](/img/tmb/3/228536/27caac78685c6c03e6fa71ca298db3e2-800x.jpg)
![Побочная подгруппа VII группы ПС Галогениды Pd: PdF4 и (PdF3 – PdII[PdIVF6])Pd + 2F2 = PdF4 Галогениды Pd: PdF4 и (PdF3 – PdII[PdIVF6])Pd + 2F2 = PdF4 (при t = 120 оС )Галогениды](/img/thumbs/2380bc720003015dfcd86c9a33be34c3-800x.jpg)
![Побочная подгруппа VII группы ПС Множество термодинамически стабильных и кинетически инертных октаэдрических комплексов.Например синтезирован весь ряд Множество термодинамически стабильных и кинетически инертных октаэдрических комплексов.Например синтезирован весь ряд от [PtCl6]2– ….. [PtClx(NH3)6–x] ….. [Pt(NH3)6]4+](/img/thumbs/36221289daa3c2cbea9233180bb09b55-800x.jpg)


![Побочная подгруппа VII группы ПС Известно очень много комплексов, в основном октаэдрические.Нитритные комплексы широко используются при Известно очень много комплексов, в основном октаэдрические.Нитритные комплексы широко используются при получении и очистке родия:[RhCl6]3– + 6NO2–](/img/thumbs/879d1dc6025ef031b9a52f92e452d967-800x.jpg)