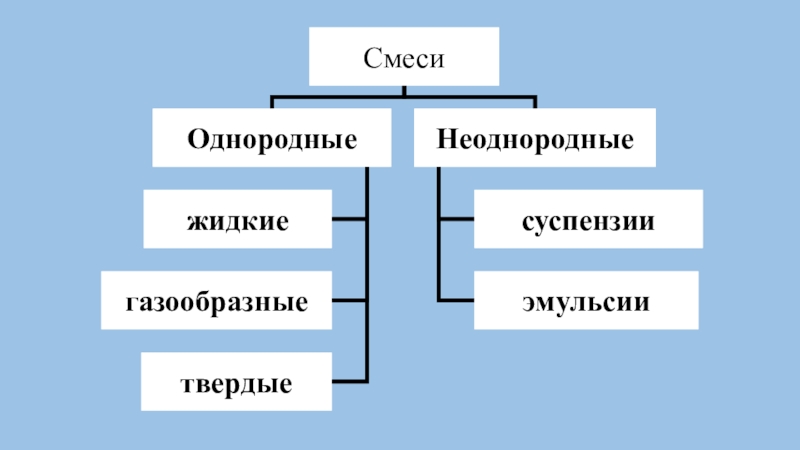
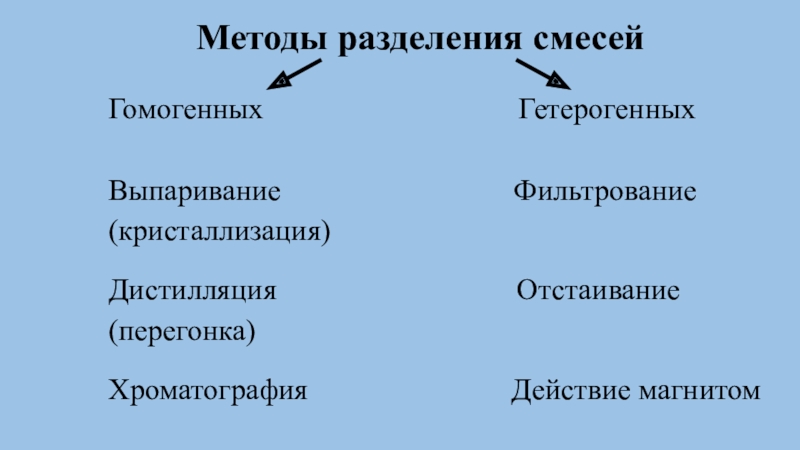
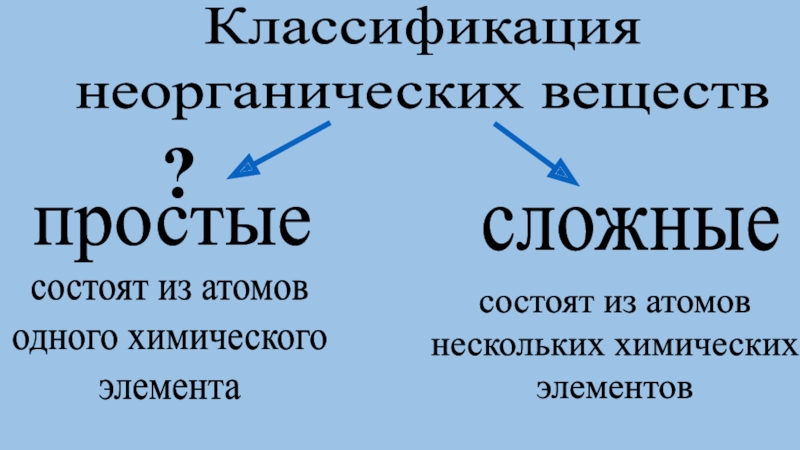
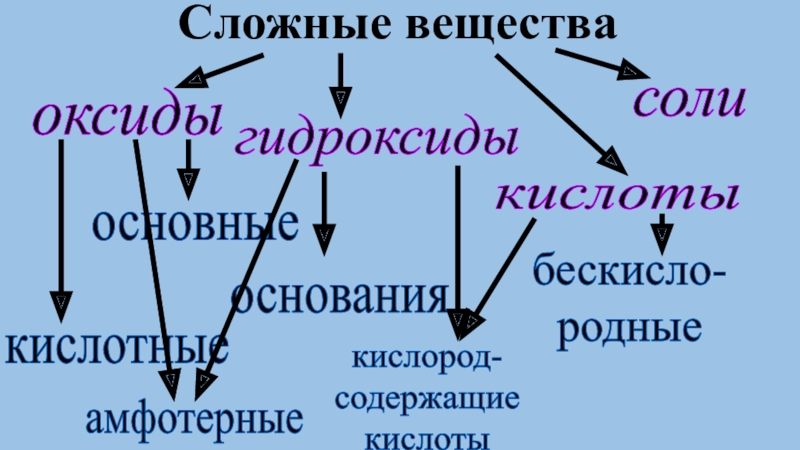
и простое вещество.
Физические свойства кислорода и водорода.
Классы неорганических веществ, их
состав и свойства.Генетическая связь между классами неорганических веществ.
Типы химических реакций.
Расчёт массовой доли элемента.
Массовая доля растворённого вещества в растворе.
Расчёты по уравнениям химических реакций.
Периодический закон
Строение атома.