в 2-3 мм сухих порошков медного купороса CuSO4·5H2O и пищевой
соды NaHCO3. Перемешайте. Какой эффект?Реакция:
2CuSO4 + 4NaHCO3 = (CuOH)2CO3↓ + 3CO2↑ + 2Na2SO4 + H2O
Опыт 1
Эффект:
бирюзовый
(малахит)
бесцветный
2. В сухую смесь добавьте около 2-3 мл воды.

![ПРАКТИЧЕСКАЯ РАБОТА
Генетическая связь между классами
неорганических соединений [ПО УРОКУ]В КЛАССЕ ВЫПОЛНЕНИЕ – ДОМА ОФОРМЛЕНИЕ (презентация будет) [ПО УРОКУ]В КЛАССЕ ВЫПОЛНЕНИЕ – ДОМА ОФОРМЛЕНИЕ (презентация будет)](/img/tmb/4/307964/27ce7b9d672435cd09b31a0ee61fc652-800x.jpg)

![ПРАКТИЧЕСКАЯ РАБОТА
Генетическая связь между классами
неорганических соединений [Учителю] Задайте вопрос детям, что нужно, чтобы «запустить» химическую реакцию. Объясните, [Учителю] Задайте вопрос детям, что нужно, чтобы «запустить» химическую реакцию. Объясните, что проблема гетерогенных реакций – это](/img/thumbs/44491249f149319685ef892443c26244-800x.jpg)


![ПРАКТИЧЕСКАЯ РАБОТА
Генетическая связь между классами
неорганических соединений [Учителю] В процессе работы учителю стоит озвучить, что NO2 токсичный, и [Учителю] В процессе работы учителю стоит озвучить, что NO2 токсичный, и сразу после получения его следовых (!)](/img/thumbs/6476001f94e1e7e3f5635589165d3299-800x.jpg)

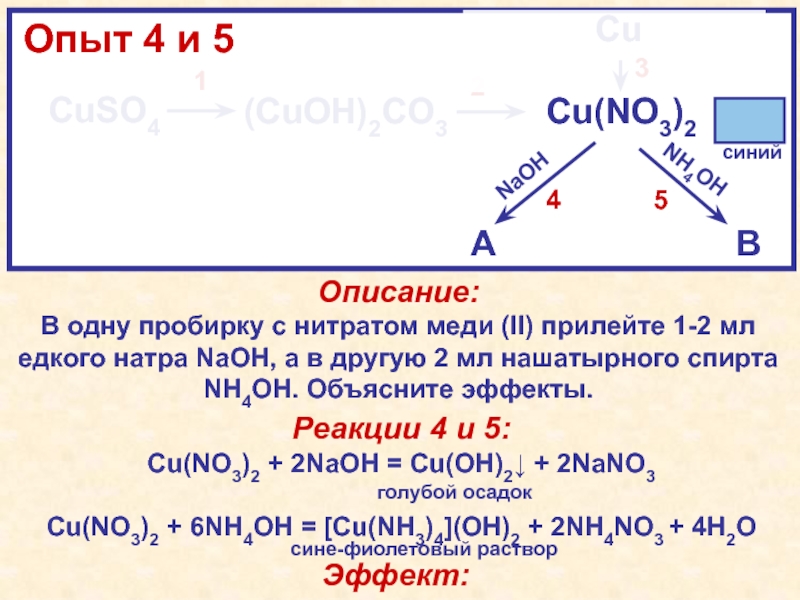
![ПРАКТИЧЕСКАЯ РАБОТА
Генетическая связь между классами
неорганических соединений [Учителю] В этой части поясните детям, что несмотря на то, что [Учителю] В этой части поясните детям, что несмотря на то, что в обеих пробирках у них нитраты](/img/thumbs/627a036002cfb96261191f1bb58c0a91-800x.jpg)



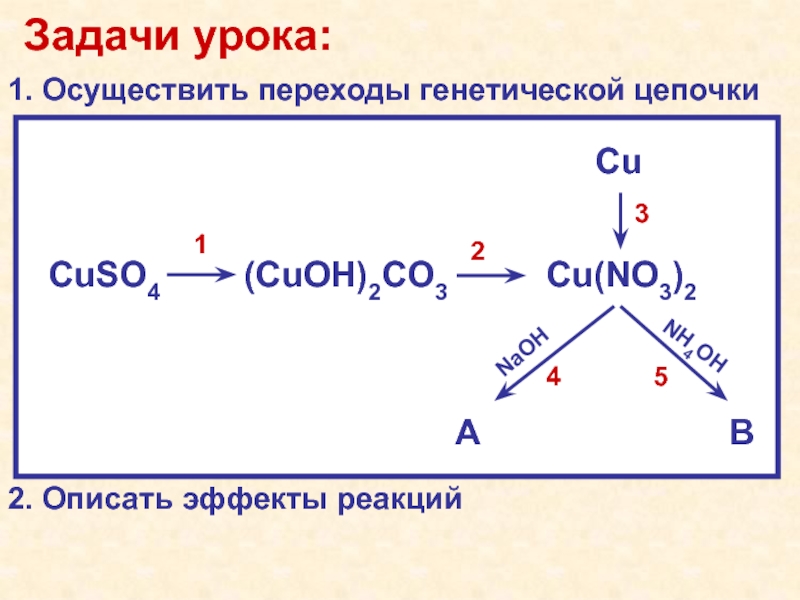
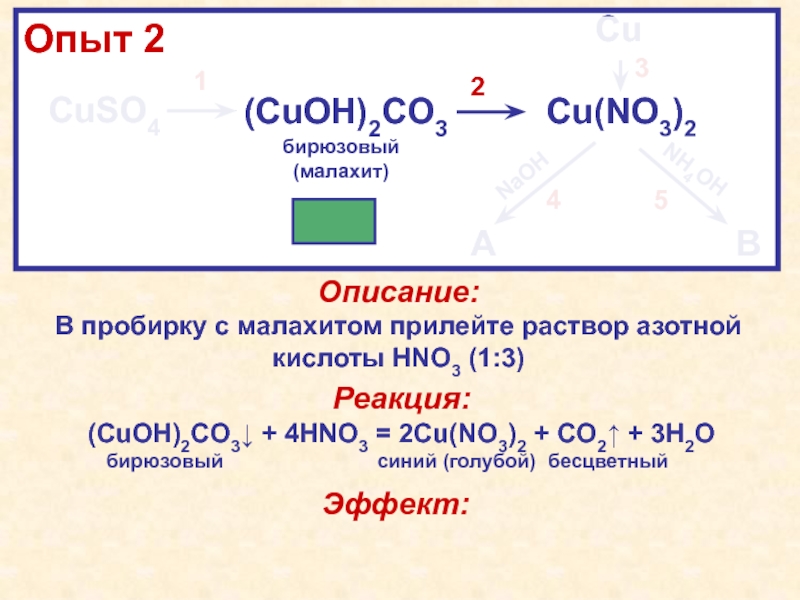
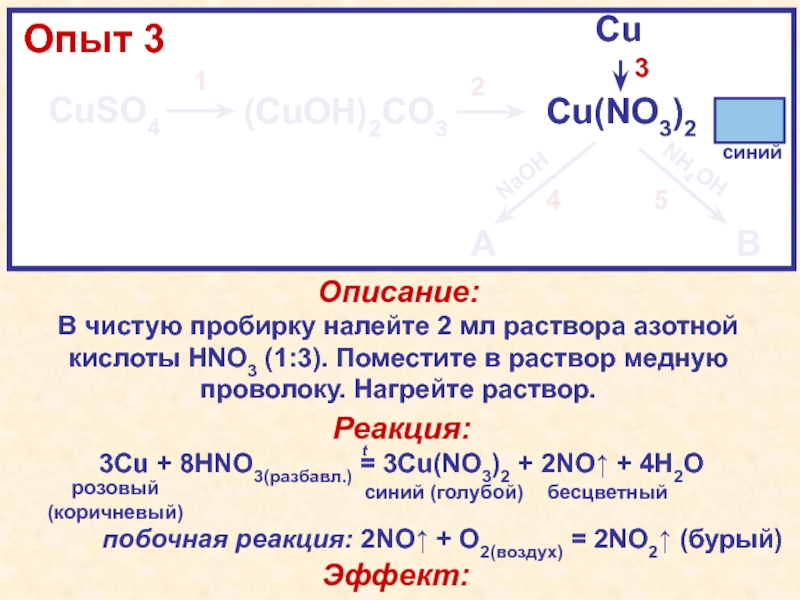
2бирюзовый(малахит)NaHCO3HNO3HNO3, tКачественная особенность: соединения меди (II) в растворах синего цвета CuSO4·5H2O(CuOH)2CO3↓Cu(NO3)2CuNaOHNH4OHИтоговая схема урока: синийCu(OH)2↓[Cu(NH3)4](OH)2бирюзовый(малахит)NaHCO3HNO3HNO3, tКачественная особенность: соединения меди (II) в растворах синего цвета](/img/tmb/4/307964/9bedcc60ec086f1115638761248c7a11-800x.jpg)
![ПРАКТИЧЕСКАЯ РАБОТА
Генетическая связь между классами
неорганических соединений [УЧИТЕЛЮ] Штативы с тремя пробирками – 1 – сухая, 2 – [УЧИТЕЛЮ] Штативы с тремя пробирками – 1 – сухая, 2 – с медной проволокой, 3 – с](/img/tmb/4/307964/d5e9bca1f80d42ad1f0a6d2e71120cb4-800x.jpg)
2бирюзовый(малахит)NaHCO3HNO3HNO3, tКачественная особенность: соединения меди (II) в растворах синего цвета CuSO4·5H2O(CuOH)2CO3↓Cu(NO3)2CuNaOHNH4OHСхема работы на уроке: синийCu(OH)2↓[Cu(NH3)4](OH)2бирюзовый(малахит)NaHCO3HNO3HNO3, tКачественная особенность: соединения меди (II) в растворах синего цвета](/img/tmb/4/307964/46deadb41b98156a3b6554243743afb0-800x.jpg)

![Рассказ ШУБА ДЛЯ ПУШКА АВТОМАТИЗАЦИЯ звука [ Ш ]](/img/thumbs/9ffb264870f32de8ed2b3218faa1c354-800x.jpg)