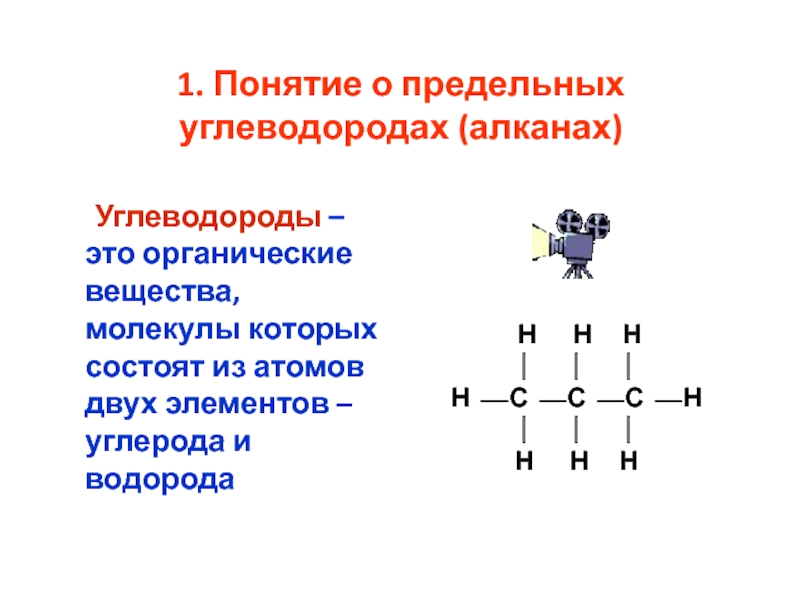
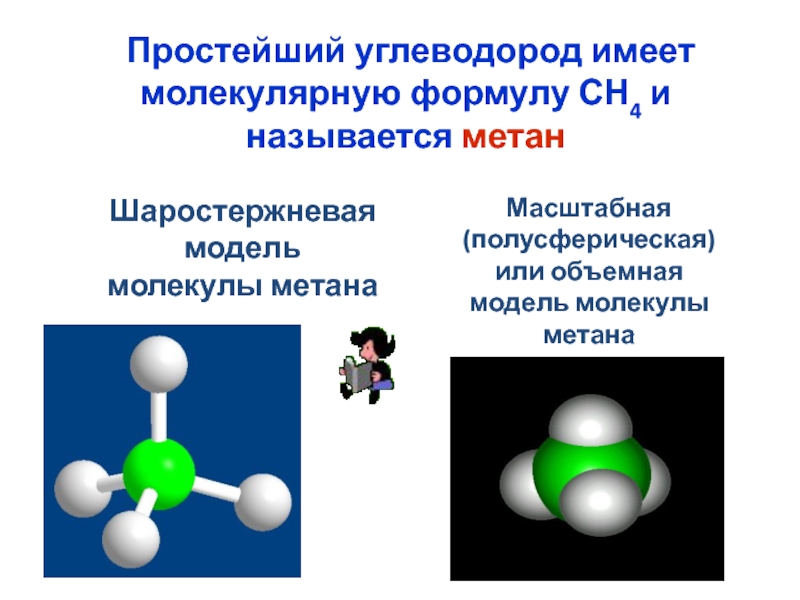
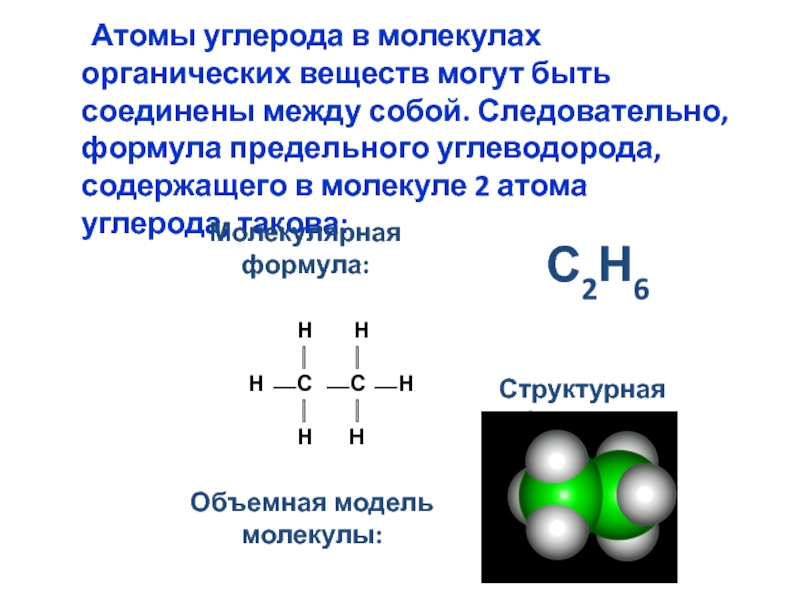
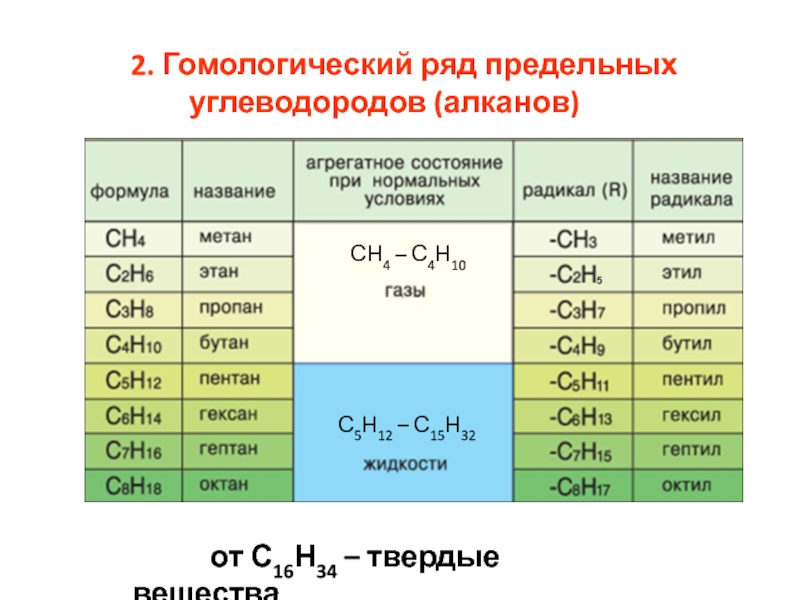
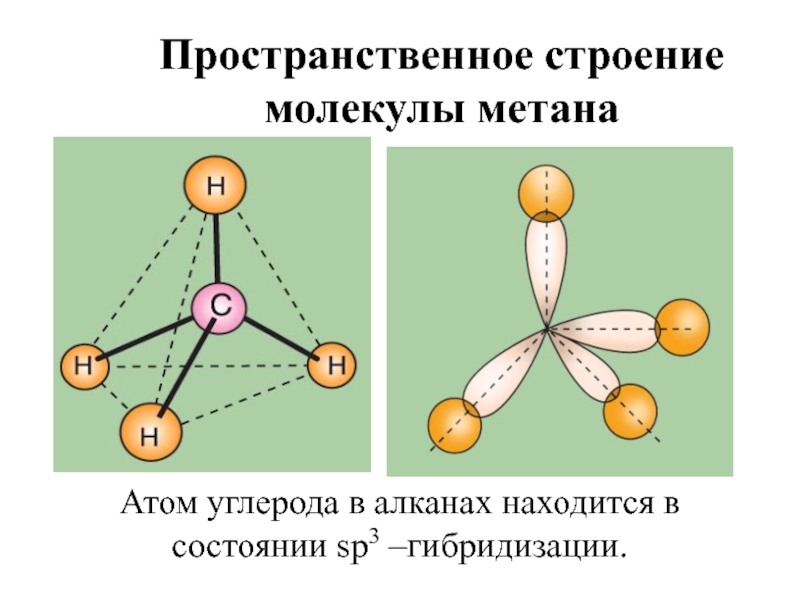
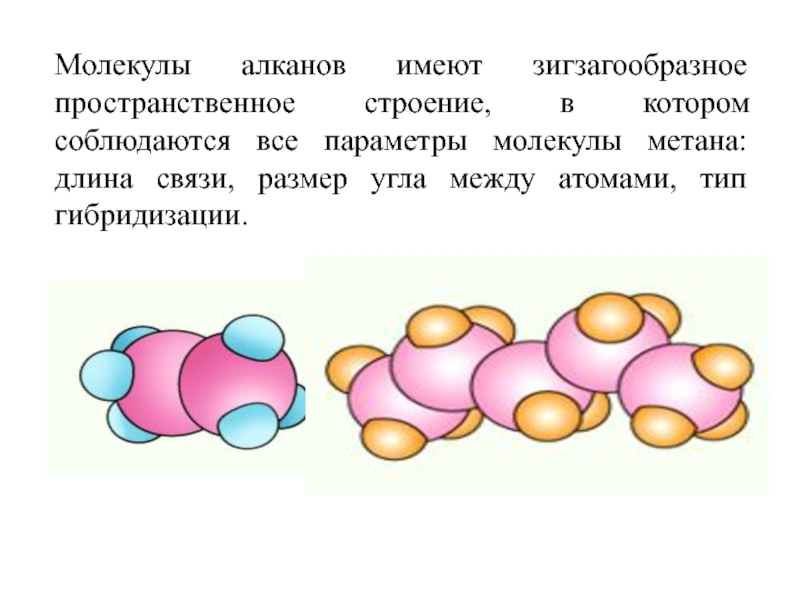
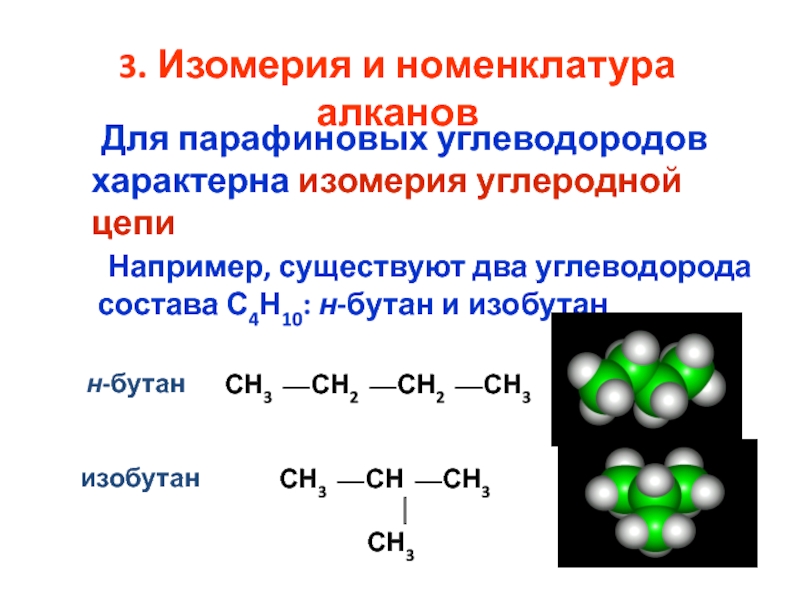
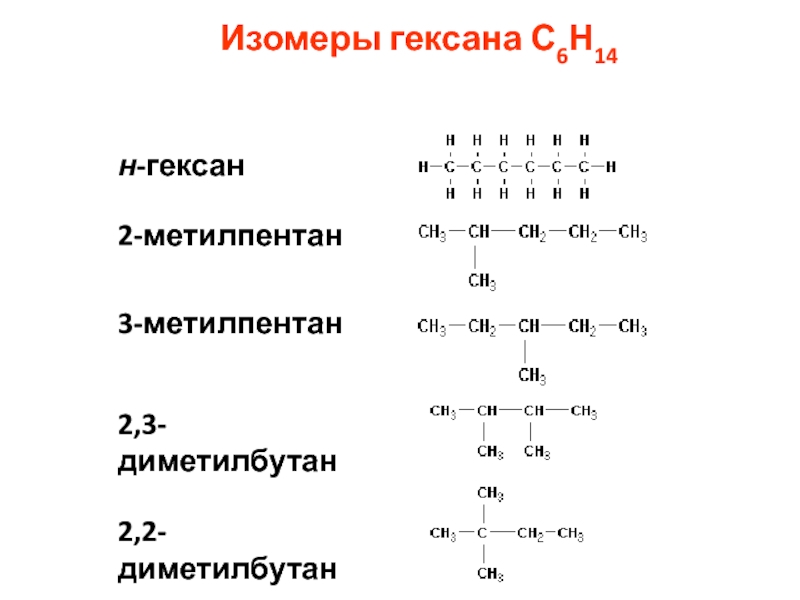
номенклатура алканов
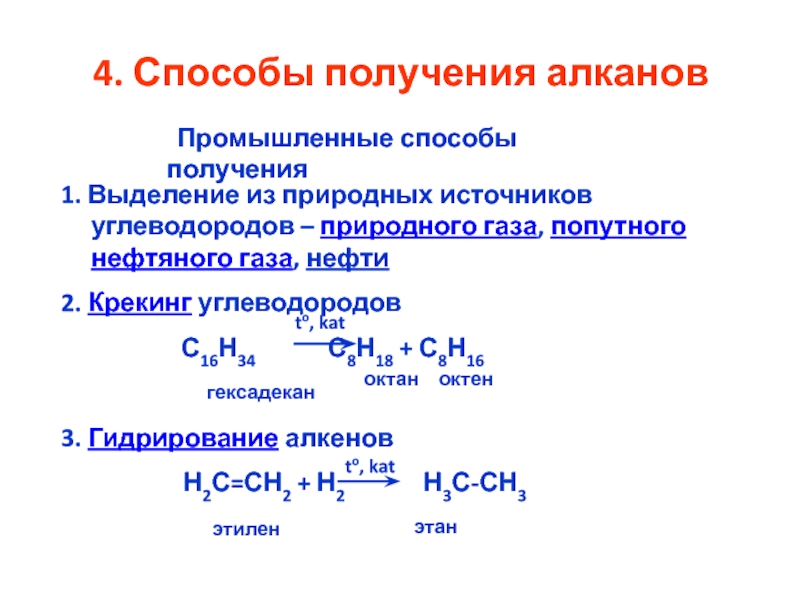
Способы получения и физические свойства алканов
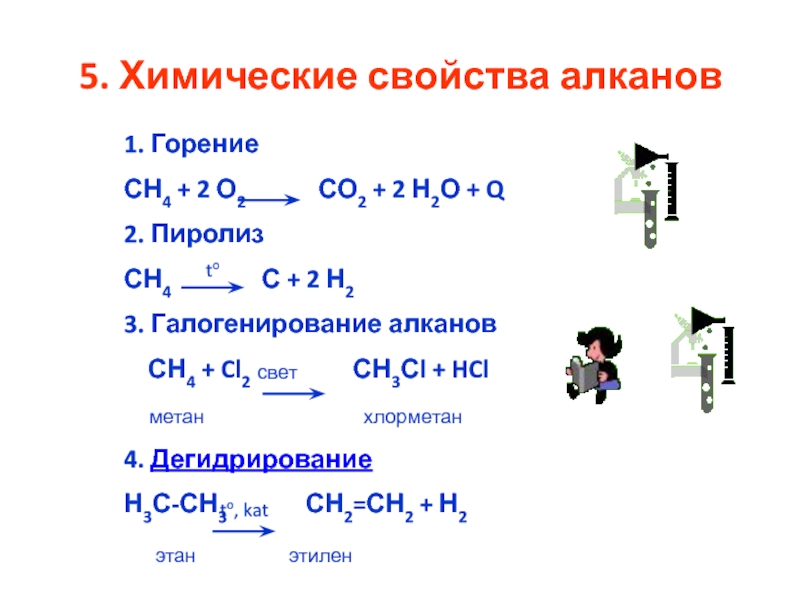
Химические свойства алканов
Области применения
предельных углеводородовПроверь себя