Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Применение лазеров в медицине
Содержание
- 1. Применение лазеров в медицине
- 2. Лазерная диагностикаЗадача диагностики – достоверное извлечение информации
- 3. Принципы лазерной диагностикиМетоды лазерной диагностики можно разделить
- 4. Лазерная захватывающая микродиссекция (ЛМЗ) как пример разрушающего
- 5. В коммерческих системах для лазерной микродиссекции используются,
- 6. Использование лазерного луча, сфокусированного объективом микроскопа, в
- 7. Лазерная макродиагностикаВ основе – использование высокой монохроматичности
- 8. Голография и интерферометрияГолографические методы позволяют получать трехмерные
- 9. ФлуориметрияЛазер как источник излучения (возбуждающего флуоресценцию) очень
- 10. ПРИМЕНЕНИЕ ЛАЗЕРОВ В ДИАГНОСТИКЕ (спектры собственной
- 11. Слайд 11
- 12. Флуоресцентная ангиографияФлуоресцентная ангиография (ФАГ) – метод исследования
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Принцип получения информацииКлеточная суспензия, предварительно меченная флуоресцирующими
- 18. Преимуществакороткое время анализа (сек) за счет высокой
- 19. Лазерная пролётная цитометрия с многопараметрическим подходом, основанным
- 20. Слайд 20
- 21. Принципиальная схема флуоресцентного микроскопа.
- 22. Виды флуоресцентных красителей. Флуоресцеины.Области применения: Производные флуоресцеина
- 23. Виды флуоресцентных красителей. Области применения: Красители родаминового
- 24. Виды флуоресцентных красителей. Родамины.Карбокси-Х-родамин (ROX)Тетраметилкарбоксиродамин (TAMRA) TAMRA
- 25. Виды флуоресцентных красителей. Гасители флуоресценции.Области применения: Dabsyl
- 26. Конфокальный микроскоп
- 27. Mushroom spices are eliminated in 6 month’s
- 28. DARPP-32, MAP2 100х to visualize co-localization of cortex cells and MSNs
- 29. ЛазерКоллиматорСветоделительнаяпризмаОбъективПрепаратPinhole (диафрагма)ФотоумножительСканирующиезеркалаПринцип конфокальности
- 30. Что значит «конфокальный»? Конфокальный микроскоп
- 31. Вторая особенность состоит в
- 32. Альтернативой является использование светоделительной
- 33. Сканирование проходит слоями
- 34. Таким образом получили две большие разницы
- 35. Изображения высокого качества
- 36. Wild type mouse hippo culture 16 DIV
- 37. Слайд 37
- 38. Слайд 38
- 39. Сенсибилизаторы второго поколения на основе хлорофилла а Флуоресцентная диагностика раковых опухолей
- 40. Спектры поглощения исходного препарата «Радахлорин», разбавленного физиологическим раствором до концентрации 0,0014% и 0,007%
- 41. Двумерный спектр люминесценции препарата «Радахлорин» с концентрацией 0,0014%
- 42. Слайд 42
- 43. Рис.5 Наглядное представление о проведении сеанса
- 44. Сеанс проведения люминесцентного анализа (в темноте).
- 45. Оптическая когерентная томография(ОКТ)-1)это метод медицинского имиджинга, позволяющий
- 46. Биологические ткани являются прекрасным объектом для оптической
- 47. Что изучает ОКТ?кожаслизистые оболочки шейки маткипищеводамочевого пузыряжелудкатонкого и толстого кишечника
- 48. Все эти ткани имеют общие признаки гистологического
- 49. Основными преимуществами ОКТ являются:изображение в реальном времени
- 50. Физический принцип
- 51. Использование метода ОКТ в видеоэндоскопии.
- 52. Эндоскопический торцевой OКT-микрозонд в биопсийном канале фиброгастроскопа.
- 53. Показания к применению ОКТ детекция патологических изменений,
- 54. ОфтальмологияСкан макулярной области сетчатки в норме. Прибор представляет черно-белое
- 55. Трехмерная реконструкция макулярной области сетчатки глаза того же пациента
- 56. Трехмерная реконструкция области диска зрительного нерва (оптический срез проходит через зрительный нерв).
- 57. Сквозное сенильное (возрастное) макулярное отверстие. Диаметр отверстия у вершины 513 мкм.
- 58. Трехмерная реконструкция макулярной области сетчатки того же пациента. Хорошо визуализируются изменения в слоях сетчатки вокруг отверстия.
- 59. ОКТ того же пациента до и после хирургического лечения (витрэктомия).
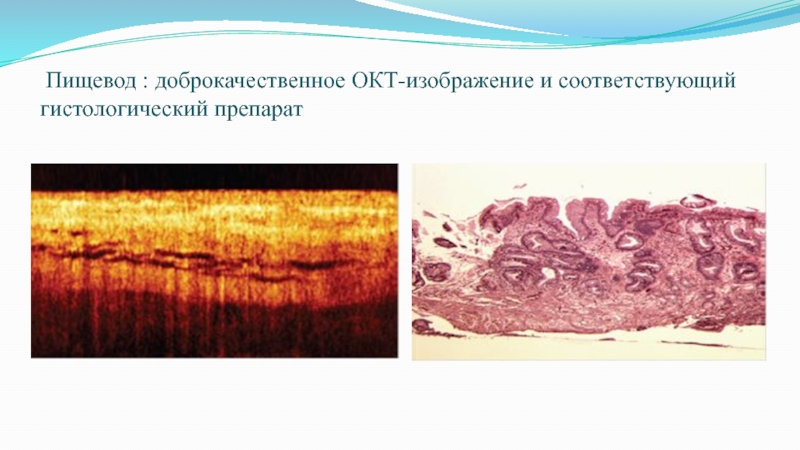
- 60. Пищевод : доброкачественное ОКТ-изображение и соответствующий гистологический препарат
- 61. Высокая степень дисплазии метапластического эпителия – ОКТ-изображение и соответствующий гистологический препарат
- 62. ОптогенетикаМетод, объединяющий в себе оптику и генетику
- 63. Шаг 1: Вставить гены опсинов в желаемые
- 64. Шаг 2: Активация белков-опсинов с помощью света
- 65. ПреимуществаНаправленный контроль активности одного типа клеток при
- 66. Быстрое возбуждение: Каналородопсин
- 67. Халородопсин (Halorhodopsin)Халоропсин (Halorhodopsin) использует оранжевый свет для
- 68. Активация кортикальных нейронов, экспрессирующих ChR2 (Channelrhodopsin2) синим светом 1Деполяризация клеткиИмпульстная активация потенциалов действияТоническая световая активация
- 69. Нейроны коры и стриатума (средние шипиковые нейроны-
- 70. Контроль активности нейронов коры и стриатума в смешанной культуре синим светом. Только нейроны кортекса экспрессируют ChR2CorticalMSN
- 71. Контроль активности нейронов коры и стриатума в смешанной культуре оранжевым светом. Только нейроны кортекса экспрессируют HalorhodopsinCorticalMSN
- 72. Слайд 72
- 73. Испытательная установка (на клеточных культурах нейронов)Общий вид экспериментального комплексаИсследовательские возможности ЛМН
- 74. Будущее оптогенетикиДанная разработка позволит увеличить точность позиционирования
- 75. Разработки в мире1.2.Гибкий массив электродов, моделируемый по
- 76. CПАСИБО ЗА ВНИМАНИЕ!
- 77. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Применение лазеров в медицине
Профессор Власова О.Л.
Кафедра медицинской физики
Института физики,
нанотехнологий и телекоммуникаций Санкт-Петербургский Политехнический университет Петра Великого
Слайд 2Лазерная диагностика
Задача диагностики – достоверное извлечение информации о состоянии организма
и патологических изменений в нём.
Поэтому – любое воздействие извне с
одной стороны нежелательно, с другой стороны без воздействия нет отклика.Все-таки при диагностике низкоинтенсивные воздействия, не вызывающие необратимых изменений в организме, применяются значительно шире, чем высокоинтенсивные, после которых биологическая ткань либо перестает существовать вообще как организованная структура, либо погибает.
Высокоинтенсивное излучение применяется, когда необходимо исследовать продукты разрушения биотканей.
В основном, информацию получают, используя эффекты светорассеяния или флуоресценции.
Слайд 3Принципы лазерной диагностики
Методы лазерной диагностики можно разделить на:
Микродиагностические (на уровне
атомов и молекул) – линейная и нелинейная лазерная спектроскопия
Макродиагностические (на
уровне клеток и органелл, органов) – упругое и квазиупругое рассеяние, эффект Доплера, флуоресценция, интерферометрия и голография.Примеры микродиагностики, в основном, связаны с использованием лазеров для пробоподготовки.
Резонансная фотоионизация молекул с помощью лазера с традиционной масс-спектрометрией позволяет, например, определить концентрацию триптофана в воде на уровне 10-14 г. ЛАММА -метод (лазерная микроаналитическая масс-спектрометрия)– отбор пробы путем её испарения с помощью лазера с поверхности биообъекта и дальнейшего масс-спектрометрического анализа пара.
Неразрушающая микродиагностика , например: лазерная микрофлуориметрия отдельных клеток или органелл
Слайд 4Лазерная захватывающая микродиссекция (ЛМЗ) как пример разрушающего действия лазера в
диагностике — метод изоляции отдельных клеток с необходимыми характеристиками из
биологических образцов ткани, позволяющий избежать возможных повреждений или изменений клетки либо минимизировать их.ЛЗМ позволяет избежать повреждений морфологии клетки и её химического состава, что делает этот метод оптимальным при изучении ДНК, РНК, белкового состава клетки. Среди возможных образцов — мазки крови, цитологические препараты, культуры клеток, и даже замороженные и парафинированные образцы.
Прозрачная плёнка накладывается на образец, затем нужные клетки идентифицируются под микроскопом. Под воздействием лазерного луча ИК диапазона клетки слипаются с плёнкой и вместе с ней вынимаются из образца для дальнейшего исследования.
Слайд 5В коммерческих системах для лазерной микродиссекции используются, как правило, следующие
лазеры: азотный лазер (337 нм), а также твердотельные лазеры с
умножением частоты на кристаллах Nd:YAG (355 нм). Лазерные линии выбраны таким образом, что они попадают в зону А (320- 400 нм) ультрафиолетовой области, где поглощение ультрафиолетового излучения молекулами ДНК, РНК и белков, а следовательно, и их повреждение минимально. Это обеспечивает лучшую сохранность материала для молекулярно-генетического и биохимического анализа.С помощью лазерной микродиссекции, например, отделяют опухолевую ткань от нормальной или же вырезают различные компоненты опухолей из биопсийного материала.
Слайд 6Использование лазерного луча, сфокусированного объективом микроскопа, в качестве «режущего» инструмента
позволяет выделять объекты интереса микроскопических размеров с высокой точностью.
А
- жировая ткань; В - Этапы выделения адипоцитов методом лазерной микродиссекции.Слайд 7Лазерная макродиагностика
В основе – использование высокой монохроматичности и когерентности лазерного
излучения, которая позволяет измерять положение, скорость, форму компонентов и самих
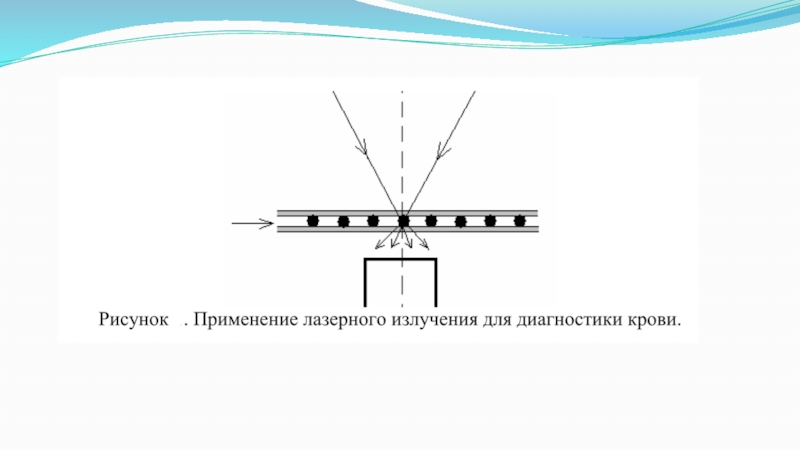
биообъектов. В основном, используются эффекты светорассеяния (нефелометры, проточные цитометры) и флуоресценции (микроскопия и др.).Примеры использования эффекта светорассеяния:
1.Лазерный индикатор иммунологических реакций. Основан на измерении интегральной интенсивности рассеянного света в суспензиях отдельно антигена (I1), антител(I2) и в их смеси (I3). Реакция произошла, если К=10 (I1+I2)I3 лежит в интервале 0-8.
2. Упругое рассеяние лазерного излучения – метод измерения деформируемости эритроцитов (экмацитометрия). Лазерный луч пропускают через суспензию эритроцитов, помещенных между вращающимися прозрачными цилиндрами и наблюдают дифракционную картину, вид которой зависит от формы эритроцитов (недеформированные – концентрические окружности, деформированные – эллипсы).
3. Лазерная пролетная цитометрия.
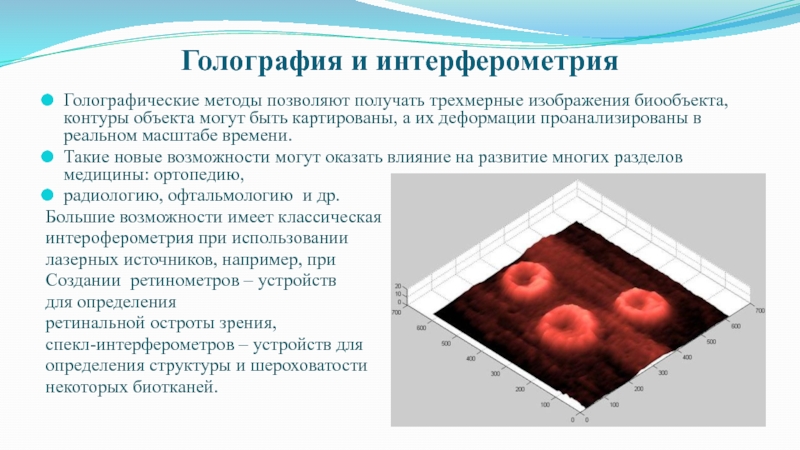
Слайд 8Голография и интерферометрия
Голографические методы позволяют получать трехмерные изображения биообъекта, контуры
объекта могут быть картированы, а их деформации проанализированы в реальном
масштабе времени.Такие новые возможности могут оказать влияние на развитие многих разделов медицины: ортопедию,
радиологию, офтальмологию и др.
Большие возможности имеет классическая
интероферометрия при использовании
лазерных источников, например, при
Создании ретинометров – устройств
для определения
ретинальной остроты зрения,
спекл-интерферометров – устройств для
определения структуры и шероховатости
некоторых биотканей.
Слайд 9Флуориметрия
Лазер как источник излучения (возбуждающего флуоресценцию) очень часто используется в
ходе флуоресцентного анализа, например:
1. При анализе собственной флуоресценции живых тканей
с помощью спектрометров.2. При флуоресцентной микроскопии с использованием флуоресцентных красителей (конфокальный микроскоп).
3. При флуоресцентной диагностике опухолевых тканей с использованием фотосенсибилизатора.
Слайд 10ПРИМЕНЕНИЕ ЛАЗЕРОВ В ДИАГНОСТИКЕ
(спектры собственной флуоресценции)
Спектры флуоресценции от
почки (а) и предстательной железы (б) крысы: 1 — здоровый
орган, 2 — опухолевыйПрименение лазерных флуоресцентных спектрометров с высокой спектральной плотностью мощности возбуждения позволило повысить скорость и качества получения спектров собственной флуоресценции и поднять общий уровень исследований в этом направлении.
Отличия спектров объясняются либо изменениями среды, окружающей флуорофоры, либо производством новых флуорофоров, индуцированным биохимическими изменениями в клетках или в окружающей их среде.
Слайд 12Флуоресцентная ангиография
Флуоресцентная ангиография (ФАГ) – метод исследования сосудов сетчатки, заключающийся
во внутривенном введении красителя – флуоресцеина и наблюдении за его
прохождением по сосудам глазного дна. При освещении голубым светом с длиной волны около 490 нм молекулы флуоресцеина активируются и начинают излучать световые волны иного спектра (около 530 нм) желто-зеленого цвета. Специальная камера фиксирует изображение глазного дна на различных этапах прохождения флуоресцеина по сосудам.Слайд 17Принцип получения информации
Клеточная суспензия, предварительно меченная флуоресцирующими моноклональными антителами или
флуоресцентными красителями, попадает в поток жидкости, проходящий через проточную ячейку.
Условия подобраны таким образом, что клетки выстраиваются друг за другом за счет гидродинамического фокусирования в струе. В момент пересечения клеткой лазерного луча детекторы фиксируют:рассеяние света под малыми углами (от 1° до 10°) (данная характеристика используется для определения размеров клеток).
рассеяние света под углом 90° (позволяет судить о соотношении ядро/цитоплазма, а также о неоднородности и гранулярности клеток).
интенсивность флуоресценции по нескольким каналам - позволяет определить субпопуляционный состав клеточной суспензии и др.
Слайд 18Преимущества
короткое время анализа (сек) за счет высокой скорости
анализ большого количества
клеток (до 108 клеток)
детектирование субпопуляций клеток
измерение параметров редко встречающихся клеток
объективное
измерение интенсивности флуоресценцииСлайд 19Лазерная пролётная цитометрия с многопараметрическим подходом, основанным на светорассеянии (например,He-Ne
лазер 633 нм) , иногда в сочетании с микрофлуориметрией (например,
используется аргоновый - 488 нм или He-Cd лазер -441 нм).При таком подходе одновременно измеряется ряд сигналов от отдельной клетки, например, рассеяние вперёд и под углом 90 градусов (ортогональное рассеяние).
Такой подход позволяет довольно эффективно дифференцировать клетки крови по их морфологии.
Слайд 22Виды флуоресцентных красителей.
Флуоресцеины.
Области применения:
Производные флуоресцеина являются наиболее распространенными
флуоресцентными метками, вводимыми в олигонуклеотиды.
Максимум возбуждения для производных флуоресцеина
находится в диапазоне спектральных линий аргонового (488 нм) и Nd:YAG (477 нм) лазеров, что делает этот краситель незаменимым в таких областях, как: 1.ДНК анализ с лазер-индуцируемой флуоресцентной детекцией;
2.микроскопия с конфокальным лазерным сканированием;
3.проточная цитофлуориметрия.
Работают при рН = 7
Слайд 23Виды флуоресцентных красителей.
Области применения:
Красители родаминового ряда снискали широкое
применение в качестве олигонуклеотидных меток. В отличие от производных флуоресцеинов,
их спектральные характеристики не меняются в диапазоне рН от 4 до 10.Карбоксиродамины используются в различных молекулярно-биологических приложениях, таких как:
1.автоматическое секвенирование ДНК;
2.количественная ПЦР в реальном времени;
3.флуоресцентная in situ гибридизация;
4.детекция на ДНК-чипах.
Родамины.
Слайд 24Виды флуоресцентных красителей.
Родамины.
Карбокси-Х-родамин (ROX)
Тетраметилкарбоксиродамин (TAMRA)
TAMRA используется прежде всего
в качестве акцептора флуоресценции в зондах, применяемых для проведения количественного
ПЦР в реальном времени.6-Карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (6-JOE)
традиционно используется при автоматическом секвенировании ДНК.Промежуточный по сравнению с другими красителями спектр поглощения/флуоресценции 6JOE, высокий квантовый выход и низкая чувствительность к изменению рН (рКа ~4.3) в диапазоне близком к физиологическому, позволяют использовать этот краситель для целого ряда молекулярно-биологических приложений.
Слайд 25Виды флуоресцентных красителей.
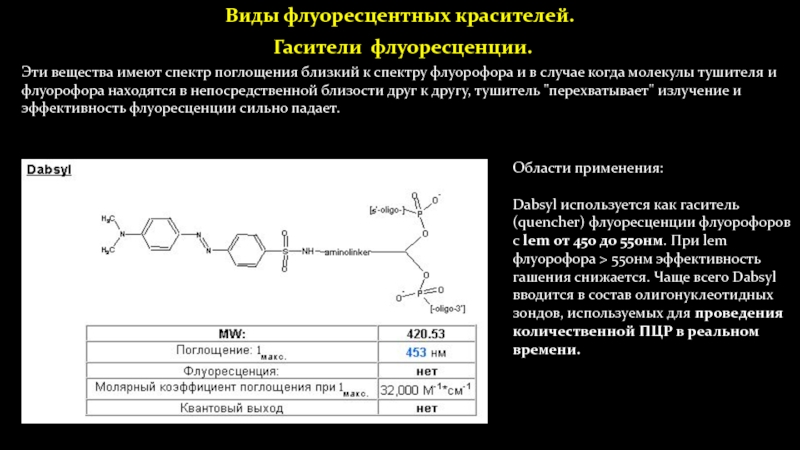
Гасители флуоресценции.
Области применения:
Dabsyl используется как гаситель
(quencher) флуоресценции флуорофоров с lem от 450 до 550нм. При
lem флуорофора > 550нм эффективность гашения снижается. Чаще всего Dabsyl вводится в состав олигонуклеотидных зондов, используемых для проведения количественной ПЦР в реальном времени.Эти вещества имеют спектр поглощения близкий к спектру флуорофора и в случае когда молекулы тушителя и флуорофора находятся в непосредственной близости друг к другу, тушитель "перехватывает" излучение и эффективность флуоресценции сильно падает.
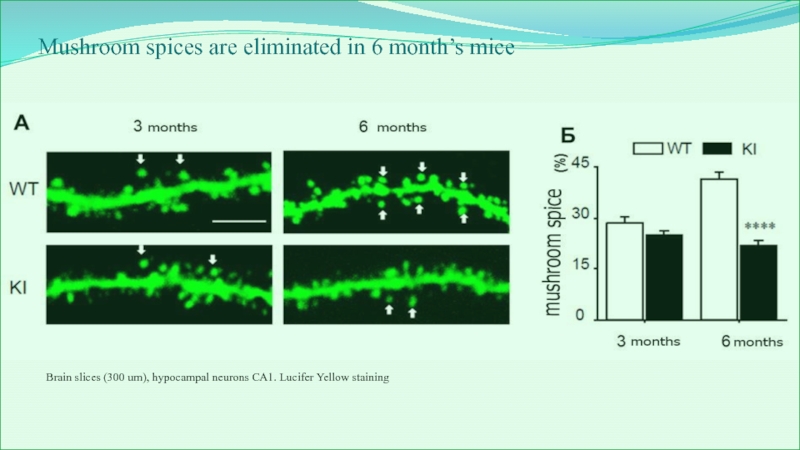
Слайд 27Mushroom spices are eliminated in 6 month’s mice
Brain slices (300
um), hypocampal neurons СА1. Lucifer Yellow staining
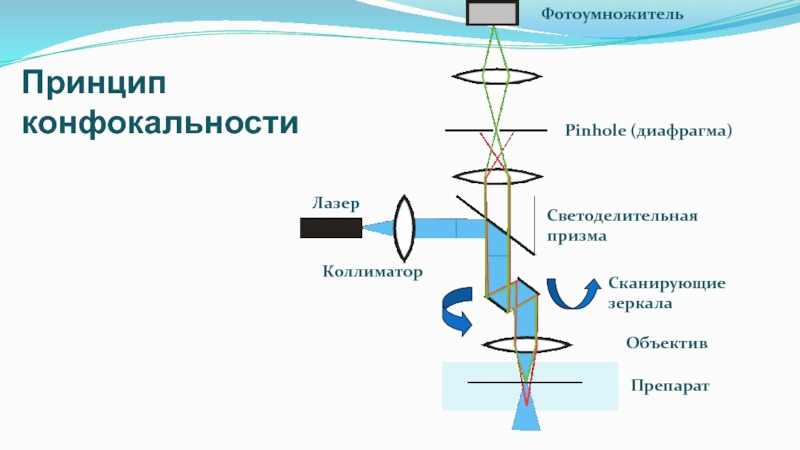
Слайд 29Лазер
Коллиматор
Светоделительная
призма
Объектив
Препарат
Pinhole (диафрагма)
Фотоумножитель
Сканирующие
зеркала
Принцип конфокальности
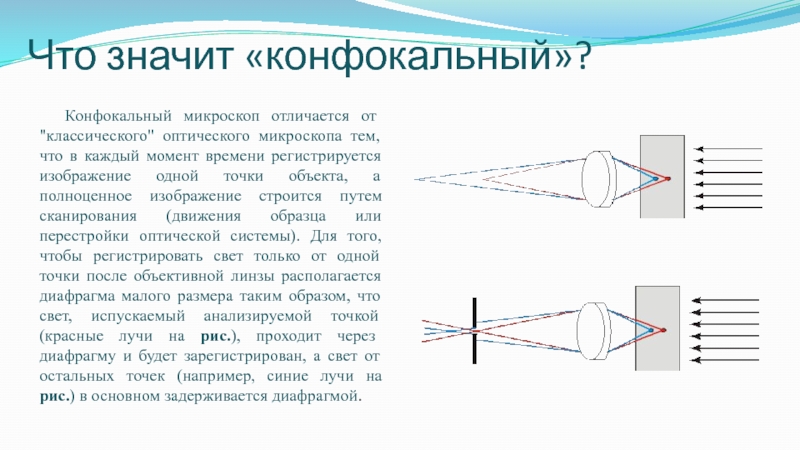
Слайд 30Что значит «конфокальный»?
Конфокальный микроскоп отличается от "классического"
оптического микроскопа тем, что в каждый момент времени регистрируется изображение
одной точки объекта, а полноценное изображение строится путем сканирования (движения образца или перестройки оптической системы). Для того, чтобы регистрировать свет только от одной точки после объективной линзы располагается диафрагма малого размера таким образом, что свет, испускаемый анализируемой точкой (красные лучи на рис.), проходит через диафрагму и будет зарегистрирован, а свет от остальных точек (например, синие лучи на рис.) в основном задерживается диафрагмой.Слайд 31 Вторая особенность состоит в том, что осветитель
создает не равномерную освещенность поля зрения, а фокусирует свет в
анализируемую точку . Это может достигаться расположением второй фокусирующей системы за образцом, но при этом требуется, чтобы образец был прозрачным. Кроме того, объективные линзы обычно сравнительно дорогие, поэтому использование второй фокусирующей системы для подсветки мало предпочтительно.Слайд 32 Альтернативой является использование светоделительной пластинки. Схема со
светоделительной пластинкой упрощает конструкцию микроскопа за счет двойного использования
объектива (для подсветки и сбора отраженного сигнала).
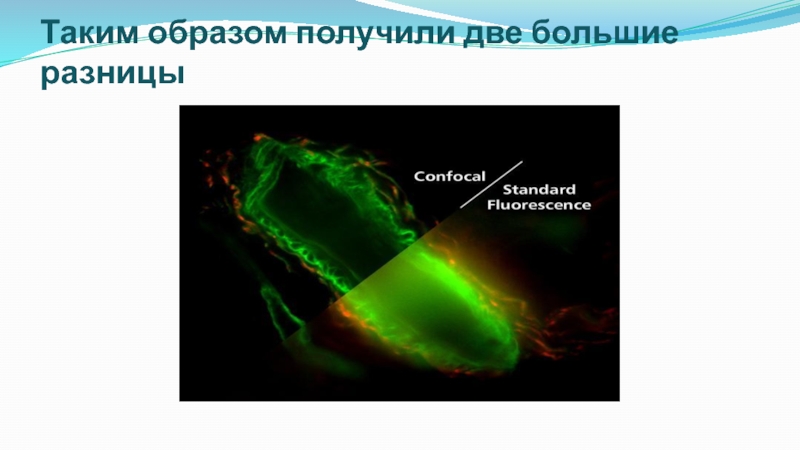
Конфокальная микроскопия обеспечивает увеличение контраста изображения за счет применения подсветки сфокусированной объективной линзой в область анализа и размещения диафрагмы в плоскости наблюдения перед фотодетектором. Такое увеличение контрастности приводит к возможности разрешения объектов, имеющих разницу в интенсивности до 200:1.
В конфокальной микроскопии несколько улучшается разрешение в плоскости объекта (в 1.5 раза) и достигается высокое разрешение вдоль оптической оси.
Платой за полученные улучшения является необходимость применения схем сканирования, либо путем перемещения образца, либо путем перестройки оптической системы. Применение сканирования позволяет увеличить поле зрения по сравнению с обычными оптическими микроскопами.
Слайд 36Wild type mouse hippo culture 16 DIV was stained with
anti-EB3 (green) and anti-MAP2 (red) antibodies, confocal microscopy, x60, x100
Слайд 39Сенсибилизаторы второго поколения на основе хлорофилла а
Флуоресцентная диагностика раковых
опухолей
Слайд 40Спектры поглощения исходного препарата «Радахлорин», разбавленного
физиологическим раствором до концентрации
0,0014% и 0,007%
Слайд 45
Оптическая когерентная томография(ОКТ)-
1)это метод медицинского имиджинга, позволяющий получать изображения приповерхностных
тканей организма человека in vivo с высоким пространственным разрешением
2)это метод получения и обработки оптического
сигнала для получения трехмерных изображений внутренней структуры образца за счет рассеяния света в объеме материала. Слайд 46Биологические ткани являются прекрасным объектом для оптической томографии в диапазоне
длин волн так называемого терапевтического окна прозрачности (0,75—1,3 мкм), где
они сильно рассеивают и относительно слабо поглощают излучение.При этом удается получать изображения живых тканей на глубину 1,5—2 мм.
Разрешающая способность ОКТ сравнима с нижней границей размеров клеточных элементов тканей
После создания в начале 90х фемтосекундных лазеров появляются методы с разрешением порядка размеров отдельных клеток.
Слайд 47Что изучает ОКТ?
кожа
слизистые оболочки
шейки матки
пищевода
мочевого пузыря
желудка
тонкого и толстого кишечника
Слайд 48Все эти ткани имеют общие признаки гистологического строения:
поверхностный плоский, переходный
или цилиндрический эпителий,
базальную мембрану,
подлежащую соединительную ткань.
Физический принцип
действия ОКТ аналогичен ультразвуковому исследованию с той лишь разницей, что в ОКТ для зондирования биоткани используется оптическое излучение ближнего инфракрасного диапазона (~1 мкм), а не акустические волны. Поэтому терминологически данный метод следует отнести не к томографии, а к эхозондированию, так как при построении ОКТ-изображения не решается томографическая обратная задача.Слайд 49Основными преимуществами ОКТ являются:
изображение в реальном времени
почти микроскопическое
разрешение
мгновенная, направленная визуализация
не требует подготовки образца или объекта
нет ионизирующего
излученияСлайд 53Показания к применению ОКТ
детекция патологических изменений, включая раннее обнаружение
неоплазии
оптимизация прицельной биопсии;
дифференциальная диагностика сходных по внешним проявлениям заболеваний различной
природы; уточнение локализации и распространенности патологических изменений, включая интраоперационное планирование в реальном времени и контроль органосохраняющих и реконструктивных операций;
оценка динамики патологических изменений, включая контроль проводимого лечения на всех этапах.
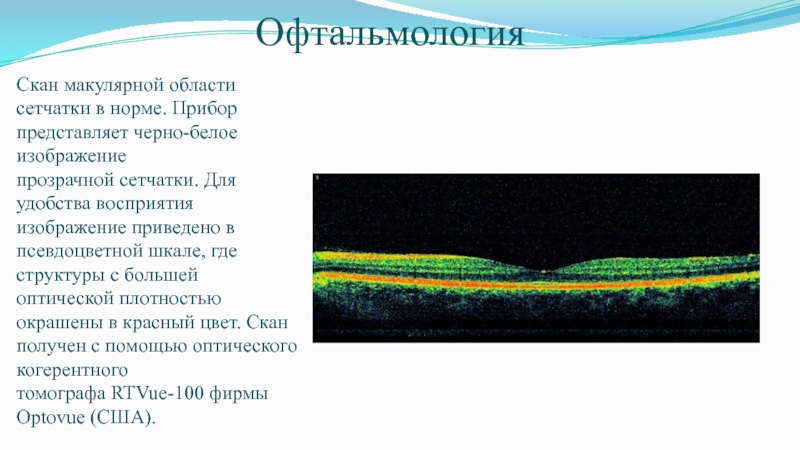
Слайд 54Офтальмология
Скан макулярной области сетчатки в норме. Прибор представляет черно-белое изображение прозрачной сетчатки. Для
удобства восприятия изображение приведено в псевдоцветной шкале, где структуры с
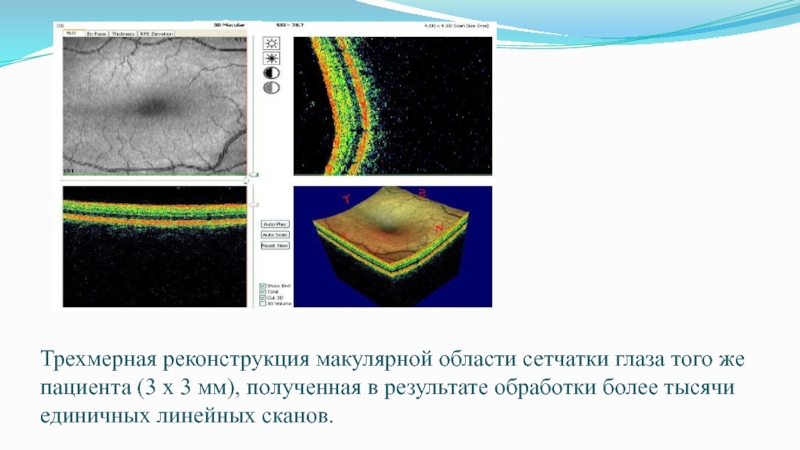
большей оптической плотностью окрашены в красный цвет. Скан получен с помощью оптического когерентного томографа RTVue-100 фирмы Optovue (США).Слайд 55Трехмерная реконструкция макулярной области сетчатки глаза того же пациента (3 х 3
мм), полученная в результате обработки более тысячи единичных линейных сканов.
Слайд 56Трехмерная реконструкция области диска зрительного нерва (оптический срез проходит через зрительный нерв).
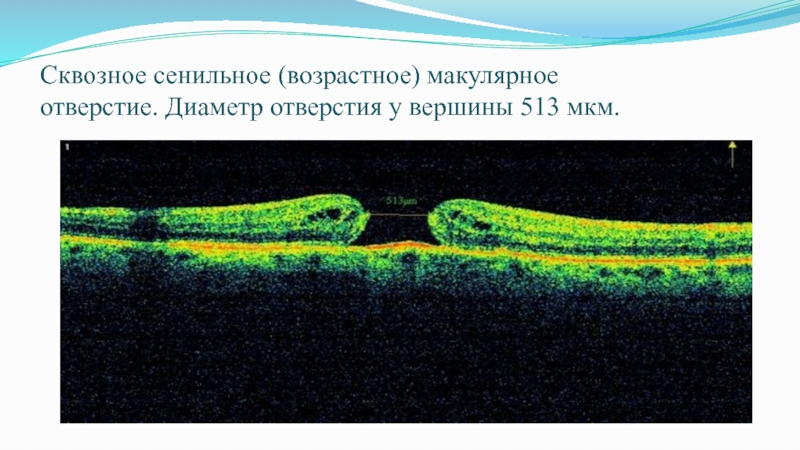
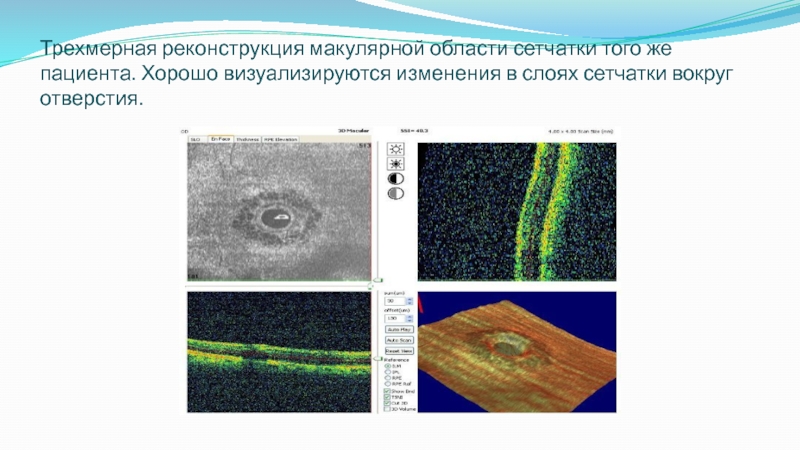
Слайд 58Трехмерная реконструкция макулярной области сетчатки того же пациента. Хорошо визуализируются изменения в
слоях сетчатки вокруг отверстия.
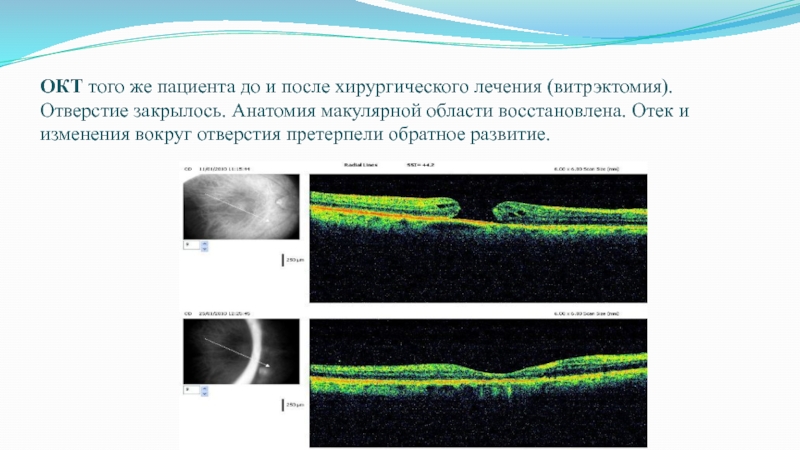
Слайд 59ОКТ того же пациента до и после хирургического лечения (витрэктомия). Отверстие закрылось. Анатомия макулярной
области восстановлена. Отек и изменения вокруг отверстия претерпели обратное развитие.
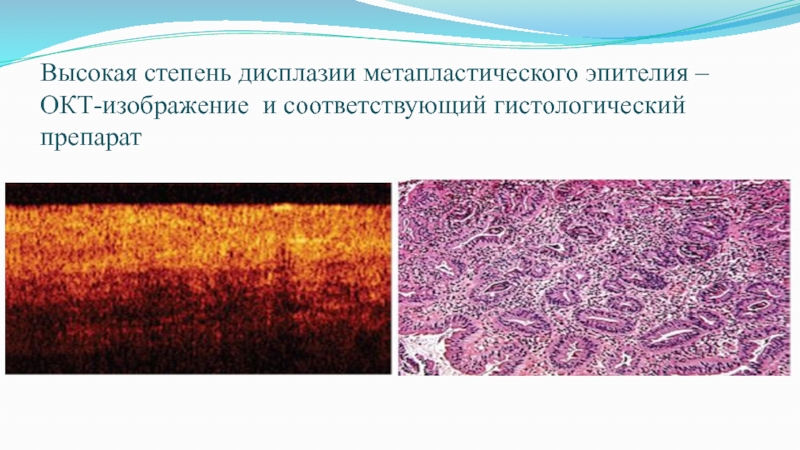
Слайд 61Высокая степень дисплазии метапластического эпителия – ОКТ-изображение и соответствующий гистологический
препарат
Слайд 62Оптогенетика
Метод, объединяющий в себе оптику и генетику
Позволяет детектировать приобретение
или потерю функций специфических клеток, живых тканей.
Позволяет оптически контролировать определенный
тип нейронов, которые могут экспрессировать под специфическим промотором ионные каналы (рецепторы), активируемые светом. Быстрое возбуждение: Channelrhodopsin2
Быстрое ингибирование: Halorhodopsin
Бистабильные модуляции: step opsins
Контроль внутриклеточного сигналинга: OptoXRs
Слайд 63Шаг 1:
Вставить гены опсинов в желаемые клетки
1: Controlling the Brain
with Light by Karl Deisseroth, Scientific American, November, 2010, pages
49-551
Ген опсина комбинируется с промотором, которые приводит к активации гена только в клетке специфического типа
Модифицированный ген вставляется в вирус, который может быть введен в мозг мыши
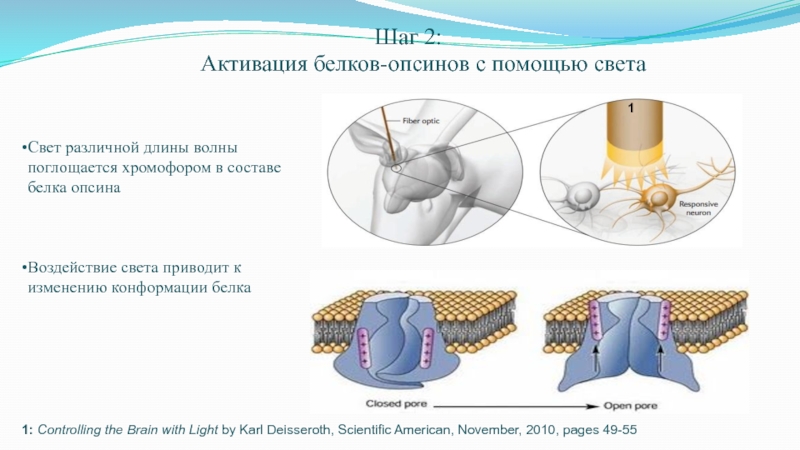
Слайд 64Шаг 2:
Активация белков-опсинов с помощью света
1: Controlling the Brain
with Light by Karl Deisseroth, Scientific American, November, 2010, pages
49-551
Свет различной длины волны поглощается хромофором в составе белка опсина
Воздействие света приводит к изменению конформации белка
Слайд 65Преимущества
Направленный контроль активности одного типа клеток при неизменном состоянии других
(генетически ориентированные на специфические группы нейронов)
Селективная активация нейрональных путей
(в отличие от электрической стимуляции, которая активирует многие нейронные пути)Быстрое временное разрешение: миллисекундная точность сравнима с известной динамикой нейронных событий, таких как потенциалы действия синаптических токов
Можно работать в интактных системах, включая свободно движущихся животных
Слайд 66 Быстрое возбуждение: Каналородопсин Channelrhodopsin2
Свет-активируемый ионный канал
изолированный из зеленой водоросли Chlamydomonas reinhardtii
Неспецифический катионный канал, проводящий ионы
H+, Na+, K+, и Ca2+Синий свет открывает ChR2 (поглощает при 480 nm)
Деполяризует нейроны
Слайд 67Халородопсин (Halorhodopsin)
Халоропсин (Halorhodopsin) использует оранжевый свет для перемещения хлорид- ионов
в клетку, преодолевая мембранный потенциал
Желтый свет открывает проводимость хлорид-
ионов в гиперполяризованную клеткуХалоропсин может быть использован один для нейронов в покое или в сочетании с Сhannelrhodopsin2 для активации, молчания или десинхронизации нервной ткани
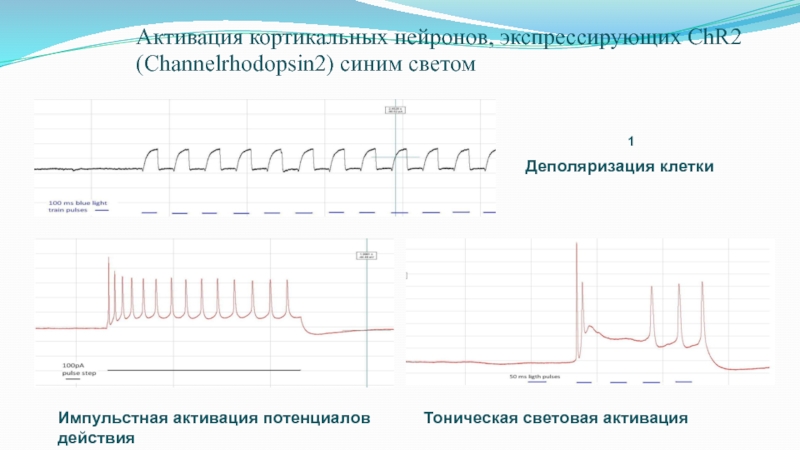
Слайд 68Активация кортикальных нейронов, экспрессирующих ChR2 (Channelrhodopsin2) синим светом
1
Деполяризация
клетки
Импульстная активация потенциалов действия
Тоническая световая активация
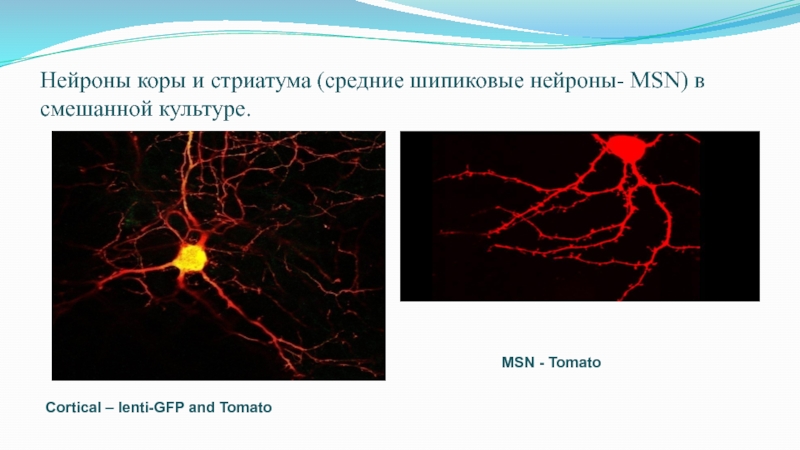
Слайд 69Нейроны коры и стриатума (средние шипиковые нейроны- MSN) в смешанной
культуре.
Cortical – lenti-GFP and Tomato
MSN - Tomato
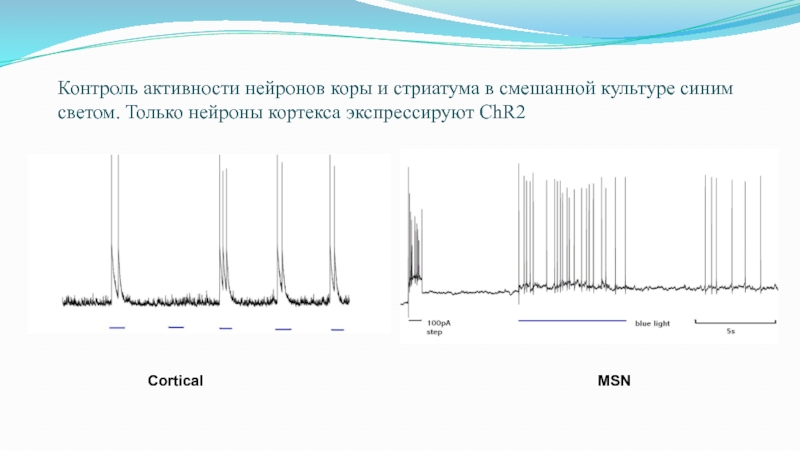
Слайд 70Контроль активности нейронов коры и стриатума в смешанной культуре синим
светом. Только нейроны кортекса экспрессируют ChR2
Cortical
MSN
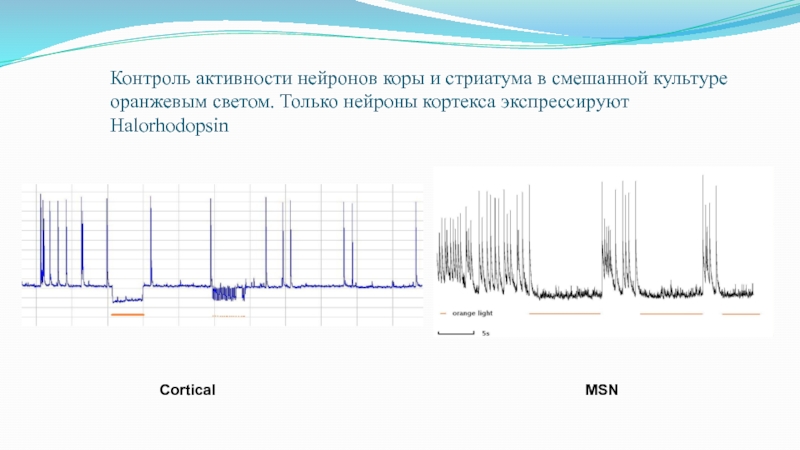
Слайд 71Контроль активности нейронов коры и стриатума в смешанной культуре оранжевым
светом. Только нейроны кортекса экспрессируют Halorhodopsin
Cortical
MSN
Слайд 73Испытательная установка (на клеточных культурах нейронов)
Общий вид экспериментального
комплекса
Исследовательские возможности
ЛМН
Слайд 74Будущее оптогенетики
Данная разработка позволит увеличить точность позиционирования биоэлектрического датчика и
качество съема и обработки экспериментальных данных за счет сопряжения группы
оптико-электродных устройств в единую тест-систему.Комбинированный оптико-электродный массив (узел тест-системы)
Слайд 75Разработки в мире
1.
2.
Гибкий массив электродов, моделируемый по форме экспериментального образца
(Columbia University, USA)
Электродный массив с световодом оптогенетической активации импульса
возбуждения (University of Utah, USA)Нейро-мышечный имплантат стимуляции тканей головного мозга (США)
3.