Слайд 2ХАРАКТЕРИСТИКА ПРИРОДНЫХ ВОД
И ИХ ПРИМЕСЕЙ
Вода является одним из самых
распространенных соединений на Земле. Общая масса воды на поверхности Земли
оценивается в 1,39 . 1018 т. Большая часть ее содержится в морях и океанах. Стационарные запасы пресных вод, пригодных для использования, составляют всего 0,3% объема гидросферы.
Химическая промышленность является крупнейшим потребителем воды. Современные химические предприятия расходуют до 1 млн. м3 воды в сутки. Расходные коэффициенты по воде в (м³/т) в производстве:
азотной кислоты – до 200,
аммиака – 1500,
вискозного шелка – 2500 и т.д..
Слайд 3Годовой сток:
Волги - 250 км3/год;
Амура - 350 км3/год;
Оби - 396
км3/год;
Лены - 508 км3/год;
Енисея - 623 км3/год.
Солесодержание в
различных морях:
Балтийское - 11 г/л;
Каспийское - 12-13 г/л;
Черное - 19 г/л;
Северное - 33 г/л;
Атлантический океан - 35,9 г/л;
Средиземное море - 37,3 г/л;
Мертвое море - 240 г/л;
Слайд 4Используемая в производстве техническая вода делится на охлаждающую, технологическую и
энергетическую.
Приблизительно 75% воды, используемой в химической промышленности,
расходуется на охлаждение или нагрев технологической аппаратуры.
Слайд 5Классификация примесей воды
по химическому составу: на органические (гуминовые кислоты, лигнин,
бактерии и др.) и неорганические (минеральные соли, газы N, O,
CO2, H2S, CH4, NH3 и др.).
по дисперсности. Различают четыре группы.
К первой группе относятся нерастворимые вещества от тонких взвесей до крупных частиц, размером до 10-5÷10-4 см (песок, глина, некоторые бактерии).
К второй группе относятся коллоидные системы,
высокомолекулярные вещ-ва с величиной частиц 10-5÷10-6 см.
К третьей группе относятся молекулярные растворы в воде газов и органических веществ с величиной частиц 10-6÷10-7 см. Эти вещества находятся в воде в виде недиссоциированных молекул.
К четвертой группе относятся истинно растворенные вещества, диссоциирующие в воде на ионы и имеющие величину частиц менее 10-7 см.
Слайд 6По происхождению различают:
Атмосферные воды – воды дождевых и снеговых осадков
– характеризуются сравнительно небольшим содержанием примесей.
Поверхностные воды – это
воды открытых водоемов: рек, озер, морей, каналов, водохранилищ.
Морская вода отличается высоким солесодержанием и содержит практически все элементы, имеющиеся в земной коре. Больше всего в морской воде содержится хлорида натрия (до 2, 6 % от всех солей).
Подземные воды – воды артезианских скважин, колодцев, ключей, гейзеров.
Слайд 7В зависимости от солесодержания природные воды подразделяют на:
пресную воду –
солесодержание до 1 г солей/л;
пресные воды подразделяются на:
воды малой минерализованности (до 0,2 г/л),
средней минерализованности (0,2 – 0,5 г/л)
повышенной минерализованности (0,5 – 1 г/л).
солоноватую – 1 ÷ 10 г солей/л воды;
соленую – 10 - 50 г/л.
рассолы (более 50 г/л).
Слайд 8ОСНОВНЫЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ
Прозрачность.
Цвет.
Содержание взвешенных веществ.
Сухой остаток.
Окисляемость.
Активная реакция.
Щелочность.
Жесткость.
Солесодержание.
Содержание
тяжелых металлов.
Бактериологические показатели.
Запах.
Вкус и т.д.
Слайд 9 ОСНОВНЫЕ МЕТОДЫ ВОДОПОДГОТОВКИ
ОСВЕТЛЕНИЕ ВОДЫ
Осветление воды – это ряд операций
(отстаивание, фильтрация, коагуляция), выполняемых для удаления из воды механических примесей.
Используемые
аппараты:
Песколовки
Отстойники:
горизонтальные; вертикальные и радиальные.
Фильтры
Слайд 10Песколовка
Песколовка разработана для отделения твердых, легко осаждающихся веществ.
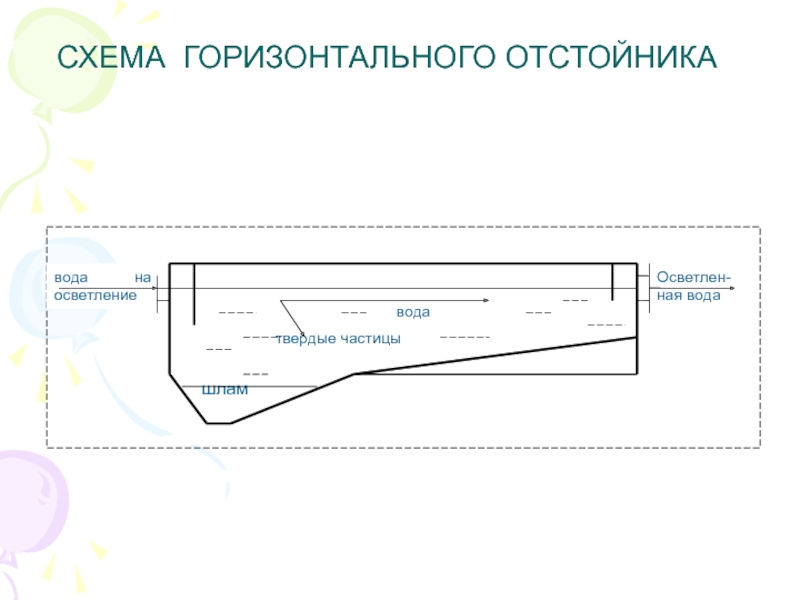
Слайд 11СХЕМА ГОРИЗОНТАЛЬНОГО ОТСТОЙНИКА
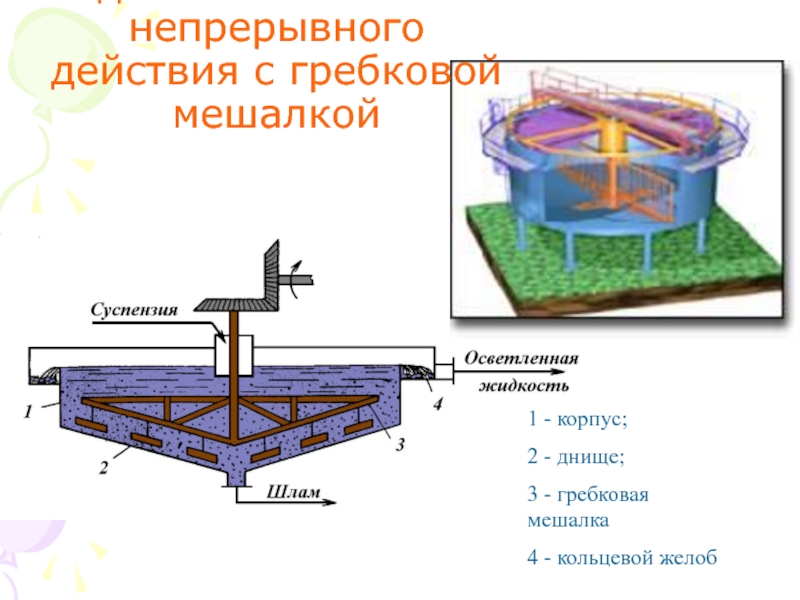
Слайд 12Радиальный отстойник непрерывного действия с гребковой мешалкой
1 - корпус;
2 -
днище;
3 - гребковая мешалка
4 - кольцевой желоб
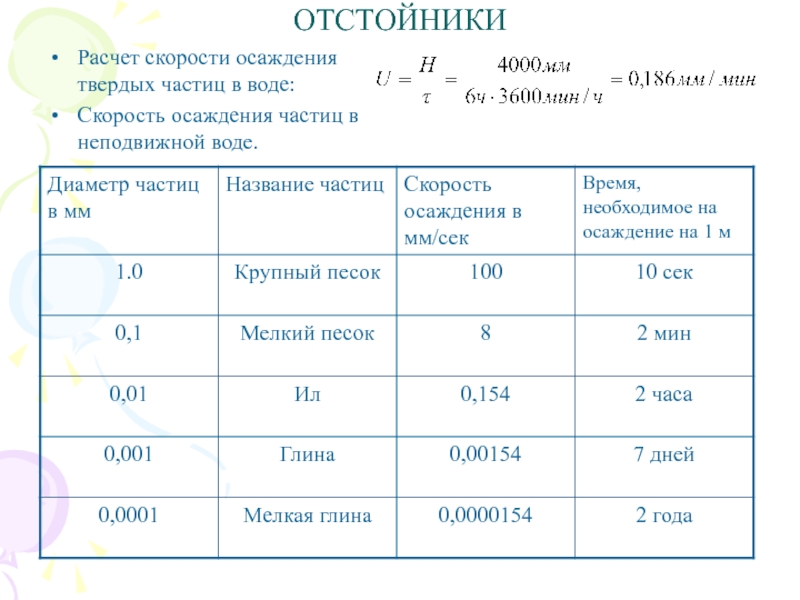
Слайд 13ОТСТОЙНИКИ
Расчет скорости осаждения твердых частиц в воде:
Скорость осаждения частиц в
неподвижной воде.
Слайд 14КОАГУЛЯЦИОННАЯ ОЧИСТКА ВОДЫ
Коагуляционная и злектрокоагуляционная очистка применяются в тех случаях,
когда примеси, находящиеся в воде не удаляются отстаиванием и фильтрацией
без дополнительной обработки.
Коагуляцией примесей воды называется процесс разрушения и укрупнения мельчайших коллоидных и диспергированных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения.
В качестве коагулянтов используют различные соли алюминия и железа, чаще всего Al2(SO4)3, FeSO4 и FeCl3.
Выбор реагента зависит от концентрации примесей, рН, температуры и солевого состава воды.
Слайд 15КОРРЕКТИРОВКА СОЛЕВОГО СОСТАВА
(умягчение и деминерализация
воды)
Задача умягчения воды-
Частичное или полное удаление солей жесткости из воды.
Задача
деминерализации воды –
уменьшение солесодержания, изменение солевого состава или полное устранение всех солей из воды.
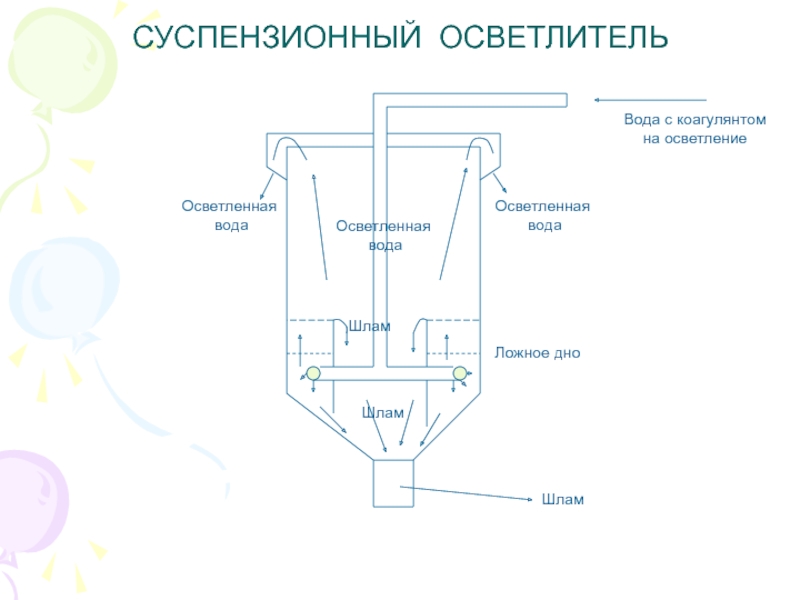
Слайд 16СУСПЕНЗИОННЫЙ ОСВЕТЛИТЕЛЬ
Вода с коагулянтом
на осветление
Осветленная
вода
Осветленная
вода
Ложное дно
Шлам
Шлам
Шлам
Осветленная
вода
Слайд 17УМЯГЧЕНИЕ ВОДЫ
Физические методы:
Кипячение
Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
2Mg(HCO3)2
= MgCO3·Mg(OH)2↓ + 3CO2 + H2O
Химические методы
Магнитная обработка
Ионообменная обработка воды
Слайд 18ХИМИЧЕСКИЕ (РЕАГЕНТНЫЕ) МЕТОДЫ УМЯГЧЕНИЯ ВОДЫ
1. Известкование воды (устраняется только временная
жесткость)
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Mg(HCO3)2+Ca(OH)2 =Mg(OH)2+2CaCO3 +H2O+CO2
FeSO4 +
Ca(OH)2 = Fe(OH)2 + CaSO4
CO2 + Ca(OH)2 = CaCO3+H2O
Обработка кальцинированной содой
Ca(HCO3)2 + Na2CO3 = CaCO3 +2NaHCO3
MgCl2 + Na2CO3 = MgCO3 + 2NaCl
Устраняется общая жесткость
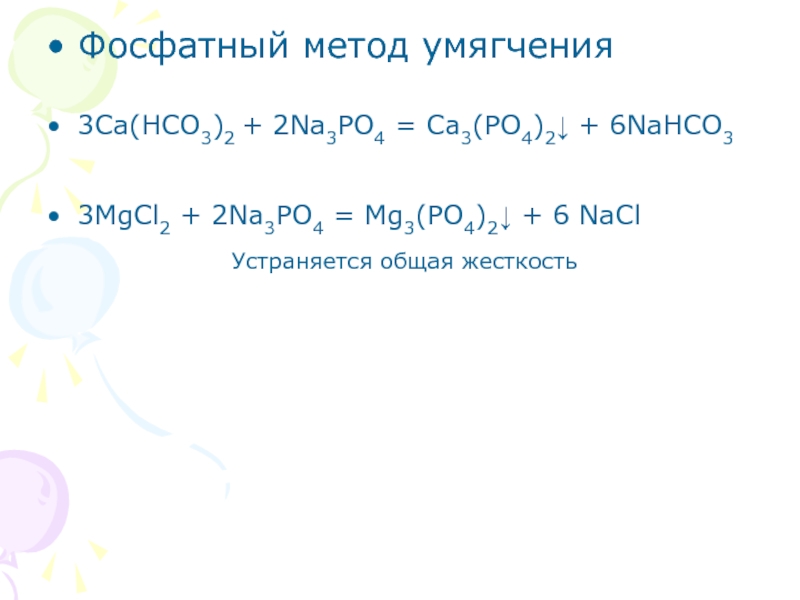
Слайд 19Фосфатный метод умягчения
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2 + 6NaHCO3
3MgCl2 +
2Na3PO4 = Mg3(PO4)2 + 6 NaCl
Устраняется общая жесткость
Слайд 20ДЕМИНЕРАЛИЗАЦИЯ ВОДЫ
Физические методы:
Дистиляция и вымораживание;
Мембранные методы.
Электрохимические методы
Ионообменный метод
Задачи, решаемые ионным
обменом в водоподготовке
1. Умягчение воды
2. Получение умягченной и нейтральной воды
3.
Корректировка солевого состава и
деминерализация воды
Слайд 21В водоподготовке используются катионообменные смолы
RNa, RH, RNH4 и
анионообменные AnOH
РЕАКЦИИ
CaCl2 + 2RNa ⇄ R2Ca + 2NaCl
Ca(HCO3)2+ 2RNa ⇄
R2Ca + 2 NaHCO3 pH > 7
вода слабо щелочная
3. CaCl2 + 2RH ⇄ R2Ca + 2HCl pH < 7 вода кислая
4. Mg(HCO3)2+ 2RH ⇄ R2Mg + H2O + CO2
Для умягчения воды используются катионообменные смолы
RNa и RNH4
Слайд 22ПОЛУЧЕНИЕ УМЯГЧЕННОЙ И НЕЙТРАЛЬНОЙ ВОДЫ
HCl + NaHCO3 = NaCl +
H2O + CO2
Слайд 23ПОЛУЧЕНИЕ ДЕМИНЕРАЛИЗОВАННОЙ ВОДЫ
1.Обработка воды катионообменной смолой RH
CaCl2 + 2RH ⇄
R2Ca + 2HCl pH < 7 вода кислая
Mg(HCO3)2+ 2RH ⇄ R2Mg + H2O + CO2
2. Обработка кислой воды анионообменной смолой AnOH
HCl + AnOH ⇄ AnCl + H2O
Основные характеристики ионообменных смол:
обменная способность и набухаемость.
Слайд 24РЕГЕНЕРАЦИЯ ИОНООБМЕННЫХ СМОЛ
Регенерация катионообменных смол осуществляется
1-1,5%-м раствором соляной или
(осторожно) серной кислотой или раствором NaCl.
R2Ca + 2HCl ⇄ CaCl2
+ 2RН
Регенерация анионообменных смол осуществляется
4%-м раствором NaOH.
ДЕГАЗАЦИЯ ВОДЫ
Физические методы
Кипячение
Применение пленочных (градирни), насадочных, барботажных (пенные аппараты) и вакуумных дегазаторов.
Химические методы
Известкование – удаление СО2
2Na2SO3 + O2 = 2Na2SO4
N2H4 + O2 = 2H2O + N2 , но гидразин – очень опасен!
N2H4·H2SO4 + O2 = 2H2O + H2SO4 + N2
и др.
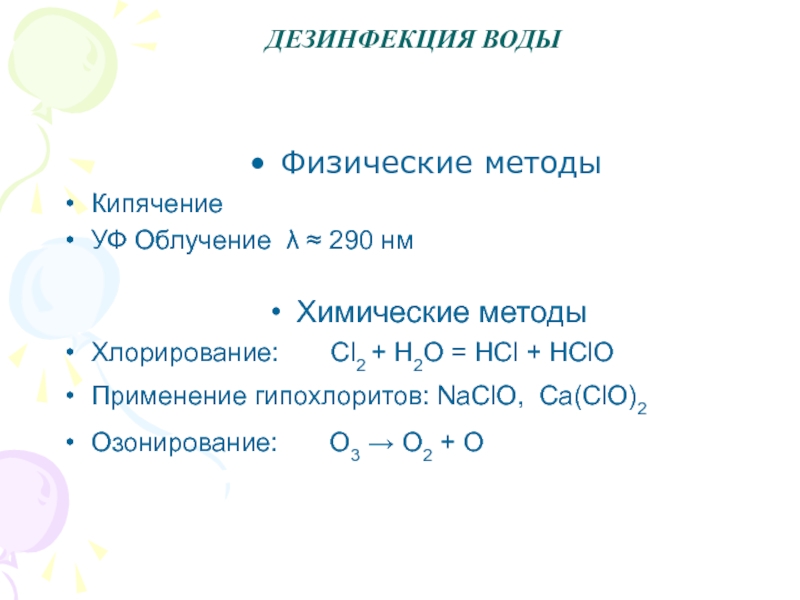
Слайд 28ДЕЗИНФЕКЦИЯ ВОДЫ
Физические методы
Кипячение
УФ Облучение λ 290 нм
Химические методы
Хлорирование:
Cl2 + H2O = HCl + HClO
Применение гипохлоритов:
NaClO, Ca(ClO)2
Озонирование: O3 → O2 + O