Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции разложения и реакции соединения
Содержание
- 1. Реакции разложения и реакции соединения
- 2. Какие бывают вещества по составу?Какие вещества называются простыми?Какие вещества называются сложными?
- 3. Классификация химических реакций:
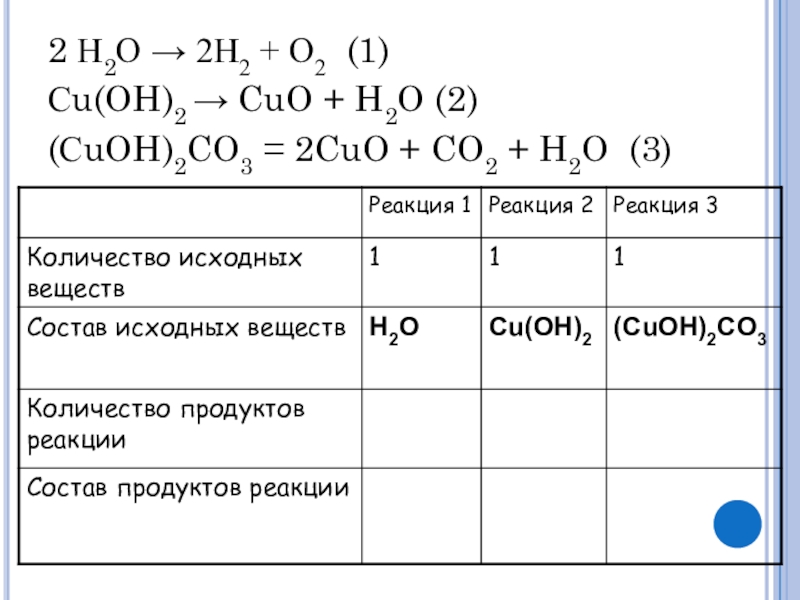
- 4. 2 Н2О → 2Н2 + О2 (1)Сu(OH)2
- 5. 2 Н2О → 2Н2 + О2 (1)Сu(OH)2
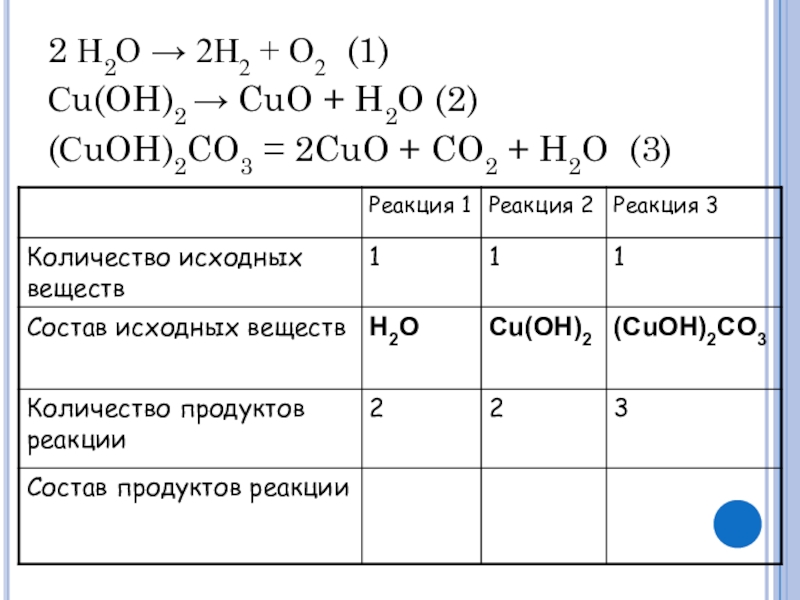
- 6. 2 Н2О → 2Н2 + О2 (1)Сu(OH)2
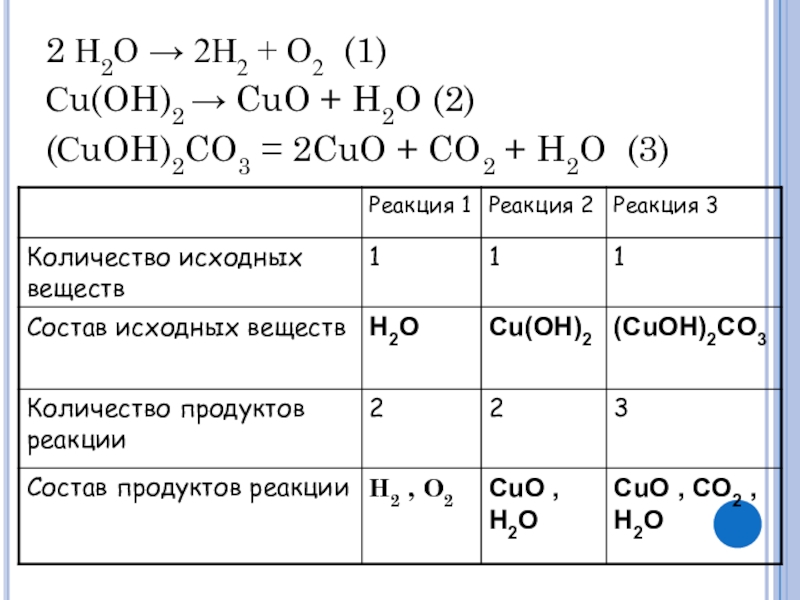
- 7. 2 Н2О → 2Н2 + О2 (1)Сu(OH)2
- 8. 2 Н2О → 2Н2 + О2 (1)Сu(OH)2
- 9. Реакции разложения – Это реакции, в результате
- 10. Реакции соединения – Это реакции, в результате
- 11. Вспомните, как на практической работе мы получали
- 12. Задание по вариантам:Первый вариант выбирает из списка
- 13. В реакции разложения вступают одно простое и
- 14. В реакции разложения вступают одно простое и
- 15. Домашнее задание:§ 29, 30, № 1 (а,
- 16. Скачать презентанцию
Какие бывают вещества по составу?Какие вещества называются простыми?Какие вещества называются сложными?
Слайды и текст этой презентации
Слайд 2Какие бывают вещества по составу?
Какие вещества называются простыми?
Какие вещества называются
сложными?
Слайд 9Реакции разложения –
Это реакции, в результате которых из одного
сложного вещества образуется два и более новых веществ.
А =
В + С +…Слайд 10Реакции соединения –
Это реакции, в результате которых из одного
или нескольких исходных веществ образуется одно сложное вещество.
А + В
+ … = ССлайд 11Вспомните, как на практической работе мы получали сульфат меди?
Что вы
при этом наблюдали?
Цепочка превращений:
Р → Р2О5 → Н3РО4
Р + … → Р2О5О2
4
5
2
Р2О5 + Н2О → Н3РО4
2
3
Слайд 12Задание по вариантам:
Первый вариант выбирает из списка реакции соединения, второй
– разложения. Также требуется расставить коэффициенты.
Fе(ОН)3 → Fе2O3 + Н2O,
Fе(ОН)3 + HCl →
FеСl3 + Н2О,Li + O2 → Li2O,
Li2O + H2O → LiOH,
CuSO4 + Fe → FeSO4 + Cu,
HNO3 → H2O + NO2 + O2.
Слайд 13В реакции разложения вступают одно простое и одно сложное вещества.
В
реакции разложения вступают только сложные вещества.
Необходимым условием реакции разложения является
нагревание.Реакции разложения – это экзотермические реакции.
В результате реакций разложения образуются только простые вещества.
В результате реакций разложения образуются два или более простых или сложных веществ.
Реакция NaOH + HCl = NaCl + H2O является реакцией разложения.
Реакция 2 NaCl = 2 Na + Cl2 является реакцией разложения.
Слайд 14В реакции разложения вступают одно простое и одно сложное вещества.
В
реакции разложения вступают только сложные вещества.
Необходимым условием реакции разложения является
нагревание.Реакции разложения – это экзотермические реакции.
В результате реакций разложения образуются только простые вещества.
В результате реакций разложения образуются два или более простых или сложных веществ.
Реакция NaOH + HCl = NaCl + H2O является реакцией разложения.
Реакция 2 NaCl = 2 Na + Cl2 является реакцией разложения.