Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регулирование свойств тампонажных материалов для цементирования скважин в
Содержание
- 1. Регулирование свойств тампонажных материалов для цементирования скважин в
- 2. Литература Агзамов Ф.А., Измухамбетов Б.С.,Токунова Э.Ф. Химия
- 3. Лекция 1Требования к тампонажным материалам. Портландцемент.
- 4. ПортландцементПортландцемент = (Клинкер + Добавка + Гипс)
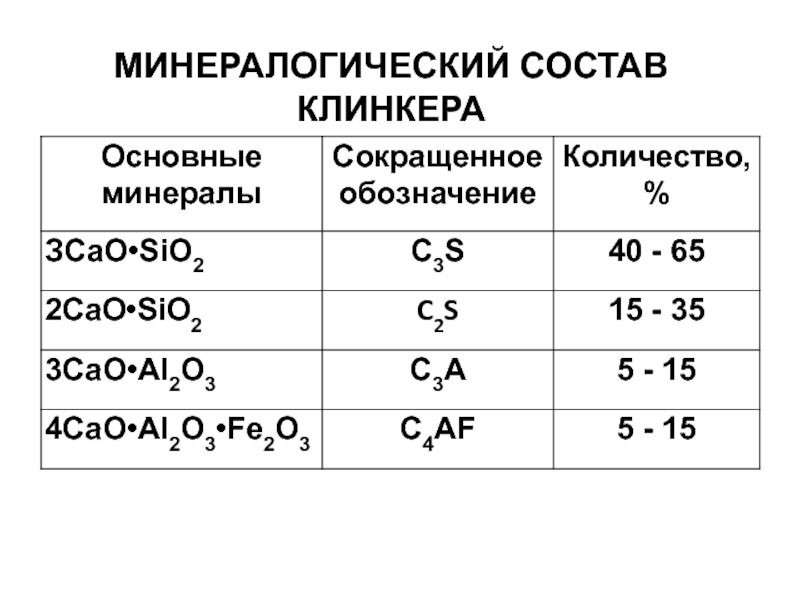
- 5. Минералогический состав клинкера
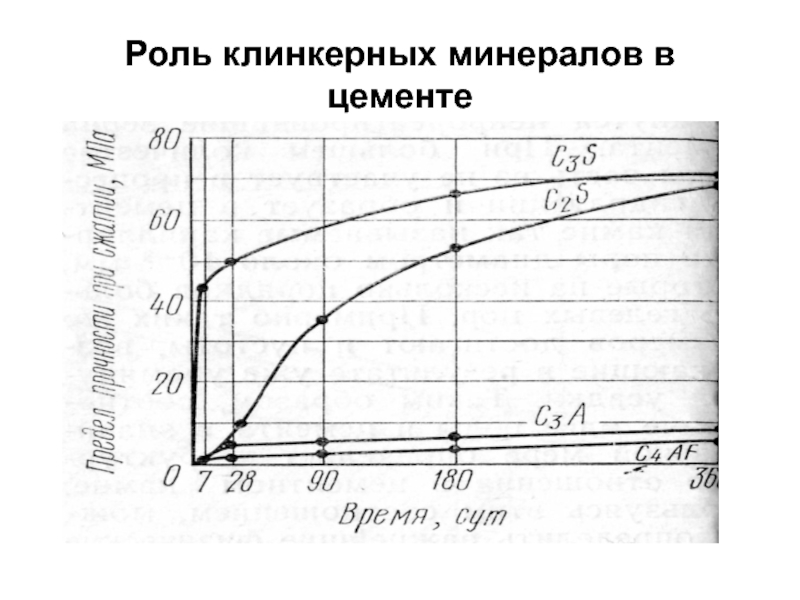
- 6. Роль клинкерных минералов в цементе
- 7. Гидратация и твердение цементов
- 8. Реакции гидратации для минералов цемента2(ЗСаО•SiO2) + 6Н2О
- 9. Схема гидратации цемента
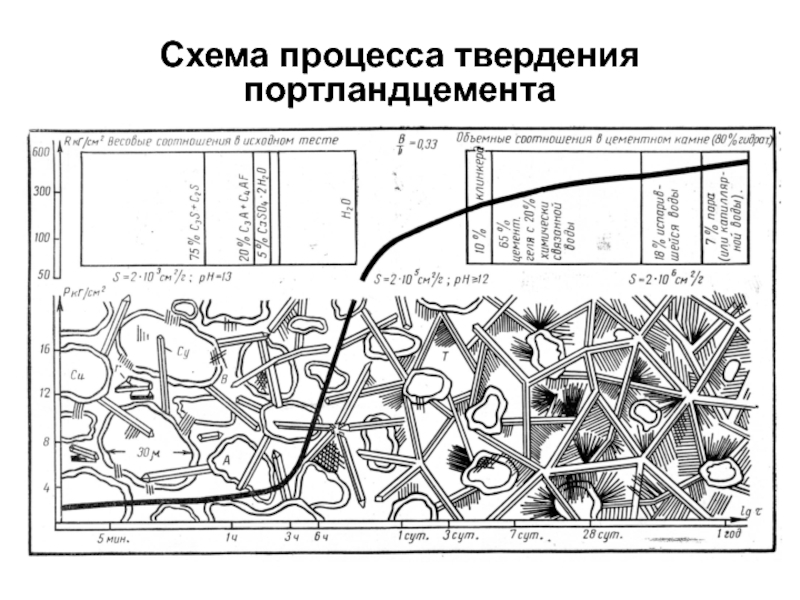
- 10. Схема процесса твердения портландцемента
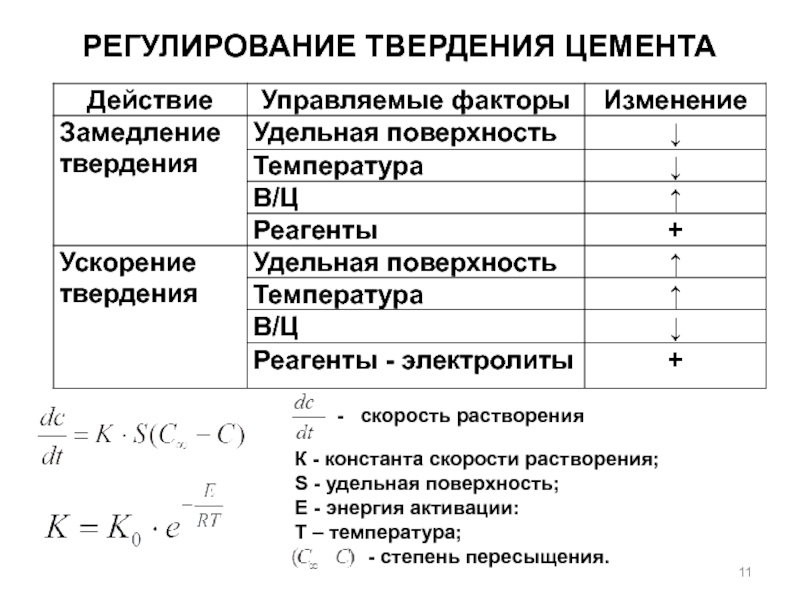
- 11. Регулирование твердения цемента- скорость растворенияК -
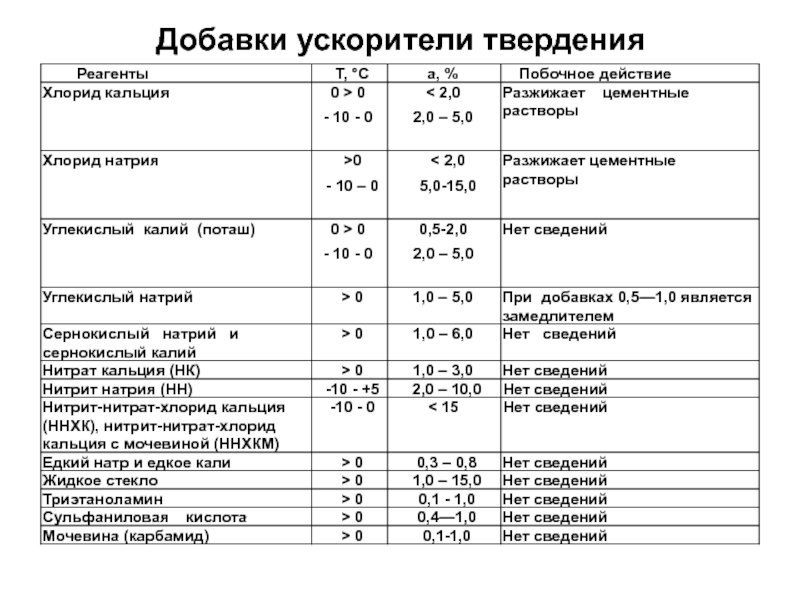
- 12. Добавки ускорители твердения
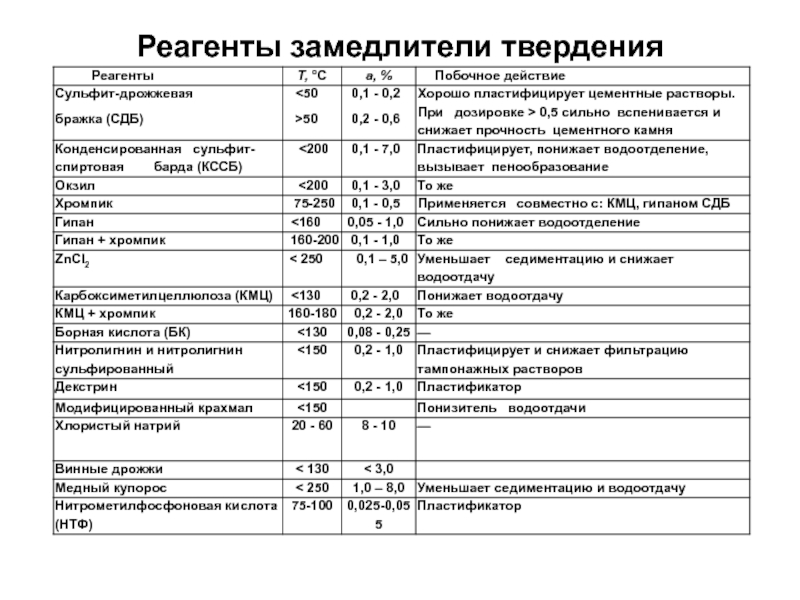
- 13. Реагенты замедлители твердения
- 14. Лекция 2Свойства цемента, цементного раствора, приборы для
- 15. Свойства цементаГранулометрический состав;Удельная поверхность;Плотность; Насыпная плотность.
- 16. Свойства цементного раствора Водоцементное отношение (В/Ц)РастекаемостьПрокачиваемостьСроки схватыванияРеологические свойстваПлотностьВодоотдачаВодоотделение
- 17. Контроль свойств цементного раствора Конус АзНИИ для
- 18. Вискозиметр для определения реологических свойств тампонажных растворов
- 19. Регулирование плотности тампонажных растворовРычажные весы для определения плотности
- 20. Плотность модифицирующих добавок
- 21. Снижение водоотдачи тампонажных растворов
- 22. Лекция 3Свойства цементного камня и методы управления ими.Стандарт на тампонажные цементы
- 23. Свойства цементного камняПористостьПредел прочностиПроницаемостьОбъемные измененияУдароустойчивостьКоррозионная стойкость.
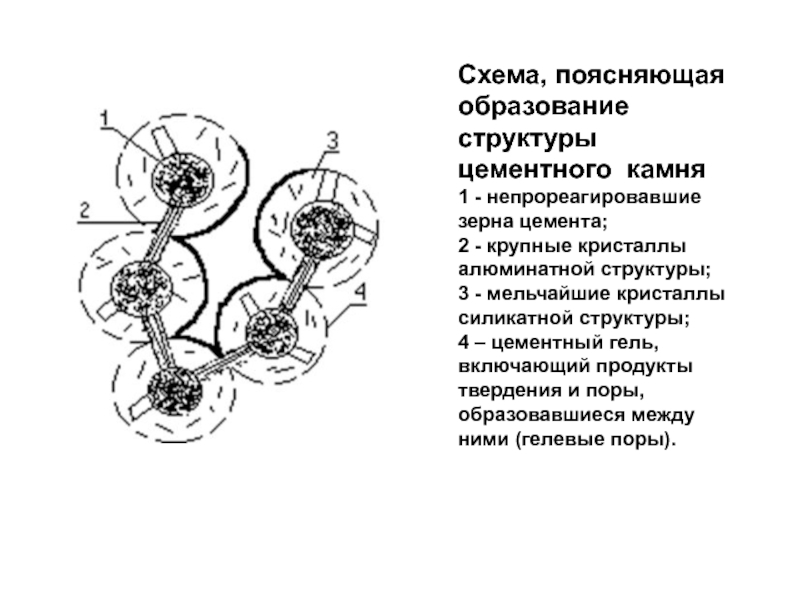
- 24. Схема, поясняющая образование структуры цементного камня 1
- 25. Гидратация цемента в цементный камень на примере
- 26. Структура цементного камня
- 27. Пресс для определения предела прочности цементного камняФормы
- 28. Требования к кинетике расширения цементовосновная часть расширения
- 29. Схема действия нагрузок при перфорации
- 30. Повышение ударостойкости цементного камня: 1) Снижение водоцементного
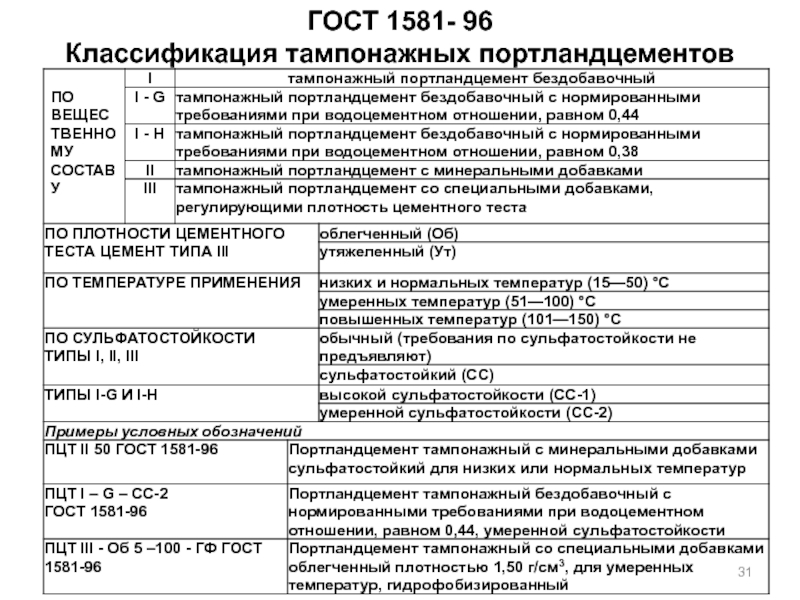
- 31. ГОСТ 1581- 96 Классификация тампонажных портландцементов
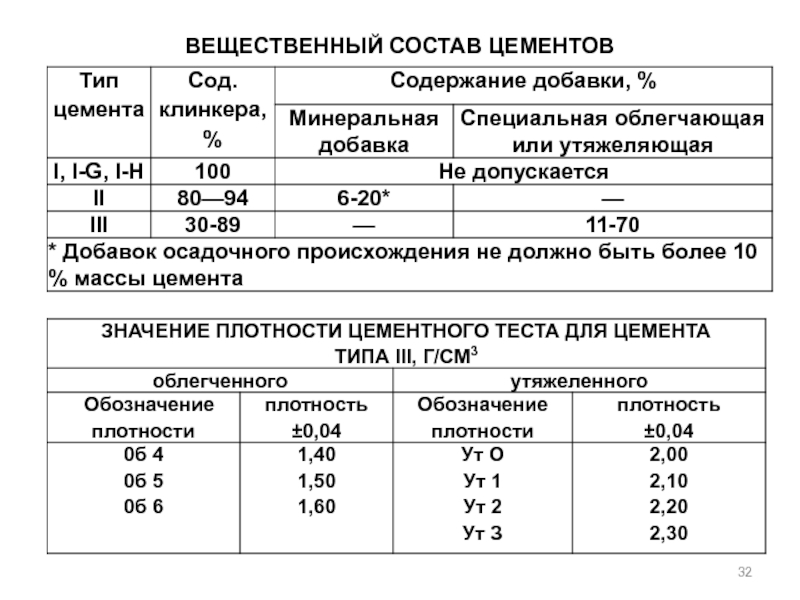
- 32. Вещественный состав цементов
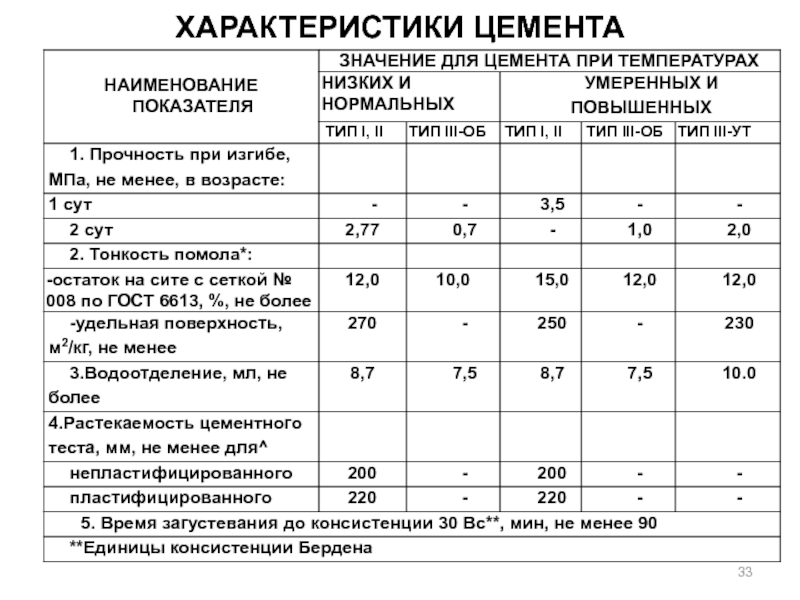
- 33. Характеристики цемента
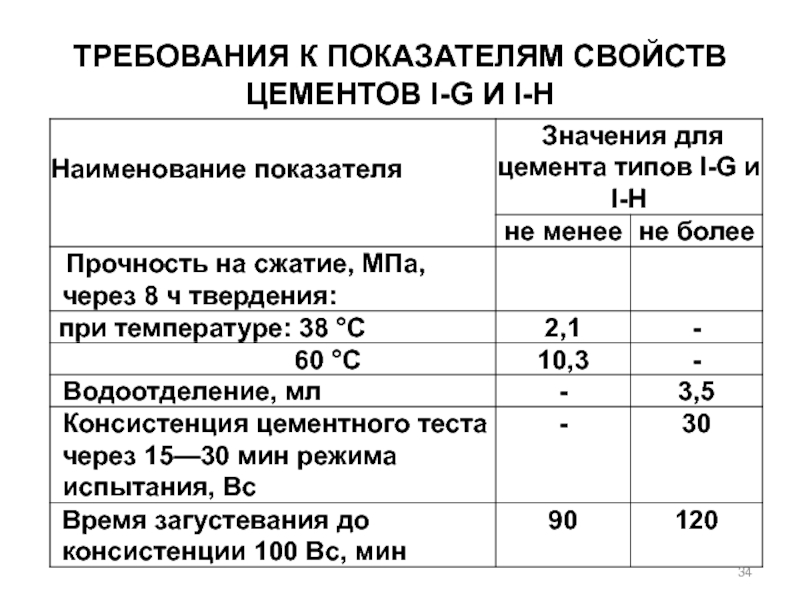
- 34. Требования к показателям свойств цементов I-G и I-H
- 35. Лекция 4Управление долговечностью тампонажных материалов.
- 36. Состав пластовых флюидов
- 37. Коррозия цементного камня. Определения Химические и физико-химические
- 38. Классификация видов коррозии цементного камня1. Физическая коррозия:Разрушение
- 39. Физическая коррозия цементного камняРазрушение цементного камня при
- 40. Механизм При действии отрицательных температур вода, находящаяся
- 41. Факторы, определяющие процессНа долговечность камня при действии
- 42. Коррозия выщелачивания, примеры
- 43. Механизм Фазовый состав затвердевшего цементного камня представлен
- 44. Факторы, определяющие процессСостав цемента;Пористость;Характер воздействия воды;Химический состав вод; Наличие негидратированного цемента
- 45. Кинетика процесса1. Растворение и гидролиз продуктов твердения2. Диффузный продуктов гидролиза в окружающую среду
- 46. Снижение прочности цементного камня при выщелачивании извести
- 47. Кислотная коррозия цементного камня Химия процессаПри контакте
- 48.
- 49. Кислотная коррозия цементного камня (пример)
- 50. Факторы, определяющие процессСостав цемента;Пористость;Реакционная емкость;Добавки ингибиторы коррозии;Концентрация кислоты на границе с цементным камнем
- 51. Кинетика процесса
- 52. Сульфатная коррозия цементного камняХимия;Механизм; Управление; Принципы получения сульфатостойких цементов;Проблемы;
- 53. Сульфатная коррозия цементного камня (химия)Na2SO4 + Ca(OH)2
- 54. Чаще всего сульфатная коррозия связывается с образованием
- 55. К механизму сульфатной коррозииУсловное соотношение объемов до
- 56. Необходимыми условия для протекания сульфатной коррозии
- 57. Анализ условийОграничение скорости поступления ионов SО42- внутрь
- 58. Анализ условий2. Снижение содержания алюминий содержащих фаз
- 59. Анализ условий3. Снижение pH цементного камня. Ввод
- 60. Магнезиальная коррозия цементного камняХимия процесса :MgSO4 +
- 61. Возможный механизм коррозии1. Кислотный, поскольку одним продуктом
- 62. Возможный механизм коррозии2. Осмотический. Выпадающий в осадок
- 63. Сероводородная коррозия цементного камняСероводород (H2S) является коррозионноактивным
- 64. Слайд 64
- 65. Растворяясь в воде, сероводород образует слабую сероводородную
- 66. Зависимость растворимости сероводорода от температуры (при атмосферном давлении)- - - - - - в воде;_______в нефти
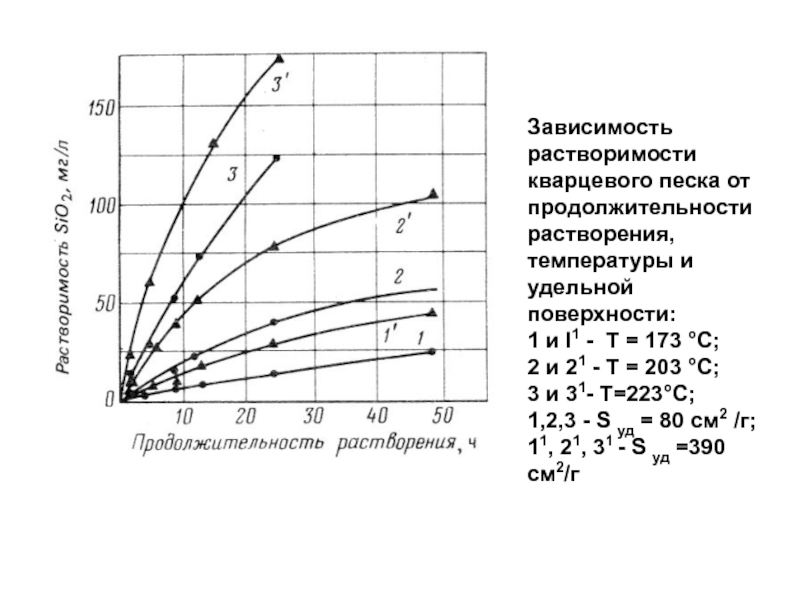
- 67. Результаты расчетов реакций коррозии продуктов твердения цемента с сероводородом в присутствии метана
- 68. Слайд 68
- 69. Наиболее уязвимы к сероводороду высокоосновные гидросиликаты кальция,
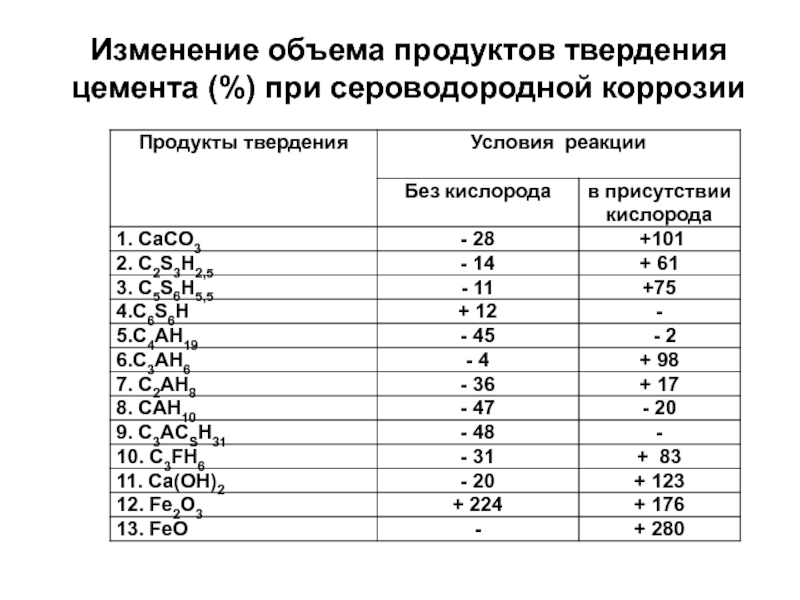
- 70. Изменение объема продуктов твердения цемента (%) при сероводородной коррозии
- 71. Коррозия цементного камня под действием газообразного сероводородаВ
- 72. Коррозия камня из мономинералов в сероводородеС3SС3SC3AC4AF
- 73. Влияние углеводородов на процесс коррозии H2SH2S + конденсат
- 74. Примеры поражения цементного камня сероводородомАстраханьОренбург
- 75. Микрофотографии образцов цементного камня до и после серовододной коррзии
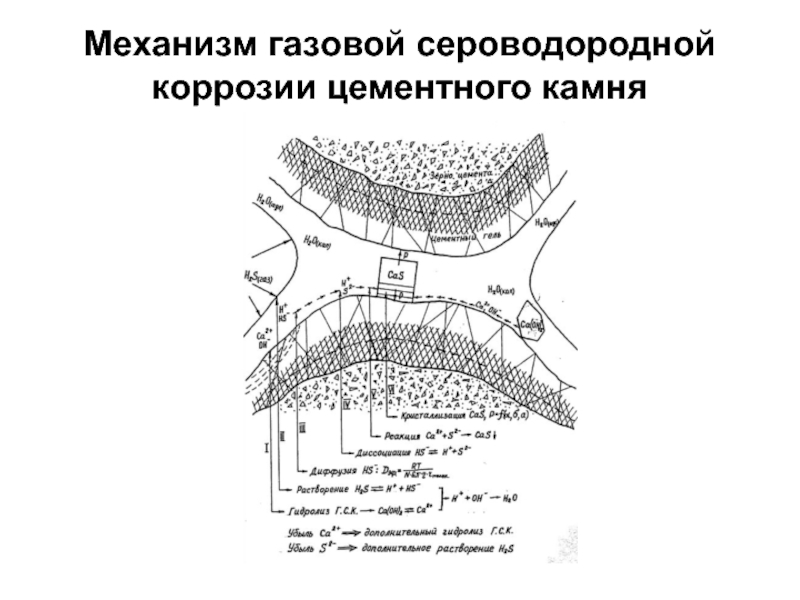
- 76. Механизм газовой сероводородной коррозии цементного камня
- 77. Даже небольшое количество продуктов коррозии, накопленное в
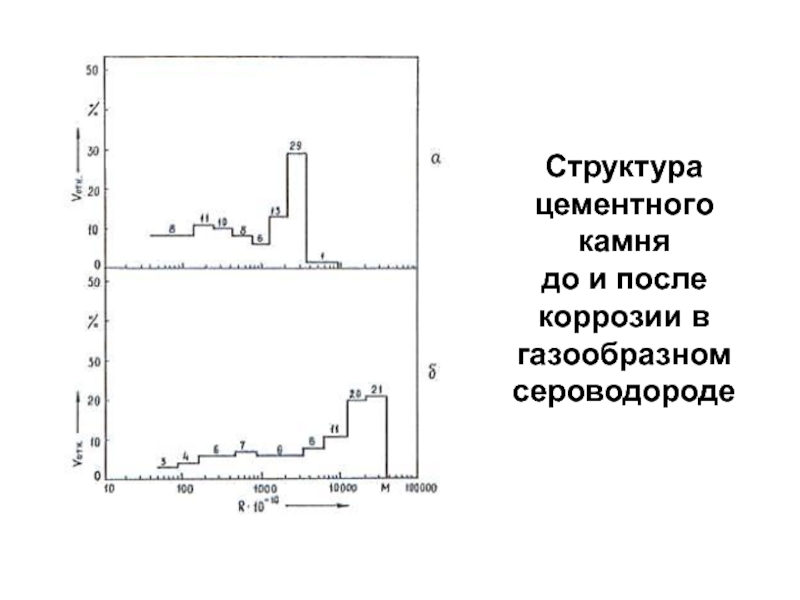
- 78. Структура цементного камня до и после коррозии в газообразном сероводороде
- 79. Тампонажные материалы, стойкие к газообразному сероводородуШлаковые цементы;Песчанистые цементы;Белитокремнеземистые цементы;Глиноземистый цемент;Сульфоалюминатный цемент.
- 80. Коррозия цементного камня под действием растворенного сероводородаВ
- 81. Схема коррозии цементного камня в скважине
- 82. Слайд 82
- 83. С точки зрения долговечности крепи более предпочтительным
- 84. Влияние свойств цементного камня и породы на
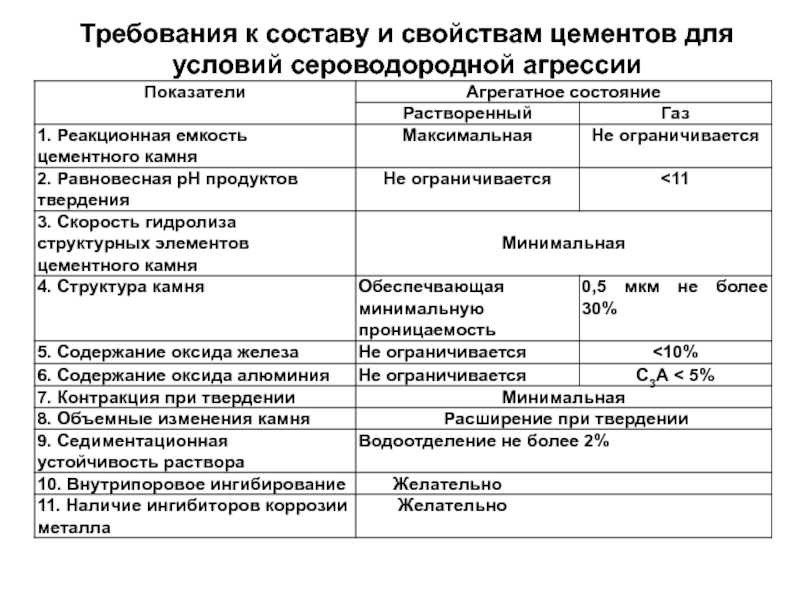
- 85. Требования к составу и свойствам цементов для условий сероводородной агрессии
- 86. Кинетика коррозии камня из цементно-известково-зольного вяжущего в растворенном сероводороде
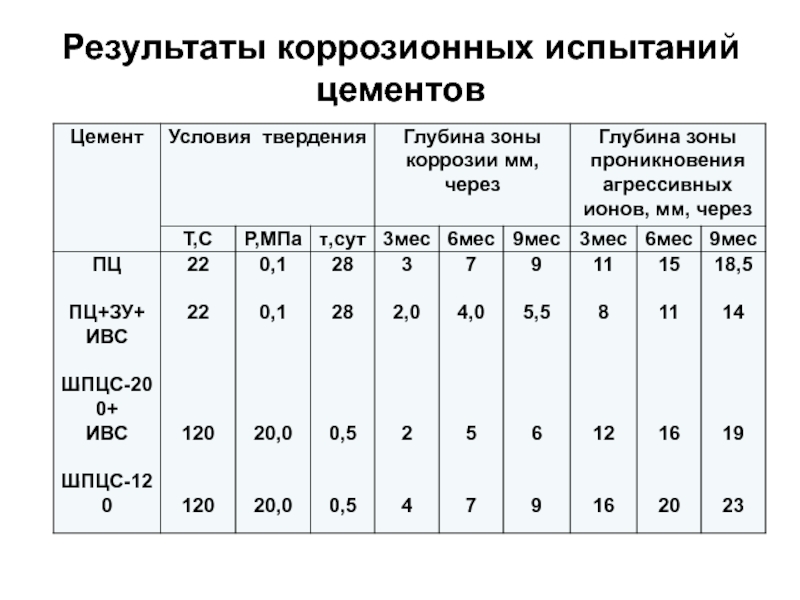
- 87. Результаты коррозионных испытаний цементов
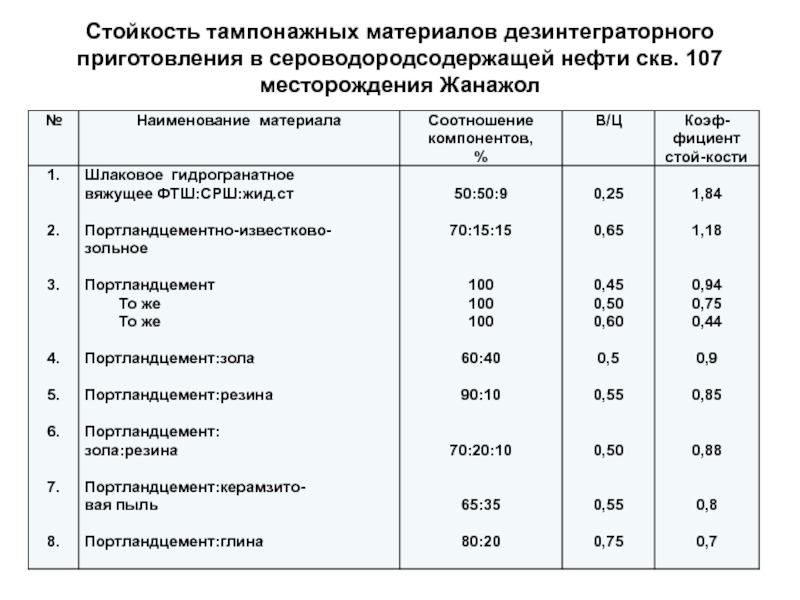
- 88. Стойкость тампонажных материалов дезинтеграторного приготовления в сероводородсодержащей нефти скв. 107 месторождения Жанажол
- 89. Пути повышения долговечности крепи скважин в агрессивных
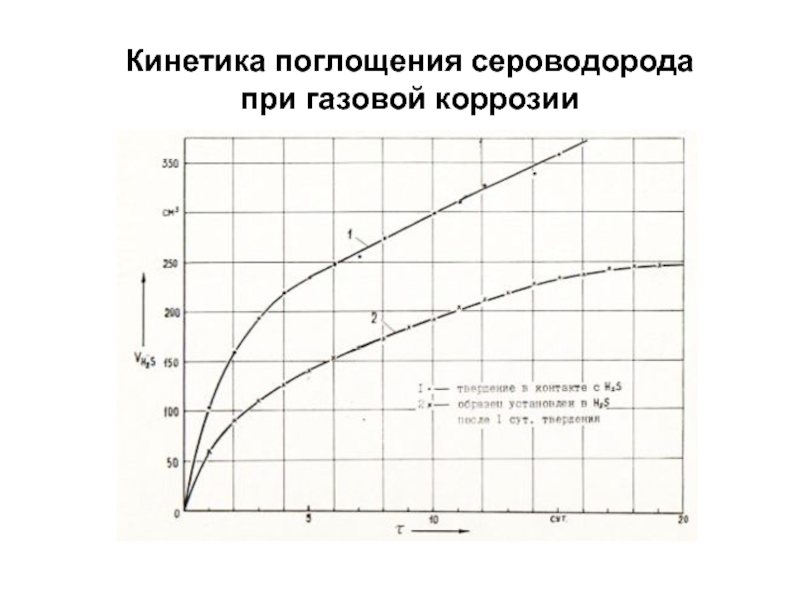
- 90. Кинетика поглощения сероводорода при газовой коррозии
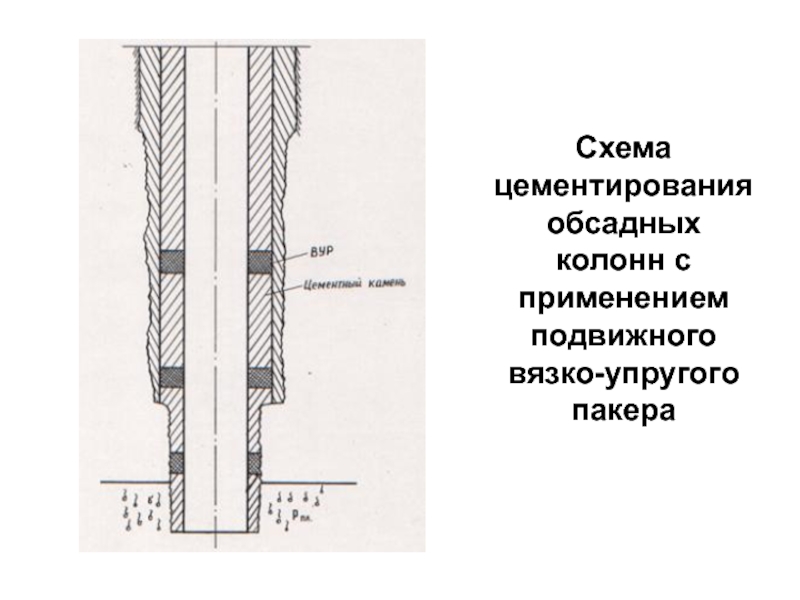
- 91. Схема цементирования обсадных колонн с применением подвижного вязко-упругого пакера
- 92. Лекция 6Управление термостойкостью тампонажных растворов.
- 93. Термическая коррозия цементного камняТермическая коррозия обусловлена термодинамической
- 94. Кривые изменения прочности цементного камня из портландцемента во времени при различной температуре (В/Ц = 0,5)
- 95. Влияние температуры и времени твердения на
- 96. Внутрифазовая перекристаллизация, заключается в том, что образовавшие
- 97. Наибольшей склонностью межфазовых перекристаллизаций обладают высокоосновные продукты
- 98. Наиболее эффективным способом предупреждения термической коррозии является
- 99. Зависимость растворимости кварцевого песка от продолжительности растворения,
- 100. Зависимость растворимости кварца 1 и аморфного кремнезема 2 от температуры
- 101. Принципы получения высокотемпературных цементов 1. Понижение основности
- 102. Термостойкие цементыПортландцементно-песчаные тампонажные смеси;Белито-кремнеземистые цементы;Известково кремнеземистый цемент; Цементы на основе доменных шлаков
- 103. Лекция 5Специальные цементы
- 104. Скачать презентанцию
Литература Агзамов Ф.А., Измухамбетов Б.С.,Токунова Э.Ф. Химия тампонажных и буровых растворов. С-ПБ, Недра, 2011, 268 с Булатов А.И., Данюшевский В.С. Тампонажные материалы: Уч. пособие для вузов.- М:.Недра,1987. 280 с.Цементы тампонажные. Методы
Слайды и текст этой презентации
Слайд 1Регулирование свойств тампонажных материалов для цементирования скважин в осложненных условиях
для
Слайд 2Литература
Агзамов Ф.А., Измухамбетов Б.С.,Токунова Э.Ф. Химия тампонажных и буровых
растворов. С-ПБ, Недра, 2011, 268 с
Булатов А.И., Данюшевский В.С.
Тампонажные материалы: Уч. пособие для вузов.- М:.Недра,1987. 280 с.Цементы тампонажные. Методы испытаний. ГОСТ 26798.1-96
Цементы тампонажные. Технические условия. ГОСТ 1581-96
Данюшевский В.С. и.др. Справочное руководство по тампонажным скважинам. –М.:Недра, 1987, 373 с.
Слайд 3Лекция 1
Требования к тампонажным
материалам.
Портландцемент.
Физико-химические основы твердение портландцемента.
Физико-химические основы регулирования процесса твердения цемента.
Слайд 4Портландцемент
Портландцемент = (Клинкер + Добавка + Гипс) Помол
Затаривание
Клинкер = (Известняк + Глина) обжиг при 15000С
Добавка =
шлак, трепел, опока, песок и др.Гипс 3 – 5 % для регулирования сроков схватывания
Слайд 8Реакции гидратации для минералов цемента
2(ЗСаО•SiO2) + 6Н2О → ЗСаО•2SiO2•3H2О +
3Са(ОН)2 + 502 Дж/г
2(2CaO•SiО2)+ 4H2О → 3СaO•2SiО2 •3Н2О + Са(ОН)2
+ 260 Дж/г3СаО•Аl2О3 + 6Н2О → 3СаО•Аl2О3•6Н2О + 867Дж/г
4СаО•Аl2О3•Fе2O3 + 2Са(ОН)2 + 10Н2О → 3СаО•Al2О3•6Н2О + + 3СаО•Fе2О3•6Н2О + 419Дж/г
Слайд 11Регулирование твердения цемента
- скорость растворения
К - константа скорости растворения;
S
- удельная поверхность;
Е - энергия активации:
Т – температура;
- степень пересыщения.
Слайд 14Лекция 2
Свойства цемента, цементного раствора, приборы для контроля свойств
Физико-химические
основы и средства регулирования свойствами тампонажных растворов.
Слайд 15Свойства цемента
Гранулометрический состав;
Удельная поверхность;
Плотность;
Насыпная плотность.
Слайд 16
Свойства цементного раствора
Водоцементное отношение (В/Ц)
Растекаемость
Прокачиваемость
Сроки схватывания
Реологические свойства
Плотность
Водоотдача
Водоотделение
Слайд 17Контроль свойств цементного раствора
Конус АзНИИ для определения растекаемости
Игла
Вика для определения сроков схватывания
Атмосферный консистометр OFFITE
Слайд 23Свойства цементного камня
Пористость
Предел прочности
Проницаемость
Объемные изменения
Удароустойчивость
Коррозионная стойкость.
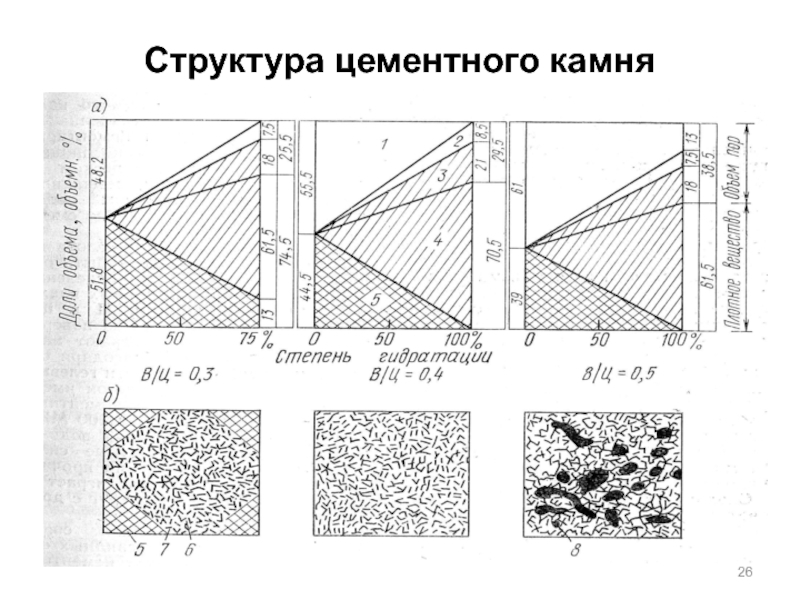
Слайд 24Схема, поясняющая образование структуры цементного камня
1 - непрореагировавшие зерна
цемента;
2 - крупные кристаллы алюминатной структуры;
3 - мельчайшие
кристаллы силикатной структуры;4 – цементный гель, включающий продукты твердения и поры, образовавшиеся между ними (гелевые поры).
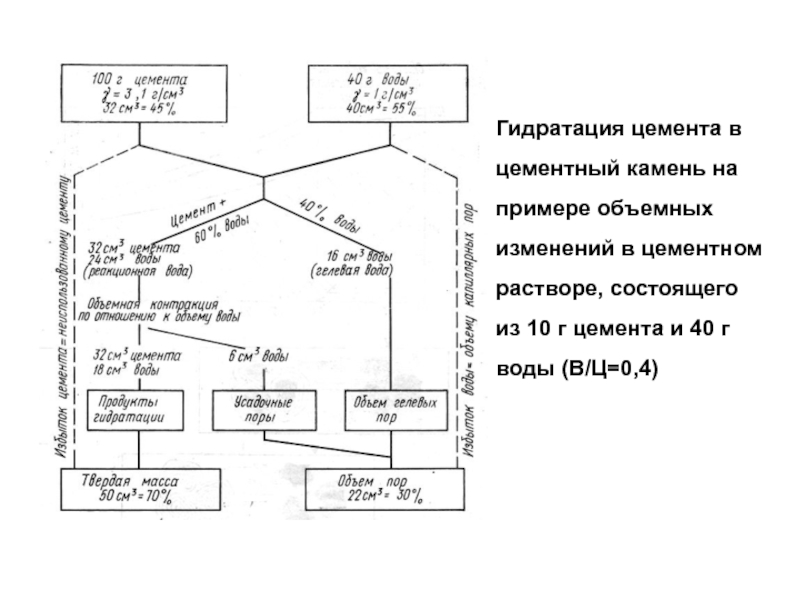
Слайд 25Гидратация цемента в цементный камень на примере объемных изменений в
цементном растворе, состоящего из 10 г цемента и 40 г
воды (В/Ц=0,4)Слайд 27Пресс для определения предела прочности цементного камня
Формы для получения образцов-балочек
и балочка для определения предела прочности на изгиб
Слайд 28Требования к кинетике расширения цементов
основная часть расширения должна происходить после
продавки цементного раствора в затрубное пространство
расширение должна происходить до формирования
жесткой кристаллической структуры цементного камняТрадиционные расширяющиеся добавки
CaO - оксид кальция (негашеная известь)
MgO - оксид магния (каустический магнезит)
ДР-100 (расширяющаяся добавка
(ООО «Нефтегаз-сервис»)
CA-EC6M (добавка производства компании «Messina Chemicals»)
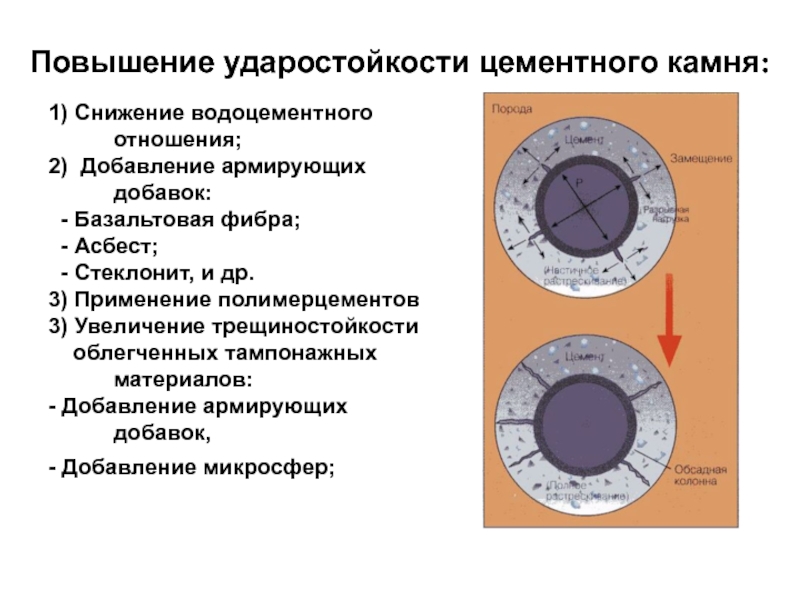
Слайд 30Повышение ударостойкости цементного камня:
1) Снижение водоцементного отношения;
2) Добавление армирующих
добавок:
- Базальтовая фибра;
- Асбест;
- Стеклонит, и др.
3)
Применение полимерцементов3) Увеличение трещиностойкости
облегченных тампонажных материалов:
- Добавление армирующих добавок,
- Добавление микросфер;
Слайд 37Коррозия цементного камня. Определения
Химические и физико-химические процессы, при которых
цементный камень разрушается под действием окружающей среды, называются коррозией.
По механизму
коррозионного поражения цементного камня все виды коррозии можно условно разделить на три группы: физическая, химическая и термическая коррозии.Физическая коррозия цементного камня - это процесс его разрушения за счет влияния окружающей среды, при котором не происходит химического взаимодействия между цементным камнем и окружающей средой. Наиболее часто этот вид коррозии встречается при действии на цементный камень знакопеременных температур или периодического увлажнения, а также при действии некоторых солей, кристаллизующихся в порах камня. Процессы физической коррозии представляют интерес в плане сохранения надежности крепи скважин в зоне ММП, т.к. они могут привести к смятию обсадных колонн в скважинах после их остановки.
Химическая коррозия цементного камня обусловлена процессами взаимодействия окружающей среды с продуктами твердения. Пластовые воды большинства месторождений содержат в своем составе растворенные соли различных кислот и щелочей и являются весьма агрессивными к тампонажному камню. Из-за сложности химического состава вод не представляется возможным описать процесс разрушения цементного камня в этих средах из-за взаимовлияния различных ионов. Поэтому на практике оценивают преобладающий вид коррозии и изучают его на однокомпонентных растворах.
Слайд 38Классификация видов коррозии цементного камня
1. Физическая коррозия:
Разрушение цементного камня при
действии знакопеременных температур;
Разрушение цементного камня при кристаллизации солей.
2. Химическая коррозия:
Коррозия
выщелачивания;Кислотная коррозия;
Сульфатная коррозия;
Магнезиальная коррозия;
Сероводородная коррозия.
3. Термическая коррозия.
Слайд 39Физическая коррозия цементного камня
Разрушение цементного камня при действии знакопеременных температур
Механизм;
Факторы,
определяющие процесс;
Пути повышения стойкости цементного камня.
Слайд 40Механизм
При действии отрицательных температур вода, находящаяся в крупных порах,
способна замерзать и переходить в твердое состояние. В первую очередь
замерзает вода, находящаяся в крупных порах. В мелких порах температура замерзания жидкости значительно ниже. В гелевых порах вода практически не замерзает даже при температурах минус 50 оС. Объем образовавшегося льда приблизительно на 9% больше объема воды, и в результате этого в цементном камне развиваются внутренние напряжения. Причиной возникновения напряжений являются кристаллизационные давления замерзшего льда, как на стенки пор, так и на незамерзшую воду. Когда величина этих напряжений превысит прочность цементного камня на разрыв, в месте их возникновения наблюдаются деструктивные процессы, приводящие к образованию микротрещин. При последующих циклах замораживания и оттаивания число микротрещин увеличивается, а часть замкнутых пор может переходить в открытые капиллярные, способные заполняться водой из окружающей среды. Накопление микротрещин, в конечном итоге, приводит к его полному разрушению.Слайд 41Факторы, определяющие процесс
На долговечность камня при действии знакопеременных температур влияют:
степень
гидратации цемента;
водоцементное отношение;
структура пор цементного камня;
вид и количество добавок;
вид вяжущего и его активность
и т.д.
Слайд 43Механизм
Фазовый состав затвердевшего цементного камня представлен группой гидросиликатов кальция
различной основности, гидроалюминатами и гидроферритами кальция, кристаллическим гидроксидом кальция и
непрореагировавшей частью клинкера.Все продукты твердения цементов являются устойчивыми соединениями только в присутствии определенного количества ионов ОН- и Са2+ в растворе, т.е. в условиях щелочной среды.
Щелочность поровой жидкости цементного камня обеспечивается наличием в ней растворенного гидроксида кальция. Причем рН среды, определяющая границу устойчивости продуктов твердения, колеблется в широких пределах.
Чаще всего степень устойчивости определяется минимально допустимым содержанием Са(ОН)2, при котором соблюдается равновесие между жидкой и твердой фазами камня. Так для Са(ОН)2 равновесная концентрация составляет 0,13; для C2SHn – 0,03-0,12; C4АHn - 0,1-0,10; C2FHn - 0,106-0065; C3АHn - 0,065-0,042; C2АHn – 0,042-0,0115; CSHn – 0,015-0,006 г/л.
Слайд 44Факторы, определяющие процесс
Состав цемента;
Пористость;
Характер воздействия воды;
Химический состав вод;
Наличие негидратированного
цемента
Слайд 45Кинетика процесса
1. Растворение и гидролиз продуктов твердения
2. Диффузный продуктов гидролиза
в окружающую среду
Слайд 47Кислотная коррозия цементного камня
Химия процесса
При контакте цементного камня с кислой
средой происходит мгновенная нейтрализация кислоты щелочью:
2HCl + Ca(OH)2 → CaCl2 + H2O.В результате химической реакции гидроксид кальция, находящийся в порах вблизи границы цементного камня, расходуется, и продукты твердения становятся термодинамически неустойчивыми.
Поэтому они начинают растворяться и, гидролизуясь, выделяют Ca(OH)2, который идет на нейтрализацию новых порций кислоты. После уничтожения Ca(OH)2 в приграничном слое «агрессор» уничтожает Ca(OH)2 в следующем слое, и процесс коррозии идет до полного поражения цементного камня.
Слайд 50Факторы, определяющие процесс
Состав цемента;
Пористость;
Реакционная емкость;
Добавки ингибиторы коррозии;
Концентрация кислоты на границе
с цементным камнем
Слайд 52Сульфатная коррозия цементного камня
Химия;
Механизм;
Управление;
Принципы получения сульфатостойких цементов;
Проблемы;
Слайд 53Сульфатная коррозия цементного камня (химия)
Na2SO4 + Ca(OH)2 = CaSO4 +
2NaOH
Когда концентрация CaSO4 превышает 2100мг/л
(Са2+ = 0, 518 г/л
и SО42- = 1,82 г/л), то раствор становится пересыщенным по отношению к кристаллогидрату CaSO4.2H2О. При достижении определенной степени пересыщения возникают условия для спонтанного возникновения зародышей новой фазы, которые затем растут и выпадают в осадок.
Слайд 54Чаще всего сульфатная коррозия связывается с образованием гидросульфоалюмината кальция (эттрингита),
образующегося за счет взаимодействия иона SО42- с гидроалюминатом кальция С3АН6
в присутствии Са(ОН)23CaO∙Al2O3∙6H2O + Ca2+ + SО42- + H2O → 3CaO∙Al2O3∙3CaSO4∙32 H2O.
Слайд 55К механизму сульфатной коррозии
Условное соотношение объемов до сульфатной
коррозии (а)
цементного камня и после нее (б)
1 –ЗСаО.Аl2О3, прореагировавший с
гипсом; 2 - CaSO4; 3 - ЗСаО.Аl2О3.3CaSO4.31H2O; 4 – поры
Слайд 56
Необходимыми условия для протекания сульфатной коррозии
наличие сульфат ионов, проникших внутрь
цементного камня;
наличие в составе цементного камня алюминий содержащих фаз (в
первую очередь это C3A);высокое pH поровой жидкости (больше 12,5).
Ограничение любого из указанных факторов будет способствовать повышению стойкости цементного камня.
Слайд 57Анализ условий
Ограничение скорости поступления ионов SО42- внутрь цементного камня.
Уменьшение
пористости камня за счет снижения В/Ц;
Кольматация порового пространства специальными добавками;
Слайд 58Анализ условий
2. Снижение содержания алюминий содержащих фаз в цементе.
Используется
на заводах при получении сульфатостойких цементов, в которых доля C3A
не превышает 5%, C3A + C4AF не превышает 22%, а C3S не превышает 50%.Слайд 59Анализ условий
3. Снижение pH цементного камня.
Ввод кремнеземистых добавок в
цемент для снижения основности продуктов твердения имеющих рН < 12,0;
Применение
шлаковых, пуццолановых, глиноземистых вяжущих;Повышение температуры твердения;
Слайд 60Магнезиальная коррозия цементного камня
Химия процесса :
MgSO4 + Са(ОН)2 = Mg
(ОН)2 + CaSO4
MgCl2 + Са(ОН)2 = Mg (ОН)2 + CaCl2.
В
обоих случаях происходит необратимая реакция с образованием практически нерастворимого гидроксида магния (растворимость 18,2 мг/л). Слайд 61Возможный механизм коррозии
1. Кислотный, поскольку одним продуктом реакции
является хлорид
кальция, который гидролизуясь, дает кислую реакцию.
Поэтому коррозионные процессы в
цементном камне под действием MgCl2 протекают по кислотному механизму, т.е. носят послойный характер. Все доставляющие цементного камня начинают разрушаться при понижении щелочности среды ниже критической с выделением свободной Са(ОН)2.
Роль MgCl2 сводится к поддержанию максимального градиента Са(ОН)2 между поровой жидкостью и окружающей средой.
Данный случай характерен для контакта цементного камня с неограниченным объемом агрессора низкой концентрации.
Слайд 62Возможный механизм коррозии
2. Осмотический.
Выпадающий в осадок Mg (ОН)2 образует
полупроницаемую перегородку на поверхности цементного камня, обеспечивая возникновение осмотического давления,
которое разрушает цементный камень при действии магнезиальных солей.Слайд 63Сероводородная коррозия цементного камня
Сероводород (H2S) является коррозионноактивным кислым газом, оказывающим
интенсивное разрушающее действие не только на металлические конструкционные материалы (трубы,
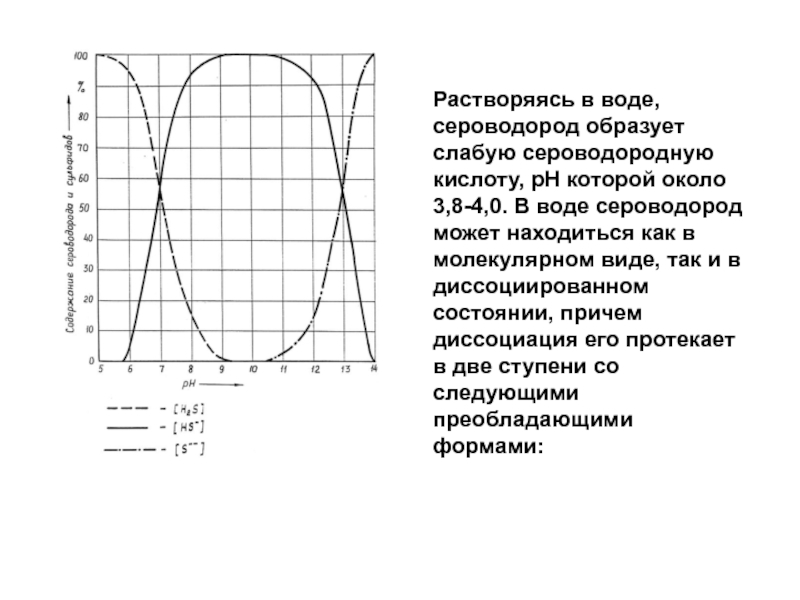
оборудование и т.д.), но также и на многочисленные неметаллические материалы, к которым относятся тампонажные цементы. Высокая токсичность газа создает серьезную опасность для окружающей среды в окрестности скважин, а также экологическому равновесию, как на поверхности, так и недр.Слайд 65Растворяясь в воде, сероводород образует слабую сероводородную кислоту, рН которой
около 3,8-4,0. В воде сероводород может находиться как в молекулярном
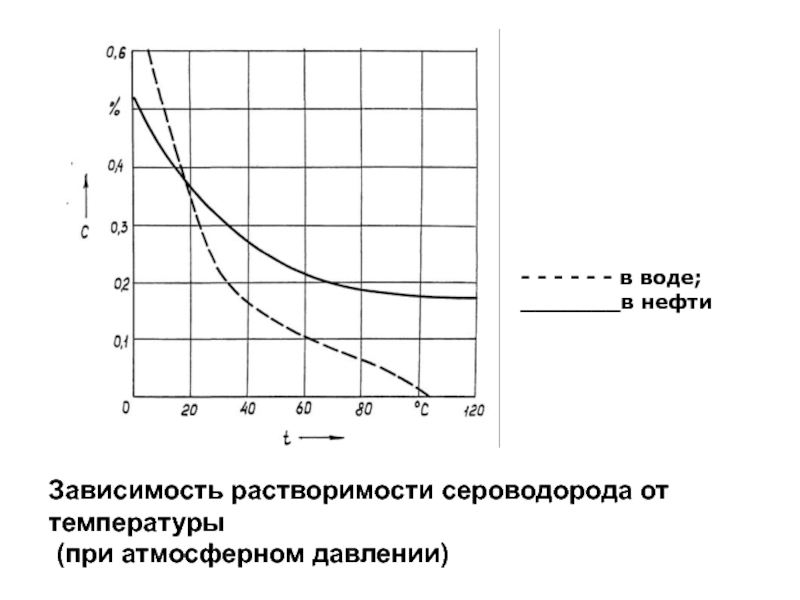
виде, так и в диссоциированном состоянии, причем диссоциация его протекает в две ступени со следующими преобладающими формами:Слайд 66Зависимость растворимости сероводорода от температуры
(при атмосферном давлении)
- -
- - - - в воде;
_______в нефти
Слайд 67Результаты расчетов реакций коррозии продуктов твердения цемента с сероводородом в присутствии
метана
Слайд 69Наиболее уязвимы к сероводороду высокоосновные гидросиликаты кальция, Са(ОН)2, гидроалюминаты кальция,
соединения, содержащие оксиды железа.
Наличие кислорода усиливает процесс поражения благодаря
образованию гипса и гидросульфоалюминатов в порах цементного камня.Наличие углеводородов интенсифицирует процесс коррозии.
Слайд 71Коррозия цементного камня под действием газообразного сероводорода
В условиях газовой сероводородной
агрессии механизм поражения носит объемный характер, разрушение сопровождается объемными изменениями
камня.Слайд 77Даже небольшое количество продуктов коррозии, накопленное в порах или перегибах
пор, вызывает резкое падение прочности и разрушение цементного камня в
результате развития высоких кристаллизационных давлений и появления очагов разрушения в наиболее слабых местах камня.Разрушение наступает, когда в химическое взаимодействие с агрессором вступила только небольшая часть продуктов твердения материала, в первую очередь, часть гидроксида кальция - наиболее активного по отношению к сероводороду. То есть достаточно прореагировать небольшому количеству гидроксида кальция, чтобы камень претерпел необратимые изменения своих структурно-механических характеристик.
Таким образом, основной причиной разрушения камня в условиях газовой сероводородной агрессии является развитие кристаллизационных давлений в отдельных точках камня (перегибах пор), играющих роль очагов поражения.
Уменьшение среднего размера пор и рационализация структуры порового пространства повышают его стойкость к газовой сероводородной коррозии.
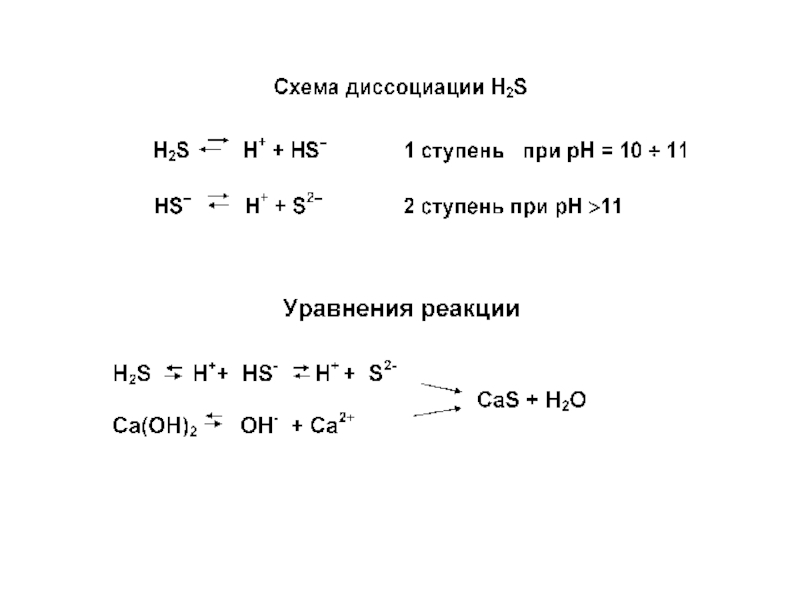
Данная схема справедлива только в том случае, когда сероводород взаимодействует с портландцементным камнем, имеющим рН ≥ 12,0, и продуктом химической реакции является сульфид кальция CaS:
Н2S + Ca(OH)2 = CaS + 2H2O.
Когда с сероводородом контактирует цементный камень, имеющий в составе продуктов твердения низкоосновные гидросиликаты кальция (рН ≤ 11,0), химическая реакция идет по схеме: Н2S + Ca(OH)2 = Ca(НS)2 + H2O.
Гидросульфид кальция Ca(НS)2, являясь легко растворимым соединением, остается в поровой жидкости, и через некоторое время между жидкой и твердой фазами наступает равновесие, т.е. процесс коррозии прекращается.
Слайд 79Тампонажные материалы, стойкие к газообразному сероводороду
Шлаковые цементы;
Песчанистые цементы;
Белитокремнеземистые цементы;
Глиноземистый цемент;
Сульфоалюминатный
цемент.
Слайд 80Коррозия цементного камня под действием растворенного сероводорода
В зависимости от состава
продуктов твердения цементный камень может иметь различную рН, и при
контакте с сероводородной кислотой могут образоваться различные продукты коррозии.При рН≤ 11 образуются продукты химической реакции в виде Са(НS)2, которые являются хорошо растворимыми и выносятся в окружающую среду. При рН ≥12 и более вероятно образование малорастворимого соединения СаS, выпадающего в осадок, который за счет взаимодействия с новыми порциями сероводорода переходит в Са(НS)2.
В результате химических реакций поровая жидкость обедняется щелочью, что приводит к нарушению термодинамического равновесия между твердой и жидкой фазами цементного камня. Продукты твердения продолжают растворяться и гидролизуются с выделением свободной Са(ОН)2. Прежде всего, разрушается твердая фаза, представленная кристаллическим гидратом окиси кальция, высокоосновными алюминатами, гидросиликатом и гидроферритом кальция. Следовательно, механизм сероводородной коррозии под действием растворенного сероводорода близок к кислотной коррозии.
Нерастворимая часть цементного камня, химически инертная по отношению к Н2S, образует буферную зону. Она представлена продуктами разложения гидратных фаз в виде гелей SiO2 ·nН2О, А1(ОН)3 и продуктами коррозии в виде твердой (FeS, CaS) и жидкой фазы (Са(НS)2). Она является более проницаемой, чем исходный камень, так как реакционноспособная часть цементного камня в процессе гидролиза и растворения перешла в раствор, а затем в виде хорошо растворимых продуктов коррозии - Са(НS)2 удалилась в окружающую среду.
Слайд 83С точки зрения долговечности крепи более предпочтительным является встреча потока
агрессора и гидроксида кальция за пределами цементного камня, т.к. при
этом внутрь камня не поступают ионы агрессивного флюида, не происходит депассивация металла обсадной колонны за счет сульфидов, гидросульфидов и гидрокарбонатов, а также исключается накопление в порах камня нерастворимых продуктов коррозии, обуславливающих возникновение внутренних напряжений в цементном камне и его объемное разрушение.Практически все из этих величин являются управляемыми с помощью тех или иных технологических приемов, в частности:
концентрация Са(ОН)2 в цементном камне – регулируется составом продуктов твердения;
концентрация Н2S в приствольной части пласта - может быть снижена за счет замены части агрессивного флюида на инертный по отношению к цементному камню;
пористость цементного камня - может регулироваться начальным водосодержанием или технологией приготовления тампонажного раствора;
пористость пласта в приствольной зоне - управляется кольматацией.
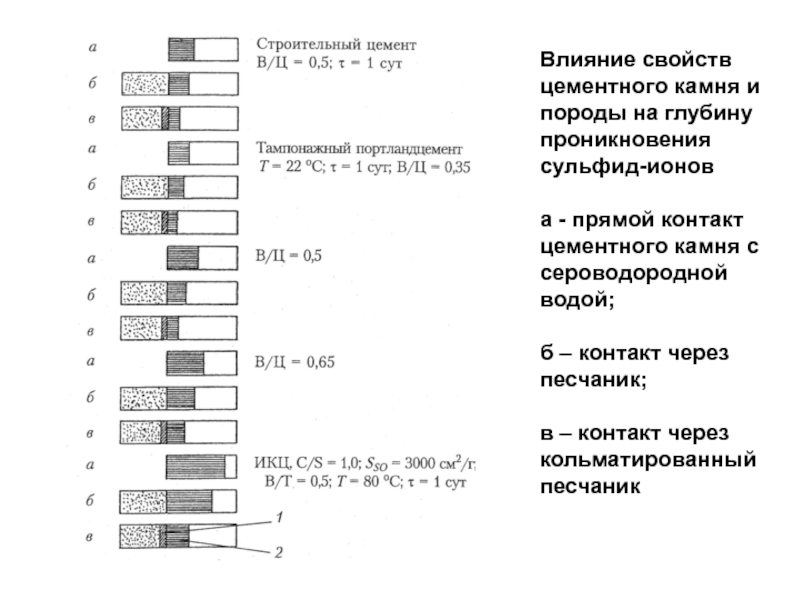
Слайд 84Влияние свойств цементного камня и породы на глубину проникновения сульфид-ионов
а - прямой контакт цементного камня с сероводородной водой;
б –
контакт через песчаник;в – контакт через кольматированный песчаник
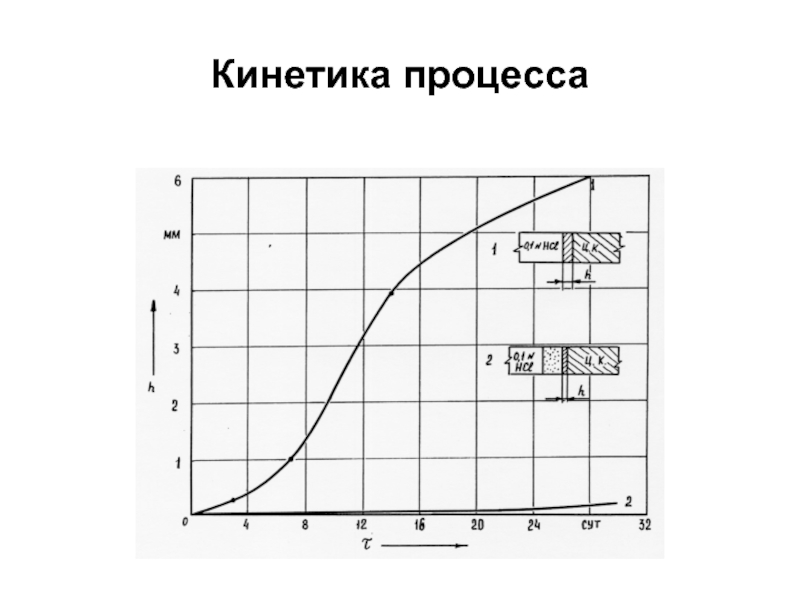
Слайд 86Кинетика
коррозии
камня из цементно-известково-зольного вяжущего в растворенном сероводороде
Слайд 88Стойкость тампонажных материалов дезинтеграторного
приготовления в сероводородсодержащей нефти скв. 107
месторождения Жанажол
Слайд 89Пути повышения долговечности крепи скважин в агрессивных средах
Материалы
Регулируется реакционная емкость
концентрация цементного камня;
Добавки «жертвы»;
Управление структурой цементного камня;
Технология крепления
Снижение концентрации Н2S
в приствольной части пласта путем его частичной нейтрализации;Снижение пористость пласта в приствольной зоне;
Применение подвижных пакеров;
Слайд 93Термическая коррозия цементного камня
Термическая коррозия обусловлена термодинамической неустойчивостью продуктов твердения
их перекристаллизацией и переходом в термодинамически более устойчивое состояние.
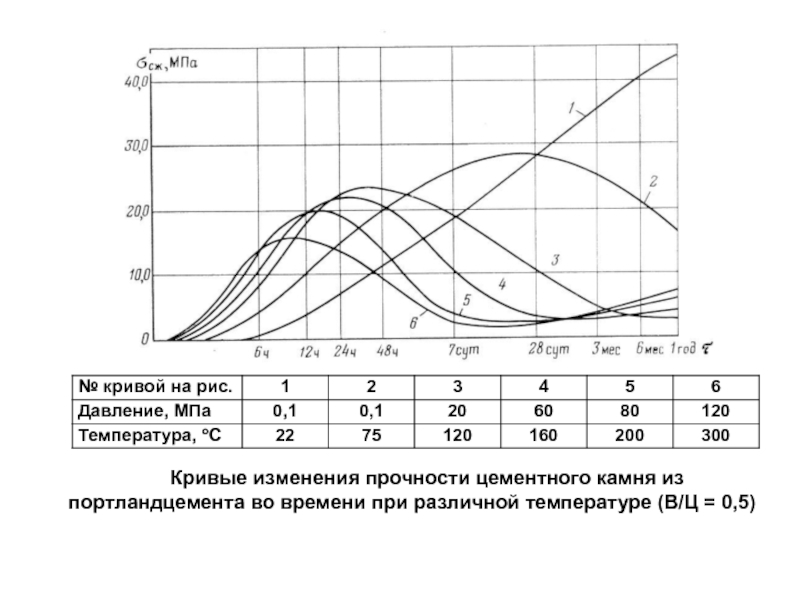
Слайд 94Кривые изменения прочности цементного камня из портландцемента во времени при
различной температуре (В/Ц = 0,5)
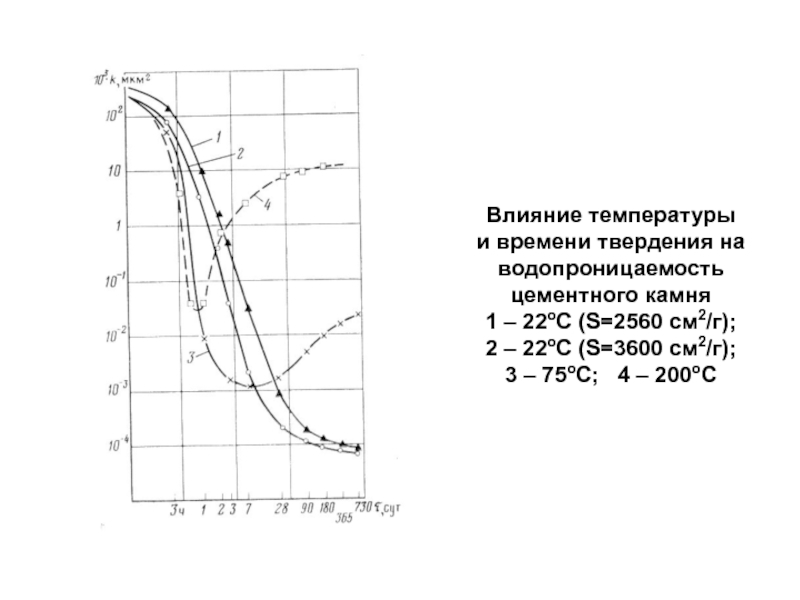
Слайд 95Влияние температуры и времени твердения на водопроницаемость цементного камня 1
– 22оС (S=2560 см2/г); 2 – 22оС (S=3600 см2/г); 3 –
75оС; 4 – 200оССлайд 96Внутрифазовая перекристаллизация, заключается в том, что образовавшие при твердении цемента
мельчайшие продукты твердения начинают укрупняться.
Межфазовая перекристаллизация приводит к образованию
кристаллических соединений иной кристаллической структуры.Цепочка фазовых переходов продуктов твердения может быть представлена следующим образом:
С3S + H2O → C3S2H3 → C2SH8 → C2SH( H ) → C6S6H → C5S6H
Слайд 97Наибольшей склонностью межфазовых перекристаллизаций обладают высокоосновные продукты твердения, в которых
CaO/ SiO2 = C/S > 1,2.
Примером таких продуктов может
быть C3S2H3 (3CaO . 2SiO2 . 3H2O), у которого С/S=1,4. С/S= 3 х (40+16) / 2 х (28+2х16) = 3х56 / 2х60 = 168 / 120 = 1,4.
Наиболее устойчивы к межфазовой перекристаллизациям низкоосновные соединения, в которых отношение С/S ≈ 1.
Слайд 98Наиболее эффективным способом предупреждения термической коррозии является уменьшение С/S в
самом цементе.
На практике этого можно достичь добавкой песка к
цементу в количестве 40 - 45 %. Причем, чем выше температура твердения, тем больше должна быть крупность песка. Роль песка (SiO2) сводится к связыванию свободного Са(ОН)2 и понижению основности образующих продуктов твердения по уравнениям:
3СаО . SiО2 + Н2О → 3СаО . 2SiО2 . 3Н2О + 3Са(ОН)2
SiО2 + Са(ОН)2 → xСаО . ySiО2 . z Н2О.
Слайд 99Зависимость растворимости кварцевого песка от продолжительности растворения, температуры и удельной
поверхности: 1 и I1 - Т = 173 °С; 2 и
21 - Т = 203 °С; 3 и 31- Т=223°С; 1,2,3 - S уд = 80 см2 /г; 11, 21, 31 - S уд =390 см2/гСлайд 101Принципы получения высокотемпературных цементов
1. Понижение основности продуктов твердения;
2. Управление
кинетикой фазообразования.
Цель исключение образования фазы С2SH(А).
Пути
образования СSH(В):бесстадийный (из извести и кремнезема):
СаО + SiO2 + H2O СSH(В);
одностадийный (в результате понижения основности гидрата С2SH2 ):
СаО + SiO2 + H2O С2SH2 СSH(В);
двухстадийный (в результате понижения основности гидрата С2SH(А):
СаО + SiO2 + H2O С2SH2 С2SH(А) СSH(В).