Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота
Содержание
- 1. Серная кислота
- 2. А) Кислородосодержащая.Б) Двухосновная.В) Сильная.Г) Растворимая.Д) Стабильная.Физические свойства концентрированной серной кислоты: Тяжёлая маслянистая жидкость, H2SO4гигроскопична,обугливает органические вещества.
- 3. Слайд 3
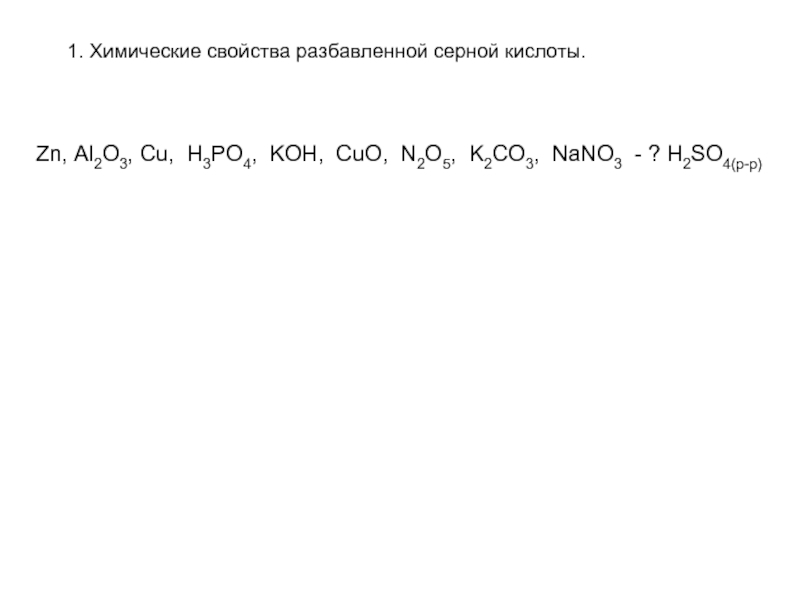
- 4. 1. Химические свойства разбавленной серной кислоты.Zn, Al2O3,
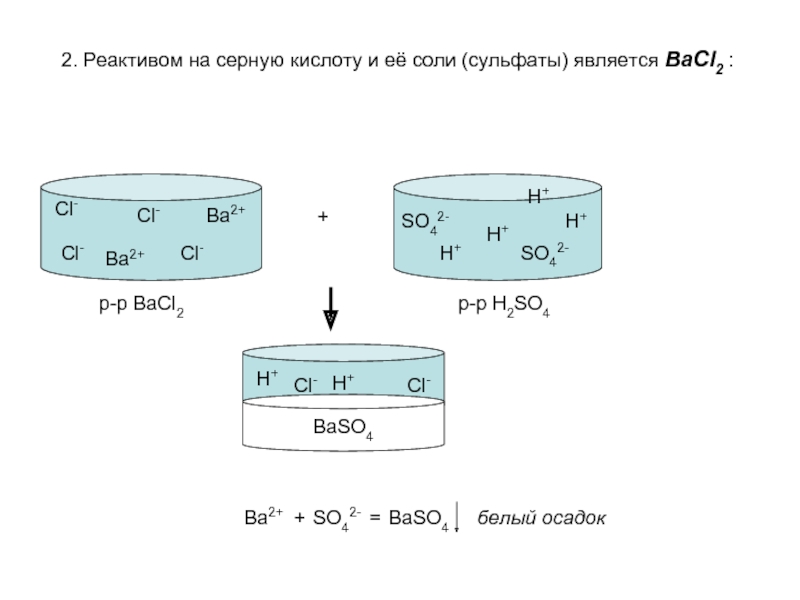
- 5. 2. Реактивом на серную кислоту и её
- 6. Слайд 6
- 7. 3. Взаимодействие концентрированной серной кислоты с металлами.А)
- 8. Домашнее задание:2) Закончить УХР в молекулярном и
- 9. Скачать презентанцию
А) Кислородосодержащая.Б) Двухосновная.В) Сильная.Г) Растворимая.Д) Стабильная.Физические свойства концентрированной серной кислоты: Тяжёлая маслянистая жидкость, H2SO4гигроскопична,обугливает органические вещества.
Слайды и текст этой презентации
Слайд 2А) Кислородосодержащая.
Б) Двухосновная.
В) Сильная.
Г) Растворимая.
Д) Стабильная.
Физические свойства концентрированной серной кислоты:
Слайд 41. Химические свойства разбавленной серной кислоты.
Zn, Al2O3, Cu, H3PO4, KOH,
CuO, N2O5, K2CO3, NaNO3 - ? H2SO4(р-р)
Слайд 52. Реактивом на серную кислоту и её соли (сульфаты) является
BaCl2 :
Cl-
Cl-
Ba2+
Cl-
Cl-
Ba2+
H+
H+
H+
H+
SO42-
SO42-
+
H+
BaSO4
Cl-
Cl-
H+
белый осадок
Ba2+
+
SO42-
=
BaSO4
р-р BaCl2
р-р H2SO4
Слайд 73. Взаимодействие концентрированной серной кислоты с металлами.
А) Окисляет практически все
металлы (кроме золота Au и платины Pt).
Б) Fe и Al
пассивируются – покрываются плёнкой (т.е. в обычных условиях реакции нет).H2SO4(конц.) + Me0
MeSO4
+
H2O
+
H2S
S
SO2
;
;
Электрохимический ряд напряжений металлов
Zn
Н2
H2S
S
SO2
В) Водород не выделяется!
Слайд 8Домашнее задание:
2) Закончить УХР в молекулярном и ионном виде:
Al2O3 +
H2SO4 →
KOH + H2SO4 →
CuO + H2SO4 →
K2CO3 + H2SO4
→1) Параграфы 22 и 21 (c/р - тест );
3) Закончить УХР, используя метод электронного баланса:
Са + H2SO4(конц.) →
Ag + H2SO4(конц.) →
Теги