Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы и их соединения
Содержание
- 1. Щелочные металлы и их соединения
- 2. Слайд 2
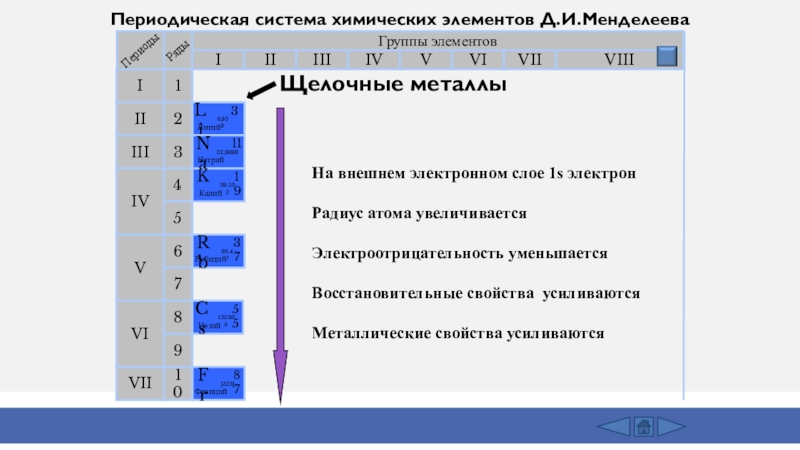
- 3. Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV21345671098Щелочные металлыПериодическая система химических элементов Д.И.МенделееваНа
- 4. Li 0 – e- → Li +1
- 5. Слайд 5
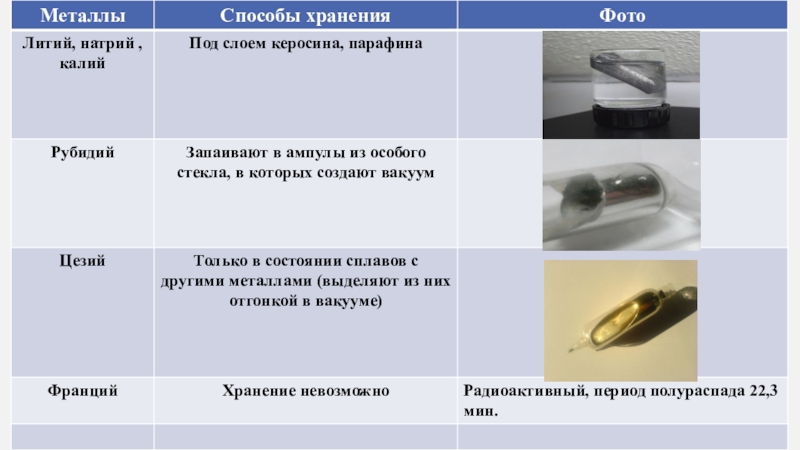
- 6. Щелочные металлы серебристо-белого цвета, кроме цезия (серебристо-желтого
- 7. Слайд 7
- 8. Слайд 8
- 9. Химические свойства щелочных металловЩелочные металлы активно взаимодействуют
- 10. Химические свойства щелочных металловПри взаимодействии щелочных металлов
- 11. Химические свойства щелочных металловПри взаимодействии щелочных металлов
- 12. Взаимодействие щелочных металлов с кислородом
- 13. Взаимодействие щелочных металлов с водойПри взаимодействии с
- 14. Взаимодействие щелочных металлов с кислотами (проводят редко,
- 15. Качественная реакция на катионы щелочных металлов —
- 16. Оксиды щелочных металловОбщая формула Met2OОксиды щелочных металлов
- 17. Гидроксиды щелочных металловОбщая формула MetOHNaOH – гидроксид
- 18. Свойства гидроксидов щелочных металловГидроксиды щелочных металлов взаимодействуют
- 19. ПрименениеЩелочные металлы и их соединения используются в разных сферах деятельности человека.двигателиПроизводство стеклаПроизводство бензинареакторыМылоБумага
- 20. Слайд 20
- 21. Скачать презентанцию
Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV21345671098Щелочные металлыПериодическая система химических элементов Д.И.МенделееваНа внешнем электронном слое 1s электронРадиус атома увеличиваетсяЭлектроотрицательность уменьшаетсяВосстановительные свойства усиливаютсяМеталлические свойства усиливаются
Слайды и текст этой презентации
Слайд 3Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
9
8
Щелочные металлы
Периодическая система химических элементов Д.И.Менделеева
На внешнем электронном слое
1s электрон
Слайд 4Li 0 – e- → Li +1
Na – e
- → Na +1
K 0 – e - → K
+1Степень окисления щелочных металлов +1
Щелочные металлы – сильные восстановители
Слайд 6Щелочные металлы серебристо-белого цвета, кроме цезия (серебристо-желтого цвета), легкие, мягкие,
хорошо режутся ножом, легкоплавкие. От лития к францию температура плавления
и твердость снижаютсяСлайд 9Химические свойства щелочных металлов
Щелочные металлы активно взаимодействуют почти со всеми
неметаллами
2Met 0 + H2 0 = 2Met+1H-1
2Na0 + H2 0
= 2Na+1H-1 (гидрид натрия)Слайд 10Химические свойства щелочных металлов
При взаимодействии щелочных металлов с галогенами образуются
соли (галогениды металлов):
2Met0 + Cl20 = 2Met+1Cl-1
2Na0 + Cl20 =
2Na+1Cl-1 (хлорид натрия)Слайд 11Химические свойства щелочных металлов
При взаимодействии щелочных металлов с серой образуются
сульфиды металлов:
2Met0 + S0 = Met2+1S-2
2Na + S = Na2S
(сульфид натрия)При взаимодействии щелочных металлов с азотом образуются нитриды металлов:
6Met0 + N20 = 2Met3+1N-3
6Li + N2 = 2Li3N
Слайд 12Взаимодействие щелочных металлов с кислородом
4Li
+ O2 = 2Li2O (оксид лития)
2Na + O2 = Na2O2 (пероксид натрия)2K + 2O 2 = K2O4 (надпероксид калия)
Na2O2 + 2Na = 2Na2O (оксид натрия)
K2O4 + 6K = 4K2O (оксид натрия)
Слайд 13Взаимодействие щелочных металлов с водой
При взаимодействии с водой щелочные металлы
образуют щёлочи, восстанавливая воду до водорода, и водород:
2Na + H2O
= 2NaOH + H2↑ 2K + H2O = 2KOH + H2↑
(Li - спокойно, Na - энергично, остальные – со взрывом – воспламеняется выделяющийся Н2 , Rb и Cs реагируют не только с жидкой Н2О, но и со льдом.)
Слайд 14Взаимодействие щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция
с водой):
2Na + 2HCl → 2NaCl + H2
Слайд 15Качественная реакция на катионы щелочных металлов — окрашивание пламени в
следующие цвета:
Li+ – карминово-красный, Na+ – желтый, K+, Rb+ и Cs+ – фиолетовый
Слайд 16Оксиды щелочных металлов
Общая формула Met2O
Оксиды щелочных металлов являются типичными основными
оксидами, они обладают всеми свойствами основных оксидов:
Взаимодействуют с водой
Na2O +H2O
=2NaOHВзаимодействуют с кислотными оксидами
Na2O +СO2 =2Na2СО3
Взаимодействуют с кислотами
Na2O + 2HCl =2NaСl + H2
Слайд 17Гидроксиды щелочных металлов
Общая формула MetOH
NaOH – гидроксид натрия (едкий натр,
каустическая сода)
КОН – гидроксид натрия (едкое кали)
Это белые кристаллические вещества,
хорошо растворимые в водеСлайд 18Свойства гидроксидов щелочных металлов
Гидроксиды щелочных металлов взаимодействуют с кислотными (и
амфотерными) оксидами:
2NaOH+CO2=Na2CO3+H2O
Взаимодействуют с кислотами (и амфотерными гидроксидами):
KOH+HCl=KCl+H2O
Взаимодействуют с растворимыми
солями:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4