Слайд 1Спектроскопические методы анализа
«Я не могу быть равнодушным к цвету.
Я радуюсь ярким цветам и искренне огорчаюсь блекло - коричневым»
Уинстон Черчиль
Спектроскопические методы анализа основаны на способности атомов и молекул вещества испускать, поглощать или рассеивать электромагнитное излучение
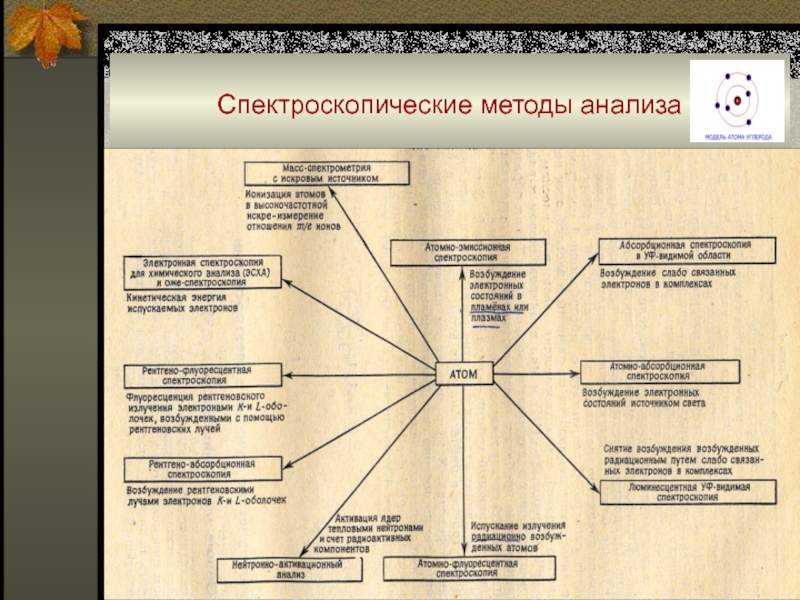
Слайд 2Спектроскопические методы анализа (классификация)
Слайд 3Спектроскопические методы анализа (классификация)
Слайд 4Области электромагнитного спектра
Слайд 6Области электромагнитных волн
Слайд 7Взаимодействие электромагнитного излучения с веществом
Слайд 8Взаимосвязь спектроскопических методов и областей электромагнитного спектра
Слайд 9Спектроскопические методы анализа
Слайд 10Спектроскопические методы анализа
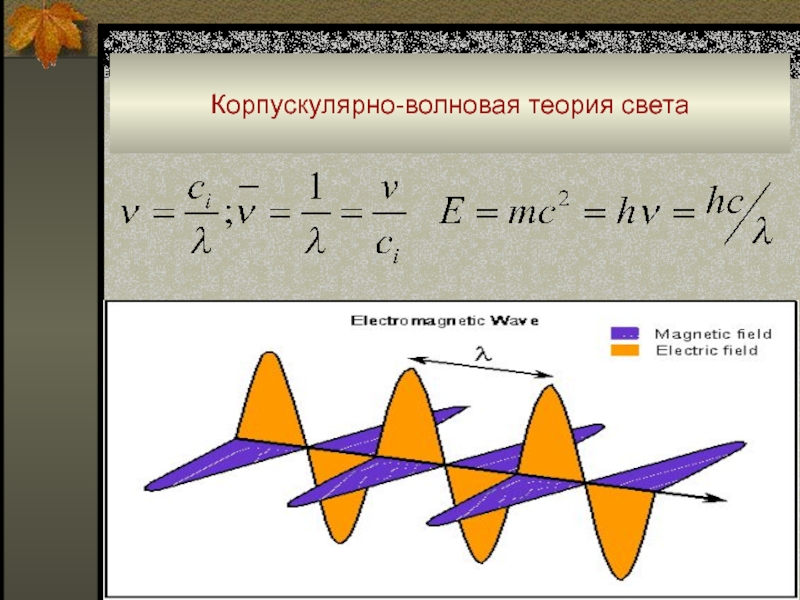
Слайд 11Корпускулярно-волновая теория света
■ Как известно, электромагнитное излучение имеет двойственную природу:
с одной стороны это волна, а с другой – корпускула,
материальная частица.
Вопросами, связанными с природой электромагнитного излучения, занимается корпускулярно-волновая теория.
Согласно этой теории, электромагнитная волна состоит из осциллирующих электрической (Е) и магнитной (Н) составляющих, которые ортогональны друг другу и распространяются в вакууме с постоянной скоростью 3108 м•c-1 перпендикулярно направлению распространения световой волны Х.
Слайд 12Корпускулярно-волновая теория света
Слайд 13Корпускулярно-волновая теория света
Длина волны (λ) – расстояние, на которое распространяется
электромагнитная волна за один период ее осцилляции (м, мкм, нм);
λ = C/ ν.
Частота (ν) – число колебаний (осцилляций) электромагнитной волны в единицу времени (Гц, т.е. с-1).
Волновое число (ṽ) - число длин волн, укладывающихся в единицу длины (см-1 или кейзер).
Скорость света (Сi) – скорость распространения электромагнитной волны в определенной среде (в вакууме С=2,997925 108 м/с): C= ν•λ.
Слайд 14Характеристики света
Прохождение света через оптическую среду (например, воздух) сопровождается взаимодействием
излучения с валентными электронами молекул вещества, в результате чего скорость
распространения излучения уменьшается.
Поскольку частота излучения при этом остается постоянной, длина волны изменяется. Так, при переходе видимого излучения из воздуха в стекло, длина волны уменьшается приблизительно на 200 нм.
Амплитуда – максимальное значение вектора электрической составляющей (E) электромагнитной волны.
Энергия отдельного кванта Е = hv = hC/λ.
Слайд 15Характеристики света
Прохождение света через оптическую среду:
Слайд 16Характеристики света
Мощность Ф (Ватт = Дж/c) – энергия dE, переносимая
излучением через некоторую поверхность S за единицу времени dt: Ф
= dE/dt.
Преломление света – отношение скорости света в вакууме (c) к скорости распространения излучения в данной среде (): n=C/. Абсолютный показатель преломления воздуха составляет 1,0003. При переходе света из оптически менее плотной в оптически более плотную среду показатель преломления изменяется скачкообразно.
Поляризация – поглощение одной из составляющих излучения (электрическая, магнитная), которые распространяются перпендикулярно направлению распространения световой волны.
Слайд 17Характеристики света
Закон преломления света Снеллиуса: sinα1 / sinα2 = n2
/n1 = n2 (для воздуха n1 ~ 1)
Слайд 18Характеристики света
Плоскость поляризации – плоскость (ху), определяемая электрическим вектором.
Направление
поляризации – направление электрического (у) или магнитного (x) векторов.
Слайд 19
Рассеяние света
Рассеяние света – изменение какой-либо характеристики
излучения при его взаимодействии с веществом.
Для молекул и молекулярных ассоциатов,
размеры которых значительно меньше, чем длина волны излучения, рассеяние света называется релеевским рассеянием.
Рассеяние света на более крупных – коллоидных частицах называется тиндалевским (его можно наблюдать невооруженным глазом).
Еще один вид рассеяния – комбинационное (рамановское) рассеяние, сопровождается изменением колебательной энергии рассеивающих частиц; это явление лежит в основе метода комбинационного рассеяния.
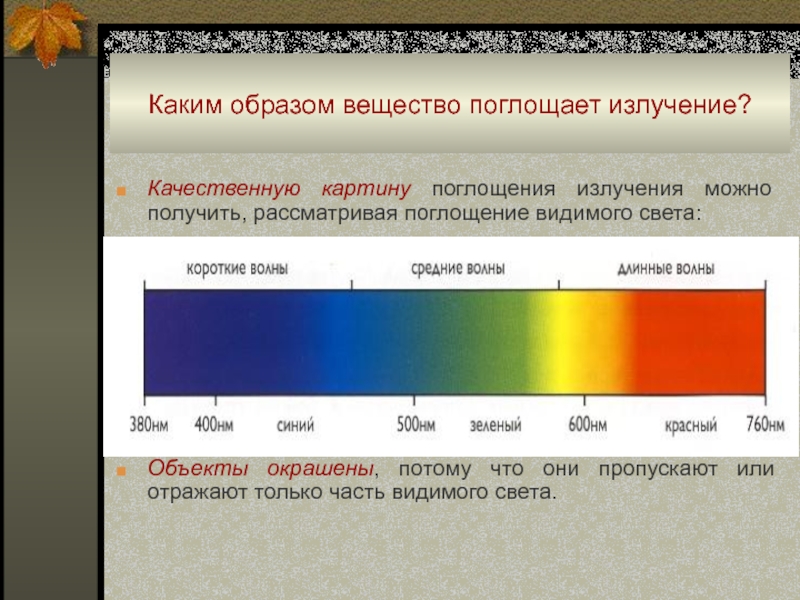
Слайд 22Каким образом вещество поглощает излучение?
Качественную картину поглощения излучения можно
получить, рассматривая поглощение видимого света:
Объекты окрашены, потому что они пропускают
или отражают только часть видимого света.
Слайд 23Каким образом вещество поглощает излучение?
Цвет прозрачных объектов – пропущенное излучение
(этот цвет является дополнительным к цвету поглощенного излучения).
Цвет непрозрачных объектов
– отраженное излучение.
Слайд 24Каким образом вещество поглощает излучение?
■ Молекула может поглощать излучение
в результате трех основных процессов:
• во-первых, молекула вращается вокруг своих
различных осей, находясь на определенном уровне вращательной энергии и за счет поглощения дискретного излучения может перейти на более высокий уровень – вращательные переходы;
• во-вторых, атомы или группа атомов в молекуле колеблются относительно друг друга и за счет поглощения дискретного излучения молекула может перейти на уровень с более высокой колебательной энергией – колебательные переходы;
Слайд 25Каким образом вещество поглощает излучение?
• в - третьих, электроны молекулы
могут переходить на более высокие уровни электронной энергии – электронные
переходы.
Слайд 26Каким образом вещество поглощает излучение?
■ Поскольку все эти виды энергии квантованы,
соответствующие переходы могут происходить только при определенном значении длины волны,
когда энергия фотона hv равна интервалу между дискретными уровнями внутренней энергии.
Относительные энергии переходов убывают в ряду: электронные > колебательные > вращательные.
Слайд 27Энергия молекулы
Е = Ее + Еv + Еr
Слайд 28Диаграмма энергетических уровней молекулы
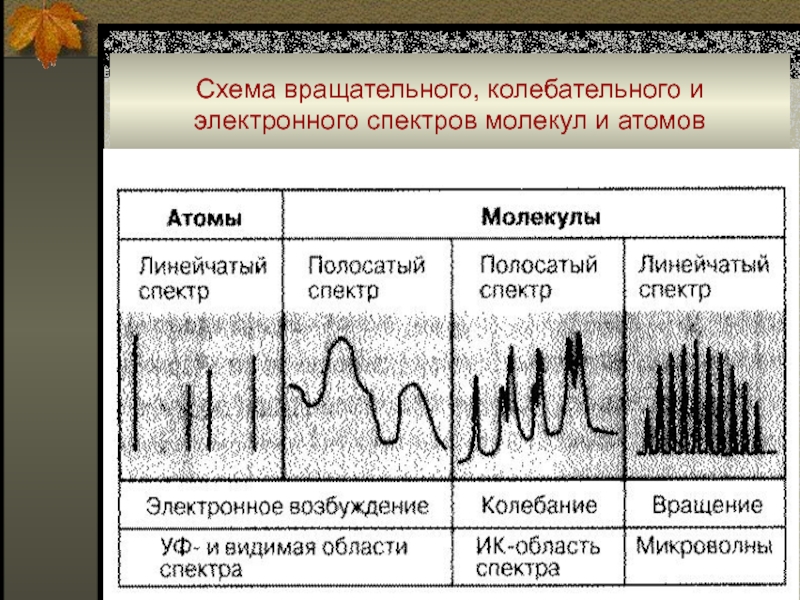
Слайд 29Схема вращательного, колебательного и электронного спектров молекул и атомов
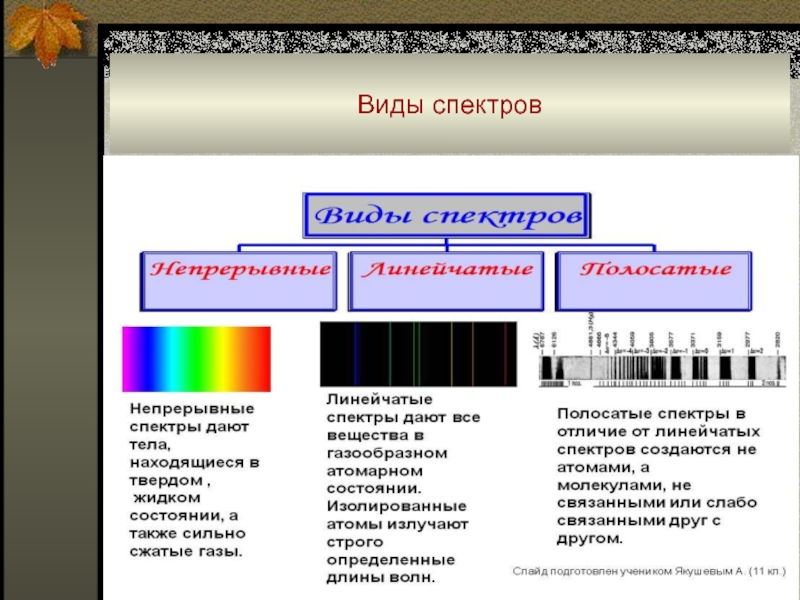
Слайд 31Атомные спектры
Атомные спектры возникают при испускании или поглощении электромагнитного
излучения свободными или слабо связанными атомами (в газах или парах)
и состоят из отдельных спектральных линий (т.е. являются линей-чатыми).
Спектральные линии можно характеризовать частотой излучения ν, ко-торая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению:
hv = Ei - Ek
Слайд 32Атомные спектры
Спектры испускания или эмиссионные получают при возбу-ждении атомов
различными способами (тепловыми столкновениями, фотонами, электронным ударом и т.д.).
Время
жизни возбужденного состояния невелико и составляет 10-7 - 10-8 с. В течение этого времени атом теряет избыточную энергию путем испускания кванта электромагнитного излучения.
Спектры поглощения, или абсорбционные наблюдаются при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары.
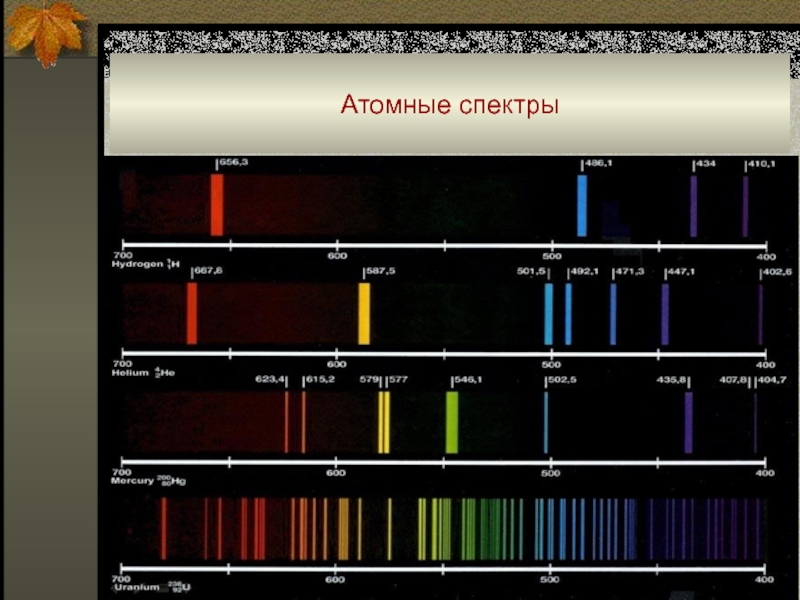
Слайд 33Эмиссионные и абсорбционные атомные спектры
Эмиссионный спектр атомарного водорода
Эмиссионный спектр
паров натрия
Абсорбционные линии в спектре солнца
Слайд 34Состояние электрона в атоме
■ Как известно, состояние электрона в атоме
описывается четырьмя квантовыми числами.
1. Главное квантовое число n (n
= 1 - 7 для атомов в основном состоянии) соответствует уровням, обозначаемым К, L, M, ... Q, и характеризует удаленность электрона от ядра.
2. Квантовое число орбитального углового момента l (l3. Орбитальное магнитное квантовое число ml (любое целое, удовлетворяющее условию - l < ml < +l).
Слайд 35Состояние электрона в атоме
■ 4. Спиновое квантовое число ms (ms
= ±1/2).
■ Электростатические взаимодействия электронов между собой приводят к
расщеплению уровня энергии на ряд подуровней – термов.
■ Величина 2S+1 называется мультиплетностью терма. Различают термы синглетные (спин равен 0), дублетные (спин равен 1/2), триплетные (спин равен 1) и т. д.
■ Спин-орбитальное взаимодействие электронов приводит к расщеплению уровня энергии с данными L и S на ряд близких компонент, отличающихся значениями полного электронного углового момента J (J = L ± S, принимает значения L+S, L+S-1, L+S-2, … L-S).
Слайд 36Состояние электрона в атоме
■ Полное обозначение терма имеет вид 2S+1LJ,
при этом состояния с L = 0, 1, 2, 3,
4, 5, ... обозначаются S, P, D, F, G, H, ... соответственно.
Разрешенными являются переходы, при которых ∆n = 0, ±1,…; ∆L = ±1; ∆J = 0, ±1.
Saunders Mac Lane
Russell Conwell Hoban)
Слайд 37Основные характеристики атомных спектров
Слайд 381
2
3
4
5
Е,эВ
4s
4d
4p
3p
3d
5p
5s
5d
6s
6p
40000
20000
3961,5
3941,1
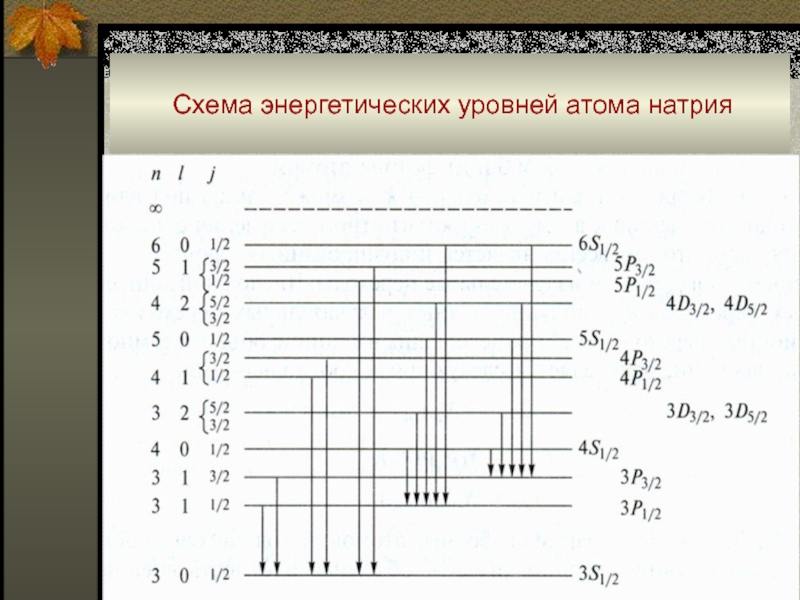
Слайд 39 Схема энергетических уровней атома натрия
Слайд 40Атомные спектры
Число всех электронных переходов и, следовательно, число линий в
спектре элемента определяется числом и размещением внешних электронов.
Спектры атомов
с малым числом валентных электронов (например, щелочные металлы) имеют относительно мало линий (в диапазоне 200 - 800 нм для водорода и щелочных металлов наблюдается менее 100 линий).
Атомы со сложно построенными внешними оболочками – особенно элементы побочных подгрупп периодической системы – дают спектры с очень большим числом линий (для алюминия – более 300, меди – около 500, железа – более 3000, урана – несколько десятков тысяч).
Слайд 42Атомные спектры
Линии, обусловленные переходом электрона на основной уровень, принято считать
резонансными.
Особое аналитическое значение имеют все резонансные линии, соответствующие переходам с
первого возбужденного уровня. Ввиду особой интенсивности этих линий, обеспечивающей большую чувствительность, их наиболее часто используют для аналитических целей.
Слайд 43Резонансные линии в атомных спектрах
Слайд 44Резонансные линии в атомных спектрах
Для возбуждения резонансных линий в спектрах
щелочных металлов необходима незначительная энергия, в то время как в
случае неметаллов эта энергия очень высока.
При этом резонансная линия закономерно смещается из видимой части спектра в экспериментально труднодоступную вакуумную ультрафиолетовую область с длинами волн менее 200 нм (например, Na 589,0–589,6 нм → Mg 285,0 нм → Si 251,6 нм → P 177,6 нм).
Таким образом, каждый элемент имеет свой индивидуальный спектр. По наличию в спектре образца характеристических для данного элемента линий можно провести качественный элементный анализ объекта.
Слайд 45Интенсивность спектральных линий
Интенсивность линии в спектрах испускания (Ie):
• Iе =
hvjiAjiNj, где h - постоянная Планка (6,62510-34 КДж•с); vji -
частота линии, отвечающая переходу j → i с испусканием; Aji - коэффициент Энштейна, определяющий вероятность перехода; Nj - заселенность возбужденного уровня с Ej (концентрация частиц в состоянии j).
■ Интенсивность линии в спектрах поглощения (Ia):
• Ia = hvijρ(vij)BijNi, где ρ(vij) - плотность поглощаемого излучения или энергия поглощаемых фотонов в единице объема (nhvij); Bij - коэффициент Энштейна, определяющий вероятность перехода; Ni - заселенность исходного уровня с Ei.
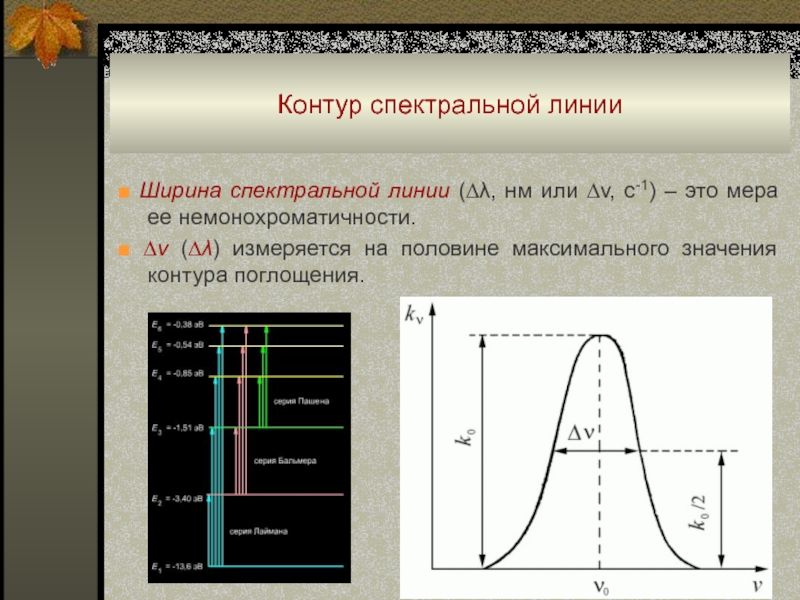
Слайд 46Контур спектральной линии
■ Ширина спектральной линии (∆λ, нм или ∆v,
с-1) – это мера ее немонохроматичности.
■ ∆v (∆λ) измеряется
на половине максимального значения контура поглощения.
Слайд 47Контур спектральной линии
■ В величину ∆v (∆λ) спектральных линий вносят
вклад, главным образом, три составляющие – естественная ширина и уширения,
обусловленные эффектами Лоренца и Доплера.
Слайд 48Уширение спектральных линий (естественное уширение)
■ Естественная ширина спектральной линии (∆λ,
∆v) определяется временем жизни возбужденного состояния (t):
■ Так, если время жизни возбужденного состояния (t) атомов составляет 10-8 с, то для резонансной линии λ0 = 500 нм:
λ2 0 1
∆λ = ———×———
C 2 πt
(500 × 10-9)2 1
∆λ = ——————×—————— = 1,33 × 10-5 нм
3 × 108 2π × 10-8
Слайд 49Уширение, обусловленное эффектом Допплера
Слайд 50Уширение, обусловленное эффектом Допплера
Слайд 51Уширение, обусловленное эффектом Допплера
Эффект Доплера легко наблюдать на практике, когда
мимо наблюдателя проезжает машина с включённой сиреной.
Когда машина не
движется относительно наблюдателя, тогда он слышит именно тот тон, который издаёт сирена.
Но если машина будет приближаться к наблюдателю, то частота звуковых волн увеличится (а длина уменьшится), и наблюдатель услышит более высокий тон, чем на самом деле издаёт сирена.
Слайд 52Уширение, обусловленное эффектом Допплера
А когда машина проедет дальше и будет
уже отдаляться, а не приближаться, то наблюдатель услышит более низкий
тон, вследствие меньшей частоты (и, соответственно, большей длины) звуковых волн.
Эффект был впервые описан Кристианом Доплером в 1842 году. Кристиан Доплер (нем. Christian Doppler; 29 ноября 1803, Зальцбург — 17 марта 1853, Венеция) — австрийский физик.
Слайд 53Уширение, обусловленное эффектом Допплера
Тепловое движение атомов носит хаотический характер, поэтому
у части атомов возникает составляющая скорости, направленная к наблюдателю, а
у другой части составляющая имеет противоположное направление.
В результате спектральная линия, являющаяся суперпозицией линий, испускаемых многими атомами, расширяется вследствие эффекта Доплера.
Чтобы оценить доплеровское уширение, нужно знать среднюю скорость атомов газа v, выделить среднюю скорость в направлении наблюдения и подставить ее в выражение для доплеровского сдвига.
Слайд 54Уширение, обусловленное эффектом Допплера
Уширение спектральных линий, обусловленное эффектом Доплера (∆λD),
значительно превышает естественную ширину и зависит от температуры атомного пара
(T), а также массы атома определяемого элемента (A).
Например, для линии натрия (АЭ = 23) с длиной волны 589,0 нм при температуре T = 2000 °K доплеровская ширина равна 3.95·10-3 нм, т. е. больше естественной ширины на два порядка.
∆λD = 7,2 × 10-7 λ 0√T/A
Слайд 55Уширение, обусловленное эффектом Лорентца
Реальные источники излучения представляют собой совокупность большого
числа атомов (молекул), взаимодействующих с окружающей средой и друг другом.
Это приводит к дополнительному уширению спектральных линий.
Итак, уширение спектральных линий, причиной которых является столкновения атомов, называется ударным (Лорентцевским уширением).
Ударное уширение спектральных линий зависит от давления, температуры атомного пара, а также диаметра и массы атома определяемого элемента.
Слайд 56Уширение, обусловленное эффектом Лорентца
2 1 1
∆vL = 2,602•1023•σ2•P√ ———(—— + ——), где
πRT A M
σ – сечение уширяющего столкновения; Р, М – давление и молекулярная масса плазмообразующего газа; А – атомная масса излучающего атома; Т – температура; R – универсальная газовая постоянная.
▀ Для линии натрия (АЭ = 23) с длиной волны 589,0 нм при температуре T = 2000 °K лорентцевская ширина имеет величину порядка 4·10-3 нм, т. е. больше естественной ширины на два порядка и близка к доплеровскому уширению.
Слайд 58Атомные и молекулярные орбитали
В общем случае молекула характеризуется совокупностью молекулярных
и атомных орбиталей.
Орбитали, обладающие одинаковой энергией, называются вырожденными.
Если в молекуле
все электроны спарены, а их спины антипараллельны, то такое состояние называют синглетным.
В том случае, если электроны в молекуле не спарены, а спины их параллельны, то такое состояние называют триплетным, квартетным и т. д.
По симметрии молекулярные орбитали делятся на σ (симметричны) и π (антисимметричны) относительно оси, связывающей ядра.
Слайд 62Молекулярные орбитали
Электроны в молекуле или ионе находятся на молекулярных орбиталях
- связывающих, несвязывающих, разрыхляющих.
Связывающими орбиталями (σсв, πсв) называют такие орбитали,
заселение которых электронами приводит к уменьшению электронной энергии системы (атома, молекулы, иона) и упрочнению соответствующих химических связей.
Разрыхляющими орбиталями (σ*, π*) называют такие орбитали, заселение которых электронами увеличивает электронную энергию и дестабилизирует (разрыхляет) систему.
Слайд 63Образование связывающих и разрыхляющих молекулярных орбиталей.
Слайд 64Образование связывающих и разрыхляющих молекулярных орбиталей.
Слайд 65Схематическая диаграмма связывающих разрыхляющих молекулярных орбиталей.
Слайд 66Структура атомных и молекулярных спектров
Слайд 67Правила отбора и типы электронных переходов в молекуле
Запрещены электронные переходы,
при которых происходит возбуждение более чем одного электрона.
2. Запрещены электронные
переходы между состояниями различной мультиплетности, например синглет-триплетный переход.
3. При наличии у молекулы центра симметрии запрещены переходы между термами с одной и той же электронной конфигурацией, например, переходы с одной d-орбитали на другие.
■ Наибольшая энергия требуется для переходов σ → σ*, поскольку σ - связи являются наиболее прочными. Указанные переходы характерны для насыщенных соединений и проявляются преимущественно в вакуумной УФ-области (< 170 нм). Такие соединения бесцветны.
Слайд 68Правила отбора и типы электронных переходов в молекуле
■ Переходы n
→ σ* наблюдаются у насыщенных молекул, содержащих гетероатомы со свободными
электронными парами (N, O, Cl и т.д.).
■ Поскольку энергия n - орбитали выше энергии σ - орбитали, полоса поглощения располагается в более длинноволновой области, чем полоса σ → σ* перехода обычно ~ 200 нм. У полос σ → σ* и n → σ* εmax достигает значений от сотни до нескольких тысяч относительных единиц.
■ В молекулах веществ с π – электронной системой связей могут быть возбуждены π → π* - переходы. Их энергия соответствует ближней УФ- и примыкающей к ней видимой части спектра.
Слайд 69Правила отбора и типы электронных переходов в молекуле
У сопряженных π
- электронных систем по мере удлинения цепи сопряжения возрастает длина
волны.
Для полос поглощения разрешенных π → π* - переходов εmax достигает значений 104 и выше, а запрещенных – от 100 до нескольких тысяч относительных единиц.
В ненасыщенных молекулах, содержащих гетероатомы, кроме π → π* - переходов возможны также n → π* - переходы. Полосы n → π* - переходов являются наиболее длинноволновыми.
Полосы поглощения n → π* - переходов характеризуются εmax от нескольких единиц до нескольких сотен. Низкая интенсивность этих полос объясняется тем, что n → π* - переходы запрещены по симметрии.
Слайд 70Области спектра электронных переходов различных типов
Слайд 71Характеристики светопоглощения некоторых хромофоров
Слайд 72Влияние структуры молекул типа C6H5(CH=CH)nC6H5 на спектры поглощения
Слайд 73Влияние структуры молекул конденсированных ароматических углеводородов на спектры поглощения
Слайд 74Электронные переходы в комплексных соединениях переходных металлов
В спектрах поглощения комплексов
переходных металлов наблюдается три типа полос, обусловленных электронными переходами, локализованными
преимущественно в лигандах, в центральном атоме-комплексообразователе и в координационных связях металл - лиганд.
■ Полосы первого типа. Электронные переходы в лигандах несколько изменяются при переходе от свободного (некоординированного) лиганда к связанному в комплекс. В соответствии с этим несколько изменяются характеристики полос поглощения лигандов.
■ Полосы второго типа. Окраска комплексов переходных металлов обусловлена d → d – переходами. d - оболочка атома переходного металла пятикратно вырождена, т.е. в ней имеются пять энергетически эквивалентных орбиталей.
Слайд 75Электронные переходы в комплексных соединениях переходных металлов
Полосы второго типа. В
комплексах под воздействием поля лигандов пятикратно вырожденные d - орбитали
расщепляются на группы с разными энергиями. Электронные переходы с одной группы орбиталей на другую могут осуществляться только с поглощением энергии.
Величина энергии расщепления определяет окраску комплекса. Энергия расщепления d - орбиталей ∆ зависит от природы лиганда и симметрии комплекса. В тетраэдрических комплексах орбитали dx2 и dx2-y2 (их принято обозначать еg) имеют более низкую энергию, а орбитали dxy, dxz, dyz (их принято обозначать t2g) – более высокую энергию.
Слайд 76Электронные переходы в комплексных соединениях переходных металлов
В октаэдрических комплексах наоборот
орбитали типа t2g более энергетичны чем еg.
У комплексов одного и
того же переходного металла величина ∆ тем больше, чем сильнее поле лигандов.
Сила поля лигандов убывает в ряду: CN- > NO2- > NH2CH2CH2NH2 > NH3 > SCN- > H2O > F- > CH3COO- > OH- > CI- > Br- > I-. Это ряд называют спектрохимическим рядом.
■ d → d – переходы запрещены правилами отбора. Причину их проявления объясняют частичным смешиванием d - и p - орбиталей.
■ εmax полос, отвечающих d → d – переходам составляет 1-100.
Слайд 77Расщепление энергетических уровней d – электронов в тетраэдрических (а) и
октаэдрических (б) комплексах
Слайд 78Электронные переходы в комплексных соединениях переходных металлов
■ Полосы третьего типа.
Кроме d → d – переходов в комплексах переходных металлов
наблюдаются переходы электронов с d - орбитали, локализованной на атоме металла, на орбитали, локализованные преимущественно на лигандах и наоборот. Такие электронные переходы вызывают появление полос с εmax 103 - 104, называемых полосами переноса заряда.
Вышеуказанное разделение на три типа полос весьма условно.
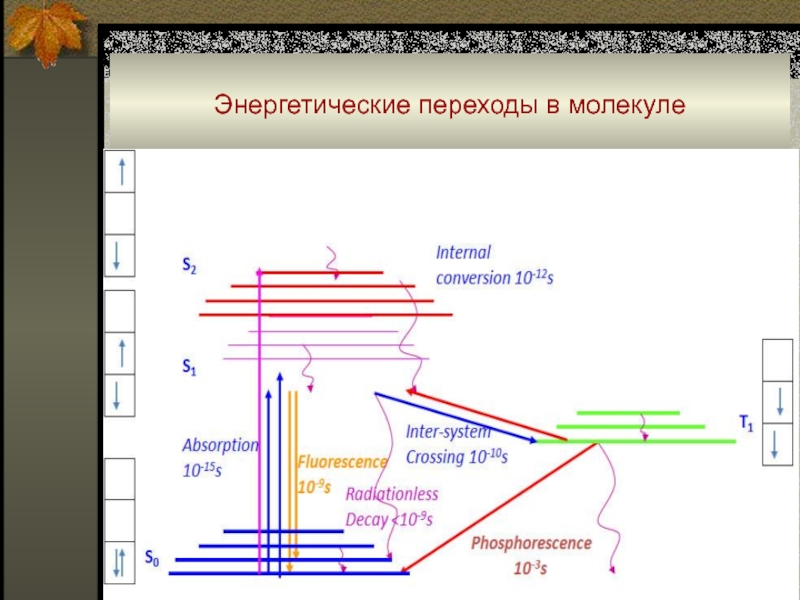
Слайд 79Энергетические переходы в молекуле
Слайд 80Энергетические переходы в молекуле
Слайд 81Энергетические переходы в молекуле
Слайд 82Энергетические переходы в молекуле
При комнатной температуре молекула обычно находится в
основном S0 синглетном состоянии.
При поглощении энергии молекула оказывается в
возбужденном электронном состоянии S2.
Далее практически мгновенно (~10-12с) в результате колебательной релаксации (КР) достигается невозбужденный колебательный уровень S2.
Далее также практически мгновенно (~10-11с) вследствие внутренней конверсии молекула перейдет в более низкое электронно-возбужденное состояние S1.
Переход S1 → S0 с испусканием фотона (10-6 - 10-9 с) – флуоресценция.
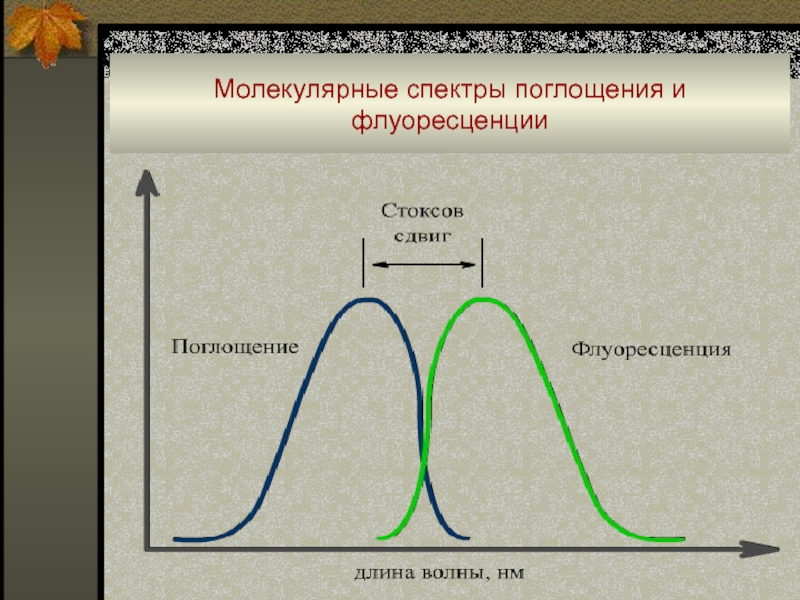
Слайд 83Молекулярные спектры поглощения и флуоресценции
Слайд 84Молекулярные спектры флуоресценции и фосфоресценции