Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спектры атомов Физическое материаловедение
Содержание
- 1. Спектры атомов Физическое материаловедение
- 2. Атомные спектры, получающиеся при испускании или поглощении
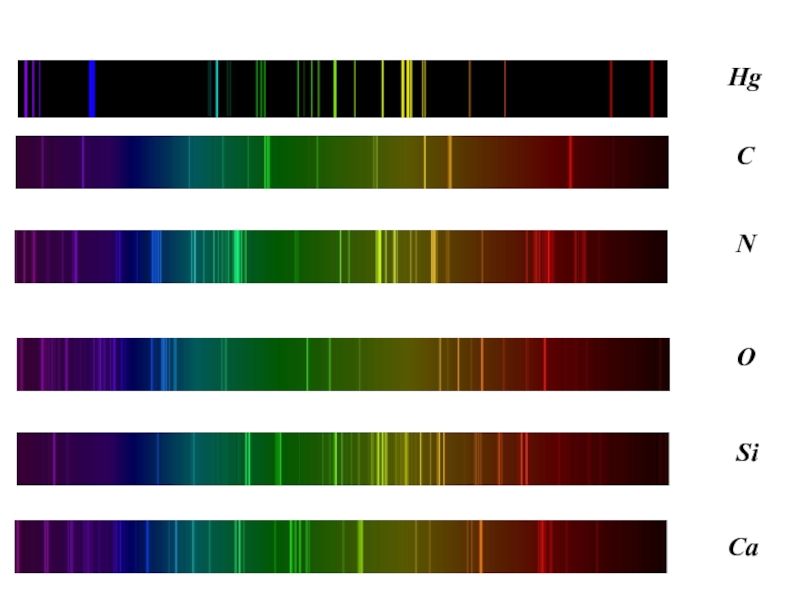
- 3. Примеры спектров излучения атомов
- 4. Слайд 4
- 5. Атомные спектры дают как нейтральные, так и
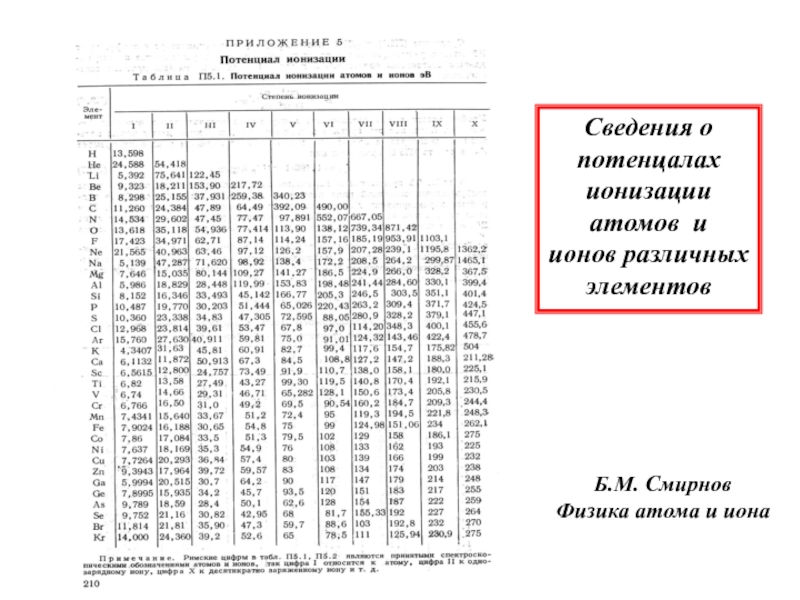
- 6. Сведения опотенцалахионизации атомов и ионов различныхэлементовБ.М. Смирнов Физика атома и иона
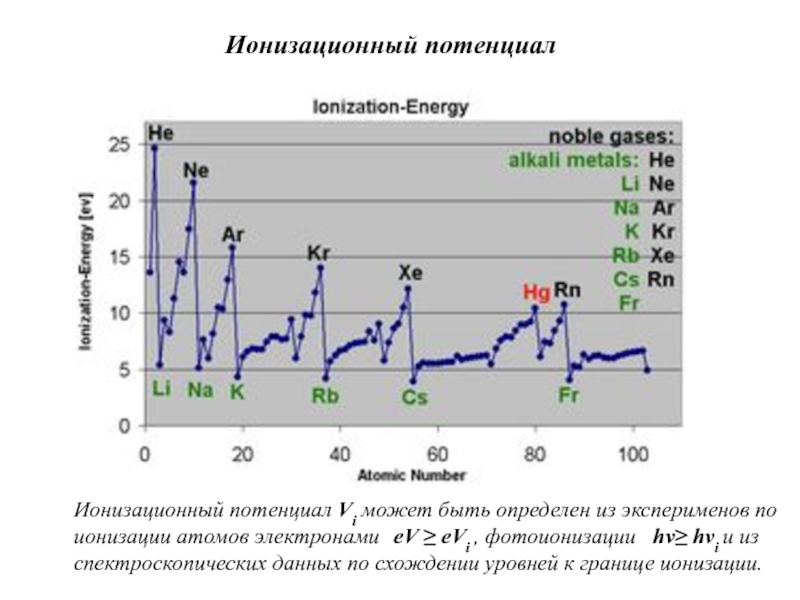
- 7. Ионизационный потенциалИонизационный потенциал Vi может быть определен
- 8. Периодичность химических, оптических, электрических и магнитных свойств
- 9. Пример изоэлектронного рядаO−2 F− Na+ Mg+2 Al+3Каждый
- 10. Уровни энергии и переходы:одноэлектронный атом H, He+,
- 11. Оценка энергии электрона
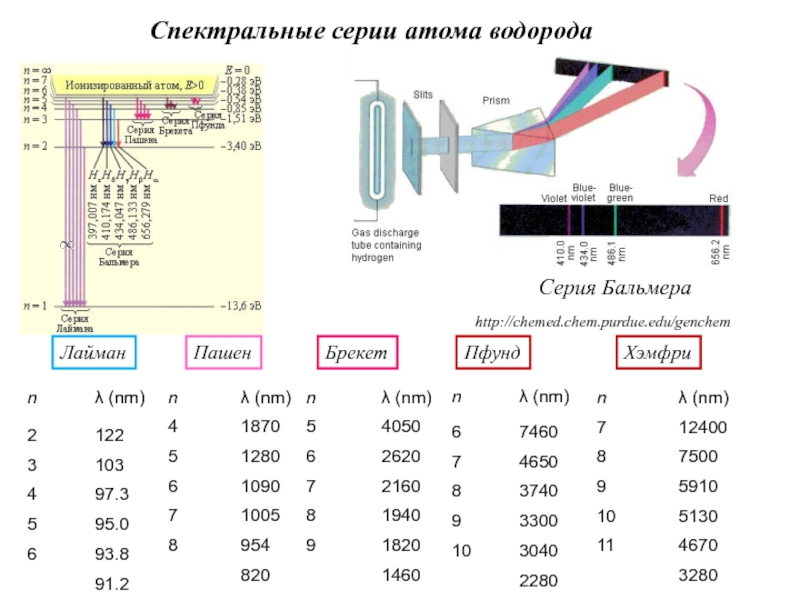
- 12. http://chemed.chem.purdue.edu/genchemСерия БальмераСпектральные серии атома водородаЛайманПашенБрекетПфундХэмфри
- 13. Линии атомных спектров образуют закономерные группы, которые
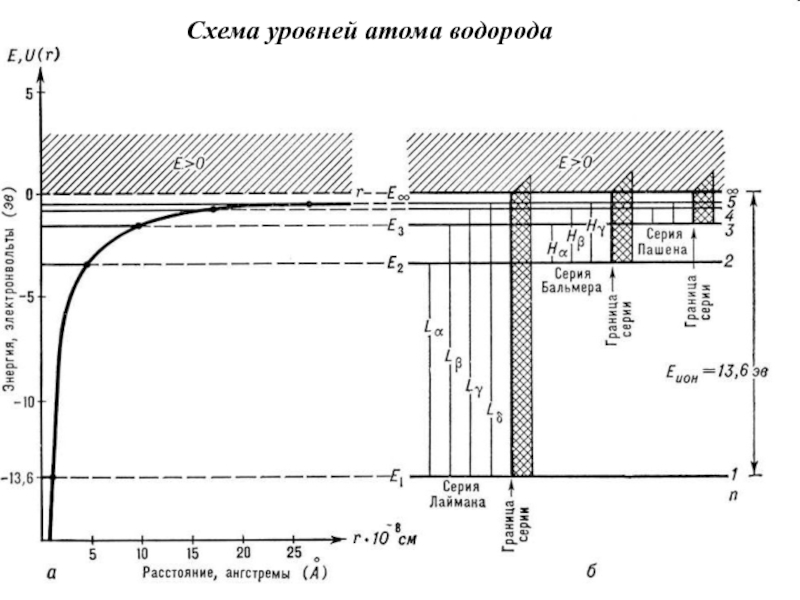
- 14. Схема уровней атома водорода
- 15. Атом водорода – диаграмма ГротрианаБ.М. Смирнов, Физика атома и иона, Энергоатомиздат, 1986
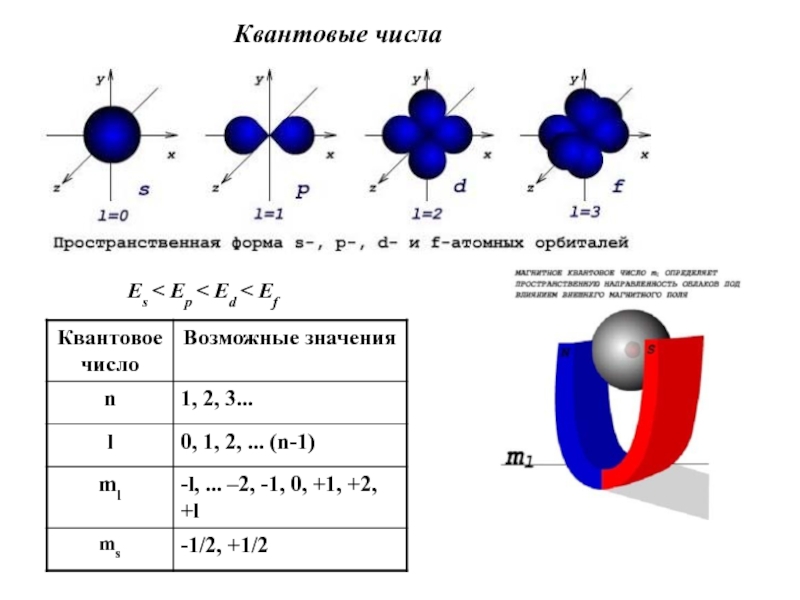
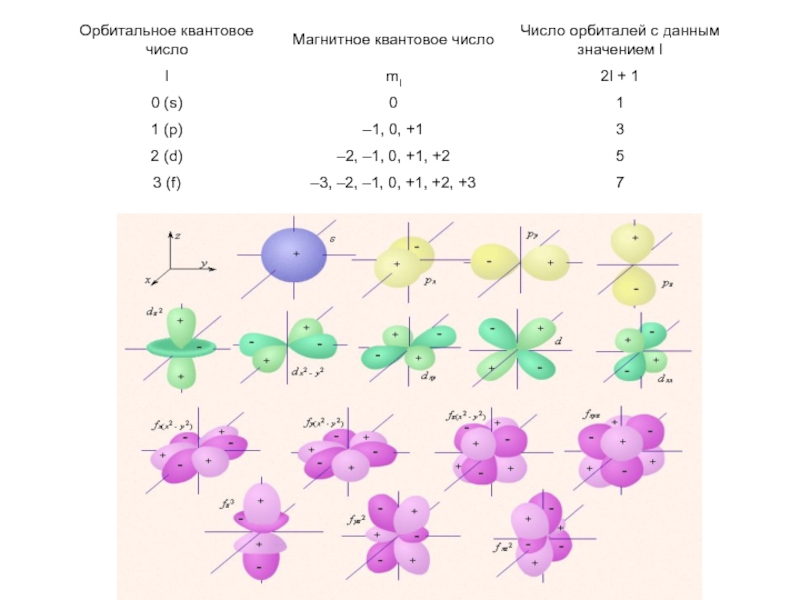
- 16. Понятие об электронных орбиталях
- 17. Es < Ep < Ed < Ef Квантовые числа
- 18. Слайд 18
- 19. Принципы заполнения атомных орбиталейПринцип минимума энергии:В атоме
- 20. Правило Хунда определяет порядок заполнения орбиталей определённого
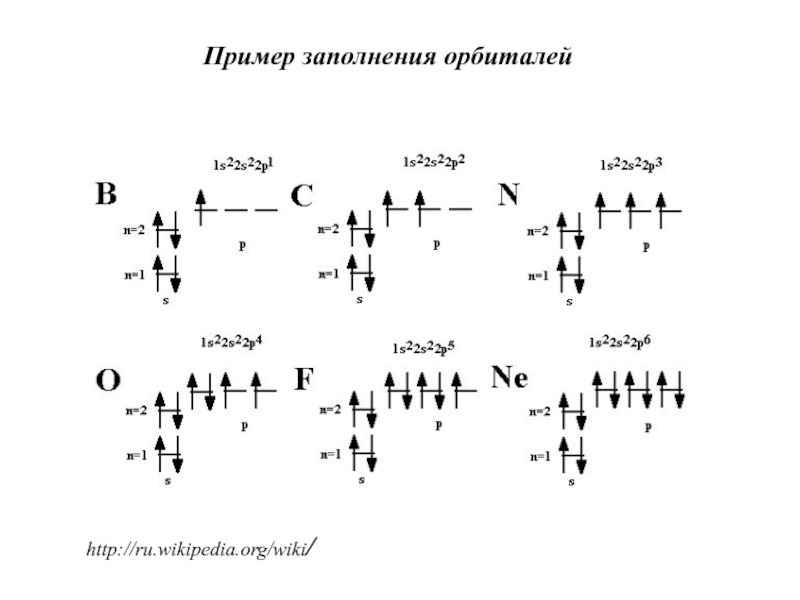
- 21. http://ru.wikipedia.org/wiki/Пример заполнения орбиталей
- 22. Заполнение электронных оболочек
- 23. Векторная схема атомовДля атомов, имеющих несколько валентных
- 24. Правила отбора Для главного квантового числа n
- 25. Схема уровней атома Li
- 26. Литература:С.Э. Фриш, Оптические спектры атомов, ФМ, Москва,
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Атомные спектры дают как нейтральные, так и ионизованные атомы; их
часто называют соответственно дуговыми и искровыми спектрами (нейтральные атомы легко
возбуждаются и дают спектры испускания в электрических дугах, а положительные ионы возбуждаются труднее и дают спектры испускания преимущественно в искровых электрических разрядах). Спектры ионизованных атомов смещены по отношению к спектрам нейтральных атомов в область больших частот, т. е. в ультрафиолетовую область. Это смещение тем больше, чем выше кратность ионизации атома — чем больше электронов он потерял. Спектры нейтрального атома и его последовательных ионов обозначают в спектроскопии цифрами I, II, III, ... В реально наблюдаемых спектрах часто присутствуют одновременно линии нейтрального и ионизованных атомов; так говорят, например, о линиях FeI, FeII, FeIII в спектре железа, соответствующих Fe, Fe+, Fe2+.Слайд 6Сведения о
потенцалах
ионизации
атомов и
ионов различных
элементов
Б.М. Смирнов
Физика атома и
иона
Слайд 7Ионизационный потенциал
Ионизационный потенциал Vi может быть определен из эксперименов по
ионизации
атомов электронами eV ≥ eVi , фотоионизации hν≥ hνi и
изспектроскопических данных по схождении уровней к границе ионизации.
Слайд 8Периодичность химических, оптических, электрических и магнитных свойств атомов различных элементов
в зависимости от Z связана со сходным строением внешних электронных
оболочек, определяющим эти свойства. Эта периодичность сохраняется и для ионов: теряя один электрон, атом становится подобен по ряду свойств атомам предыдущей группы элементов (например, однократно ионизованные щелочноземельные атомы - атомам щелочных металлов). Сходными свойствами обладают члены изоэлектронного ряда.Изоэлектронные ряды
Слайд 9Пример изоэлектронного ряда
O−2 F− Na+ Mg+2 Al+3
Каждый член этого ряда
имеет 10 электронов и одинаковую электронную конфигурацию (как атом Ne:
1s22s22p6)Заряд ядра возрастает→
Атомный радиус уменьшается→
Слайд 10Уровни энергии и переходы:
одноэлектронный атом
H, He+, Li++
Постулаты Бора:
Движущийся
вокруг ядра электрон излучает энергию только при переходе системы между
стационарными состояниями.Динамическое равновесие системы в стационарных состоя-ниях подчиняется обычным законам механики, тогда как для описания переходов они неприменимы.
Излучение, испускаемое при переходах системы из одного стационарного состояния в другое, монохроматично. E = h
Нобелевская премия
1922 г.
Слайд 12http://chemed.chem.purdue.edu/genchem
Серия Бальмера
Спектральные серии атома водорода
Лайман
Пашен
Брекет
Пфунд
Хэмфри
Слайд 13Линии атомных спектров образуют закономерные группы, которые называются спектральными сериями.
Промежутки между линиями в серии убывают в сторону коротких длин
волн, и линии сходятся к границе серии, т.е. к границе ионизации, соответствующей отрыву электрона. Выше границы ионизации лежит непрерывный энергетический спектр. Наиболее прост спектр атома водорода.Спектральные серии
Схема уровней энергии водородоподобных ионов He+, Li2+… отличается от схемы уровней атома H только увеличением масштаба в Z2 раз.
Уровни различных элементов:
http://physics.nist.gov/cgi-bin/ASD/levels_pt.pl
Слайд 19Принципы заполнения атомных орбиталей
Принцип минимума энергии:
В атоме не может быть
двух электронов с одинаковым набором значений всех четырех квантовых чисел.
Принцип Паули:
Электроны заполняют орбитали в порядке увеличения их энергии:
на орбиталях с большей энергией электроны располагаются после
того, как заполнены орбитали с меньшей энергией.
Слайд 20Правило Хунда определяет порядок заполнения орбиталей определённого подслоя : модуль
суммарного значения ms подслоя должен быть максимальным. Это означает, что
все свободные орбитали подслоя заполняются сначала по одному электрону, а потом только на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако. В результате, суммарный спин орбитали становится равным нулю.Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия –
мультиплетность максимальна,
при совпадении мультиплетностей суммарный орбитальный момент L максимален.
Правило Хунда
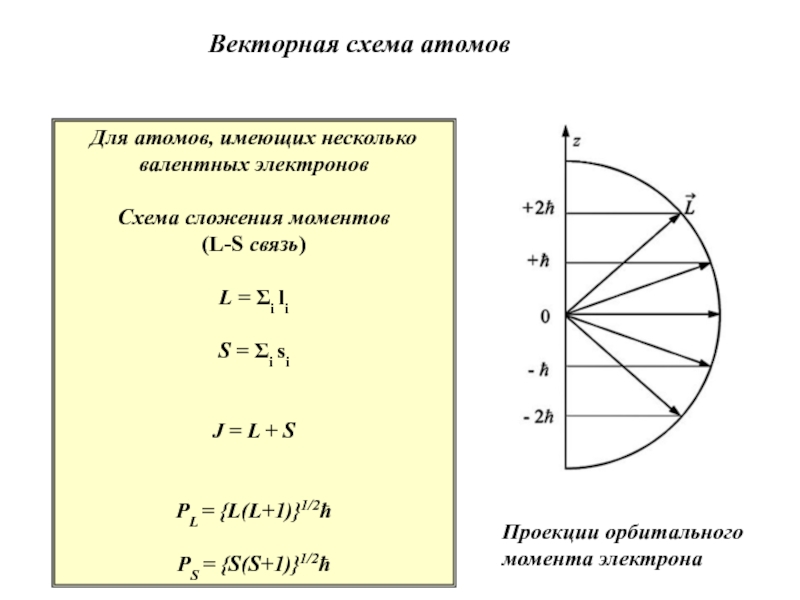
Слайд 23Векторная схема атомов
Для атомов, имеющих несколько
валентных электронов
Схема сложения моментов
(L-S связь)
L = i li
S = i si
J = L
+ SPL = {L(L+1)}1/2ħ
PS = {S(S+1)}1/2ħ
PJ = {J(J+1)}1/2ħ
Проекции орбитального момента электрона
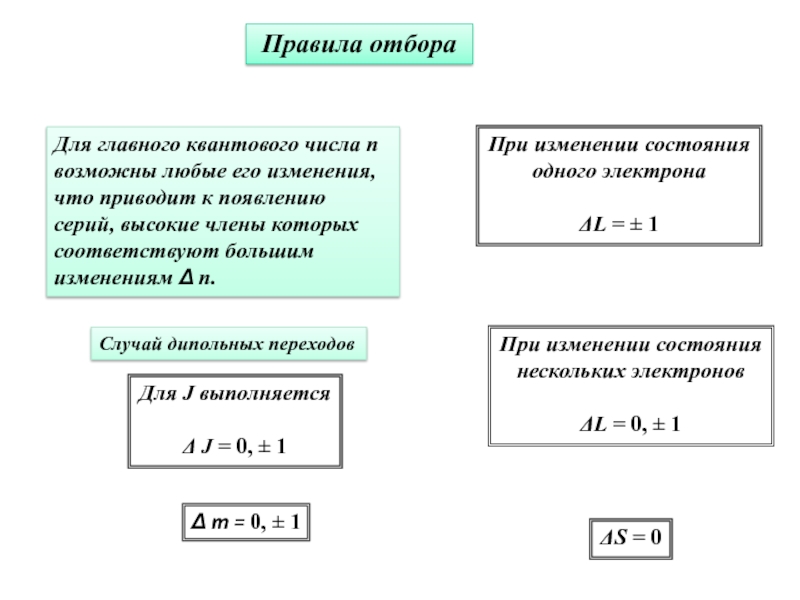
Слайд 24Правила отбора
Для главного квантового числа n возможны любые его
изменения, что приводит к появлению серий, высокие члены которых соответствуют
большим изменениям Δ n.Случай дипольных переходов
Δ m = 0, 1
Слайд 26Литература:
С.Э. Фриш, Оптические спектры атомов, ФМ, Москва, 1963.
М.А. Ельяшевич, Атомная
и молекулярная спектроскопия,
ФМ, Москва, 1963.
Б.М. Смирнов, Физика атома и
иона, Энргоатомиздат, 1986.А.А. Бабушкин, П.А. Бажулин, Ф.А. Королев, Л.В. Левшин,
В.К. Прокофьев, А.Р. Стриганов, Методы спектрального
анализа, Изд. Московского университета, 1962.