Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
СТРОЕНИЕ АЛКАНОВ. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. ПОЛУЧЕНИЕ АЛКАНОВ
Содержание
- 1. СТРОЕНИЕ АЛКАНОВ. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. ПОЛУЧЕНИЕ АЛКАНОВ
- 2. Изучение органической химии начинают с класса углеводородов.
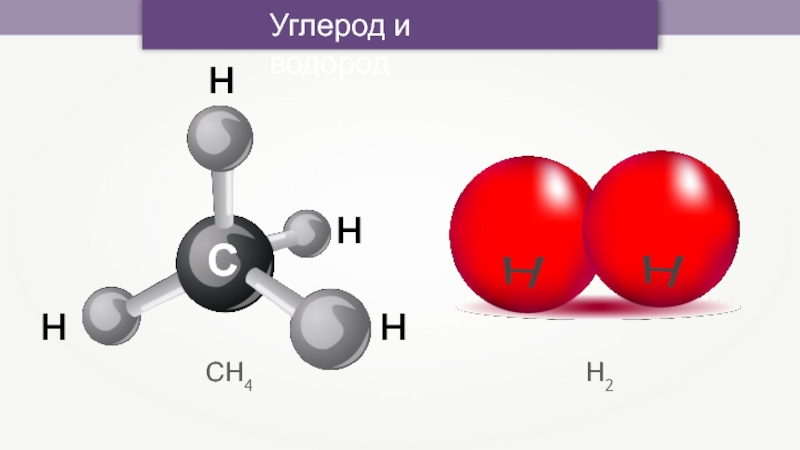
- 3. Углерод и водородСН4Н2СHHHH
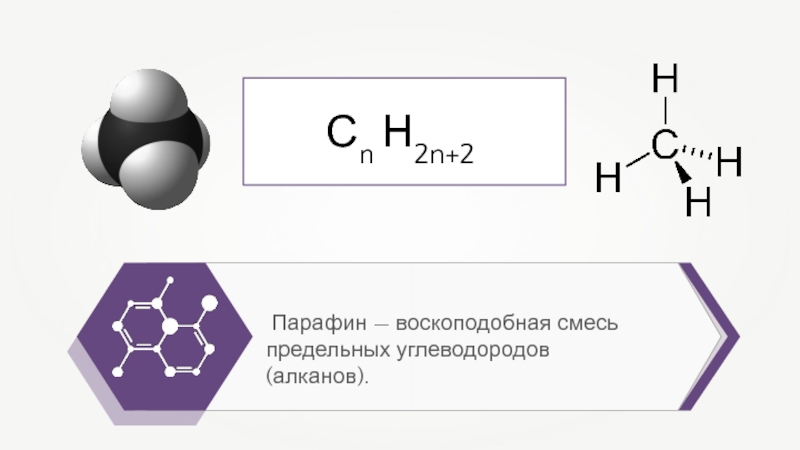
- 4. Алканы — это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями.Сn Н2n+2
- 5. Молекулы алканов имеют самое большое число водородов
- 6. С такой структурой молекула не способна к реакциям присоединения.
- 7. Парафин — воскоподобная смесь предельных углеводородов (алканов). Сn Н2n+2
- 8. Парафины — исторически сложившееся название, которое отражает свойства этих соединений.
- 9. Парафины
- 10. Предельные или насыщенные углеводороды — это органические
- 11. Основное правило в органической химии: углерод в
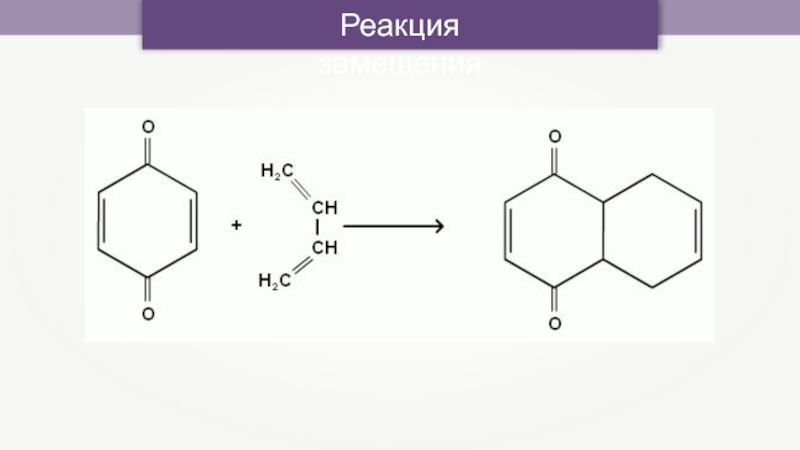
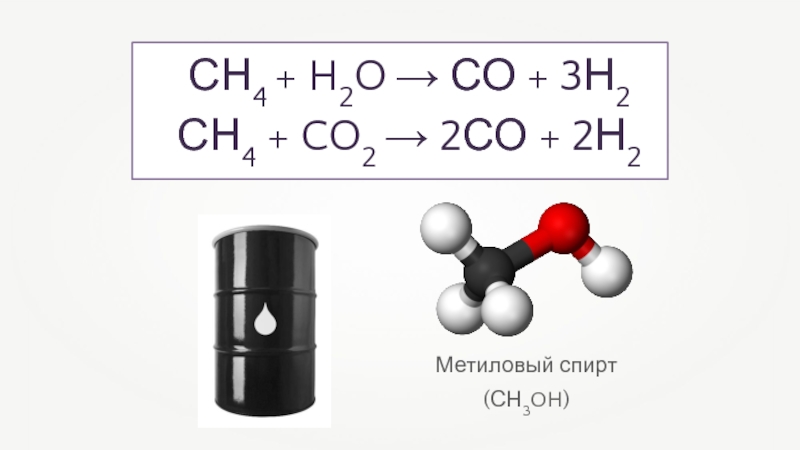
- 12. Реакция замещения
- 13. АлканСлово «алкан» того же происхождения, что и «алкоголь». По-арабски al-kohl —порошок, пудра, пыль.
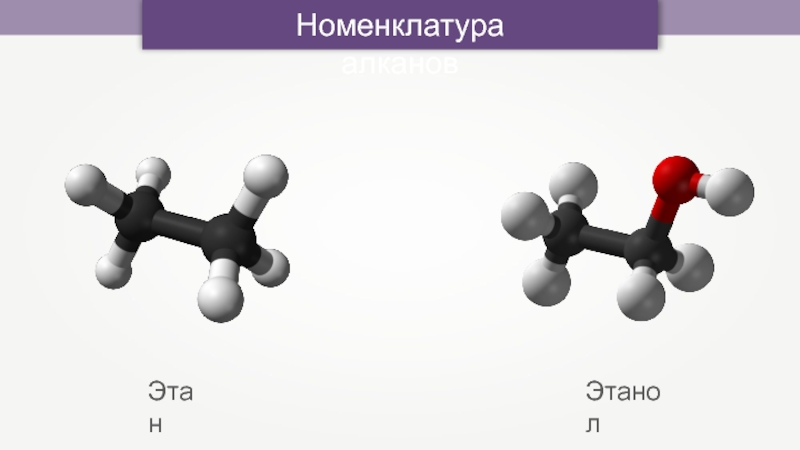
- 14. Номенклатура алканов
- 15. Cпирты и кислоты были известны задолго до
- 16. Номенклатура алкановЭтанЭтанол
- 17. Алкан с самыми длинными молекулами был синтезирован английскими химиками в 1985 г.С390 Н782Нонаконтатриктан
- 18. В гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метильную группу СН2.СН2
- 19. Корень «мет» в химии обозначает группировку, содержащую один атом углерода. СН4С2Н6С3Н8С4Н10С5Н12С6Н14С7Н16С8Н18МетанЭтанПропанБутанПентанГексанГептанОктан
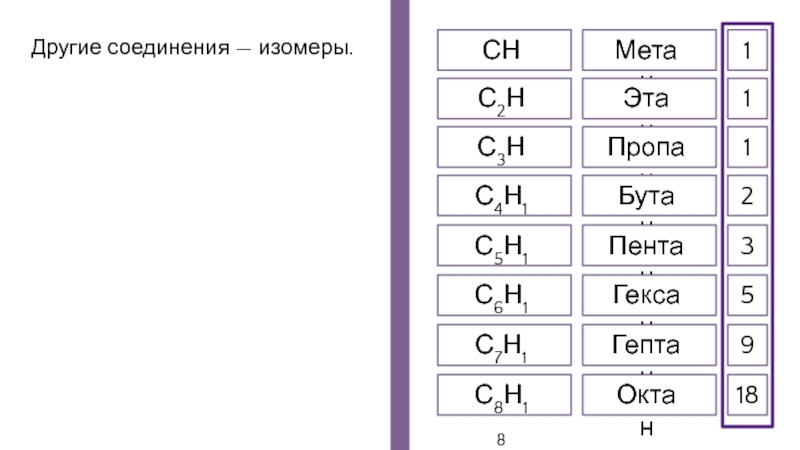
- 20. Другие соединения — изомеры.СН4С2Н6С3Н8С4Н10С5Н12С6Н14С7Н16С8Н18МетанЭтанПропанБутанПентанГексанГептанОктан111235918
- 21. А. Кэли1821–1895 гг. Один из основоположников важного
- 22. Число структурных изомеров предельных углеводородов представляет практический
- 23. ДеканАлканы
- 24. АлканыОктан
- 25. Простейшим представителем насыщенных углеводородов является метан. Это
- 26. Слайд 26
- 27. Метан — болотный газ, рудниковый газ.
- 28. Смесь метана с воздухом взрывоопасна.
- 29. АлканыМетанЭтанПропанБутан
- 30. Кроме метана в природном и попутном газе
- 31. Алканы — химически наименее активные органические соединения.
- 32. Алканам присущи реакции замещения.
- 33. В реакции присоединения они не вступают, по той причине, что им не куда присоединять радикалы.
- 34. При комнатной температуре алканы не вступают в реакции даже с активными веществами.Бром (Br2)CalveroПерманганат калия (KMnO4)FischX
- 35. Оксид углерода (CO2)Вода(H2O)С5Н12 + 8О2 → 5СО2 + 6Н2О2С8Н18 + 17О2 → 16СО2 + 18Н2О
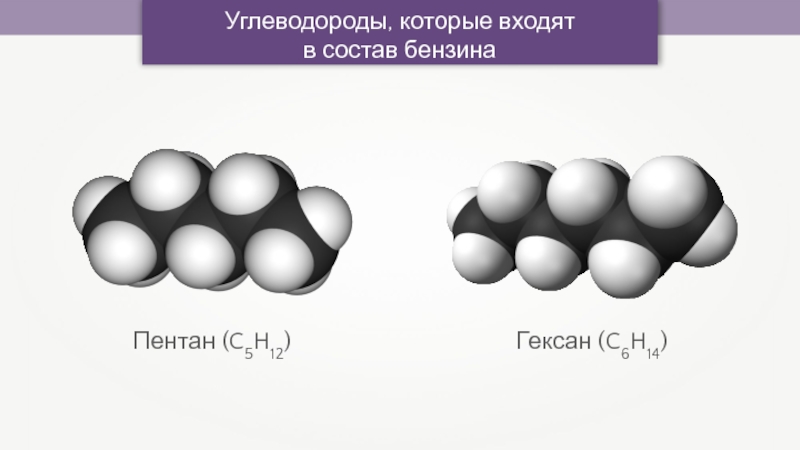
- 36. Гексан (C6H14)Пентан (C5H12)Углеводороды, которые входят в состав бензина
- 37. Когда недостаточно кислорода, может происходить неполное сгорание, в результате чего образуется угарный газ.
- 38. При неполном сгорании метана образуется сажа.
- 39. Катализаторы — это вещества, которые ускоряют химический
- 40. Метиловый спирт (СН3OH)Формальдегид(CH2O)
- 41. СН4 → С + 2H2 (1000°)2СН4 → C2H2 + 3Н2 (1500°)
- 42. АцетиленC2H2
- 43. Смесь углеводорода с воздухом при воспламенении небезопасна.
- 44. Метиловый спирт (СН3OH)СН4 + H2O → СО + 3Н2СН4 + CO2 → 2СО + 2Н2
- 45. Галогенирование — это одна из реакций замещения. Галогены
- 46. Стадии реакции замещения
- 47. Инициирование цепи — зарождение цепи, образование свободных
- 48. Продолжение цепи (развитие цепи) — это цепь
- 49. Обрыв цепи — объединение активных радикалов в
- 50. Реакции хлорирования метана СН4 + Cl2 →
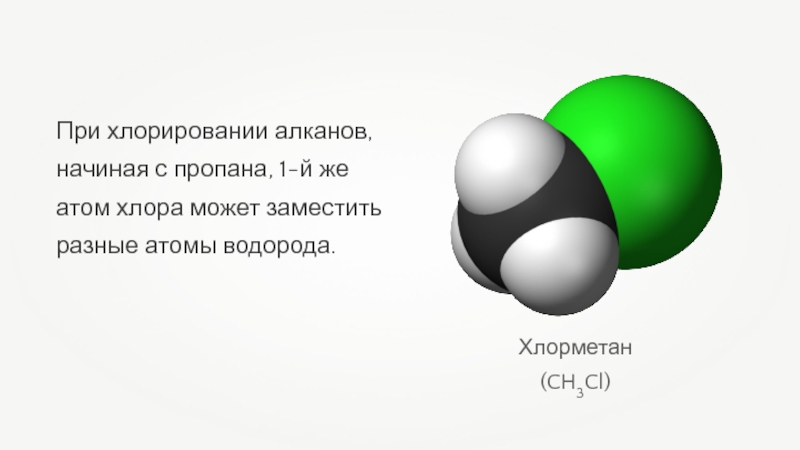
- 51. При хлорировании алканов, начиная с пропана, 1-й
- 52. Первичные связи С—Н, как правило, прочнее вторичных, а вторичные прочнее третичных.
- 53. Н.Н. Семёнов 1896–1986 гг. В разработке этих цепных
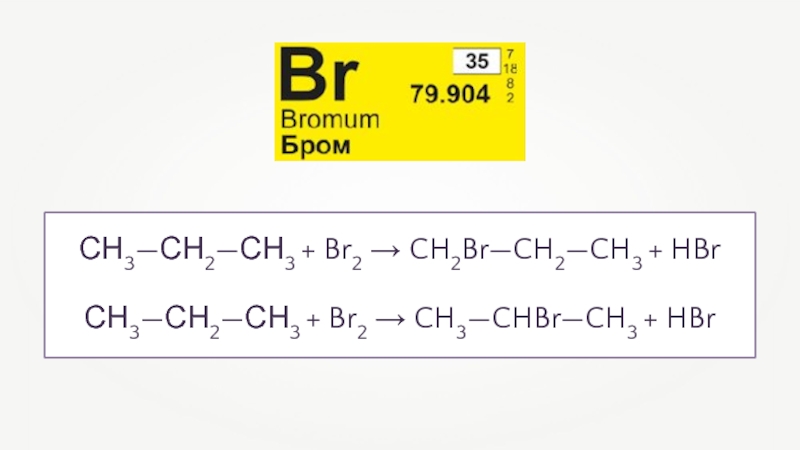
- 54. СН3—СН2—СН3 + Br2 → CH2Br—CH2—CH3 + HBrСН3—СН2—СН3 + Br2 → CH3—CHBr—CH3 + HBr
- 55. RН + I2 → RI + HI (эндотермическая)RI + HI → RН + I2 (экзотермическая)
- 56. При йодировании алканов образуются и непредельные соединения.
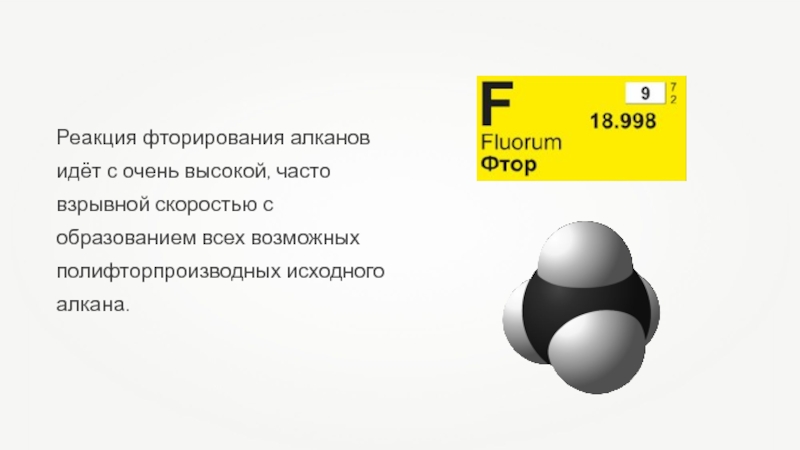
- 57. Реакция фторирования алканов идёт с очень высокой,
- 58. М.И. Коновалов 1858–1906 гг. Нитрование алканов (реакция Коновалова)
- 59. Реакцию проводят в растворе при температуре выше
- 60. К химическим свойствам алканов следует отнести также их термическое разложение.
- 61. Крекинг — процессы термического разложения, протекающие при
- 62. Реакции, свойственные насыщенным углеводородам:– окисление;– замещение;– взаимодействие с водяным паром;– крекинг.
- 63. Физические свойства предельных углеводородовС1–С4С5–С15С16 и далее
- 64. Бензол(C₆H₆)Все алканы легче воды, в ней не
- 65. Скачать презентанцию
Изучение органической химии начинают с класса углеводородов.
Слайды и текст этой презентации
Слайд 4Алканы — это предельные углеводороды, в молекулах которых все атомы
связаны одинарными связями.
Слайд 5Молекулы алканов имеют самое большое число водородов
и содержат только
одинарные (простые) связи между атомами углерода и водорода.
Слайд 10Предельные или насыщенные углеводороды — это органические соединения с полным
насыщением углеводородной цепи атомами водорода.
СН4
С2Н6
С3Н8
Слайд 11Основное правило в органической химии: углерод в органической химии всегда
четырёхвалентен.
Это значит, что возле каждого атома углерода в структурной формуле
должны находиться 4 связи.Структурная формула
Слайд 13Алкан
Слово «алкан» того же происхождения, что и «алкоголь».
По-арабски al-kohl
—порошок, пудра, пыль.
Слайд 15Cпирты и кислоты были известны задолго до открытия соответствующих алканов.
Примером может служить этиловый спирт и этан, который был получен
лишь в 1848 г.Слайд 17Алкан с самыми длинными молекулами был синтезирован английскими химиками в
1985 г.
С390 Н782
Нонаконтатриктан
Слайд 18В гомологическом ряду алканов каждый последующий член отличается от предыдущего
на одну метильную группу СН2.
СН2
Слайд 19Корень «мет» в химии обозначает группировку, содержащую один атом углерода.
СН4
С2Н6
С3Н8
С4Н10
С5Н12
С6Н14
С7Н16
С8Н18
Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Слайд 20Другие соединения — изомеры.
СН4
С2Н6
С3Н8
С4Н10
С5Н12
С6Н14
С7Н16
С8Н18
Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
1
1
1
2
3
5
9
18
Слайд 21А. Кэли
1821–1895 гг.
Один из основоположников важного раздела математики —
топологии.
В 1879 г. он опубликовал первую статью по знаменитой
«проблеме четырёх цветов»: достаточно ли их для раскраски любой географической карты. Слайд 22Число структурных изомеров предельных углеводородов представляет практический интерес только для
первых членов ряда.
Для алкана, содержащего
полтора десятка атомов углерода,
подавляющее число изомеров не получено и вряд ли будет
когда-либо синтезировано.
Слайд 25Простейшим представителем насыщенных углеводородов является метан. Это бесцветный газ, который
не имеет запаха
и почти не растворяется в воде.
Метан
Слайд 30Кроме метана в природном
и попутном газе находятся этан, пропан,
бутан, которые являются насыщенными углеродами.
Они также, как и метан,
имеют широкое применение и поэтому хорошо известны всем. Слайд 33В реакции присоединения они не вступают, по той причине,
что
им не куда присоединять радикалы.
Слайд 34При комнатной температуре алканы не вступают в реакции даже с
активными веществами.
Бром (Br2)
Calvero
Перманганат калия (KMnO4)
FischX
Слайд 37Когда недостаточно кислорода, может происходить неполное сгорание, в результате чего
образуется угарный газ.
Слайд 39Катализаторы — это вещества, которые ускоряют химический процесс, но при
этом не испытывают превращений в ходе реакции.
Слайд 47Инициирование цепи — зарождение цепи, образование свободных радикалов под воздействием
каких-либо условий.
Сl꞉Сl → Сl∙ + Сl∙
CH4 + Сl∙ → CH3∙
+ HСlСлайд 48Продолжение цепи (развитие цепи) —
это цепь последовательных взаимодействий свободных
радикалов и неактивных молекул,
в результате которых образуются новые радикалы
и новые молекулы.Сl꞉Сl → Сl∙ + Сl∙
CH4 + Сl∙ → CH3∙ + HСl
CH3∙ + Сl2 → CH3Cl + Сl∙
Слайд 49Обрыв цепи — объединение активных радикалов в неактивные молекулы.
Сl꞉Сl →
Сl∙ + Сl∙
CH4 + Сl∙ → CH3∙ + HСl
CH3∙ +
Сl2 → CH3Cl + Сl∙CH3∙ + Сl∙ → CH3Cl
Сl∙ + Сl∙ → Cl2
CH3∙ + CH3∙ → CH3—CH3
Слайд 50Реакции хлорирования метана
СН4 + Cl2 → CH3Cl + НCl
Метилхлорид
СН3Cl
+ Cl2 → CH2Cl2 + НCl
Метиленхлорид
СН2Cl2 + Cl2 → CHCl3
+ НClТрихлорметан
СНCl3 + Cl2 → CCl4 + НCl
Тетрахлорид
























































![Звуковая история Автоматизация звука [С] в прямом слоге и со стечением согласных](/img/tmb/7/638822/5f88ff8b5e1adadb4ef4610c87406b5e-800x.jpg)











