Слайд 1Строение атома. Периодический закон и Периодическая система элементов Д.И.Менделеева
Быть
может, эти электроны-
Миры, где пять материков,
Искусства, званья, войны, троны
И память
сорока веков.
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там всё, что здесь, в объёме сжатом,
Но также то, чего здесь нет.
В. Брюсов «Мир электрона»
Слайд 3Современная модель строения атома
В основе современной теории строения атома
лежат работы:
Дж. Томсона (который в 1897 г. открыл электрон,
а в 1904 г. предложил модель строения атома, согласно которой атом – это заряженная сфера с вкрапленными электронами (модель «кекс с изюмом»)),
Э. Резерфорда (который в 1910 г. открыл ядро и предложил ядерную планетарную модель атома), Однако, планетарная модель строения атома противоречит классической электродинамике, т.к. электрон, вращающийся вокруг ядра, должен непрерывно излучать энергию, в результате чего он за очень короткий промежуток времени (с) упадет на ядро, и атом прекратит свое существование.
Недостатки модели Резерфорда были устранены Н. Бором, который, дополнив ее новыми постулатами, представил динамическую модель строения атома водорода.
Н. Бора (который в 1910 г. предложил динамическую модель строения атома водорода), В основу своей теории Н. Бор положил следующие постулаты:
Слайд 41) В изолированном атоме существуют орбиты, двигаясь по которым, электрон
не излучает энергию. Такие орбиты называются стационарными характеризуются энергией находящегося
на них электрона Еn, где n – номер орбиты.
2) Излучение происходит только при перемещении электрона с одной стационарной орбиты на другую.
Слайд 5М. Планка (который в 1900 г. высказал предложение, что вещества
поглощают и пропускают энергию дискретными пропорциями, названными им квантами),
А.
Эйнштейна (который в 1905 г предсказал, что любое излучение представляет собой поток квантов энергии, назваными им фотонами),
Луи де Бройля (который в 1924 г. выдвинул предложение, что электрон характеризуется также корпускулярно-волновым дуализмом),
Вернера Гейзенберга (который в 1927 г. постулировал принцип неопределенности),
Эрвина Шредингера (который в 1926 г. вывел математическое описание поведения электрона в атоме) и многих других. Работы этих ученых заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
Слайд 6Современная модель строения атома базируется на четырех положениях:
1. В центре
атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри
атома (например, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5.10-7 нм).
2. Положительный заряд и почти вся масса атома сосредоточены в ядре атома.
3. Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу.
4. Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра.
Слайд 7Различные виды атомов имеют общее название – нуклиды.
Нуклиды с
одинаковым зарядом, различными массовыми числами и числом нейтронов в ядре
называется изотопами.
Нуклиды с одинаковыми массовыми числами, но различными зарядами ядра и числа нейтронов в ядре называются изобарами (40Ar, 40K, 40Ca).
Нуклиды с одинаковым числом нейтронов, но различным зарядом и массовым числом называется изотонами (нуклиды 157N и 146C, имеющие по 8 нейтронов).
Слайд 8Корпускулярно-волновой дуализм
В соответствии с представлениями квантовой механики, электрон обладает двойственной
природой, т.е. корпускулярно-волновым дуализмом: с одной стороны электрон – это
частица, которая имеет массу, заряд и скорость движения; а с другой стороны электрон проявляет волновые свойства, такие как способность к дифракции, интерференции и особенности движения.
Длина волны определяется в соответствии с соотношением Де Бройля:
λ = h / (m υ)
λ – длина волны в см (м);
h – постоянная Планка
m – масса частицы в г (кг);
υ – скорость частицы в см/с (м/с).
Гипотеза де Бройля получила экспериментальное подтверждение для малых частиц (электронов, нейтронов).
Слайд 9Согласно принципу неопределенности В. Гейзенберга невозможно одновременно с одинаково большой
точностью указать положение частицы и ее импульс, поэтому в квантово-механической
модели атома используют вероятностный подход для характеристики положения электрона.
Вероятность нахождения электрона в определенной области пространства описывается квадратом волновой функции Ψ2 (пси), которая характеризует амплитуду волны, как функцию координат электрона. Электрон может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Слайд 10Уравнение Шредингера
Исходя из утверждения о наличии у электрона волновых свойств,
австрийский физик Э. Шредингер предположил, что состояние электрона в атоме
должно описываться известным в физике уравнением стоячей электромагнитной волны. (Стоячей волной называется электромагнитная волна, расположенная в одной плоскости).
Подставив в уравнение стоячей волны значения по де Бройлю , Э. Шредингер получил новое уравнение, связывающее энергию электрона с пространственными координатами и волновой функцией (ψ).
Слайд 11Уравнение Шредингера представляет собой дифференциальное уравнение в частных производных:
где: ð2-
дифференциальный оператор, представляющий собой сумму вторых частных производных по соответствующим
координатам, m - масса покоя электрона, E - полная энергия электрона, U= e2/r - потенциальная энергия электрона.
Слайд 12Так как потенциальная функция электрона в атоме водорода имеет вид
где e — заряд электрона (и протона), r — радиус-вектор, то
уравнение Шрёдингера запишется следующим образом:
Здесь ψ — волновая функция электрона в системе отсчёта протона, m — масса электрона,
Слайд 13постоянная Планка:
h = 6.62·10-34 Дж·с.
ћ = h/2π = 1.05·10-34 Дж·с
E — полная энергия электрона,
оператор Лапласа:
Слайд 14Орбиталь
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика,
называется орбиталью.
Вероятность нахождения электрона внутри данной области пространства составляет не
менее 95 %.
Слайд 15Квантовые числа
Главное квантовое число (n) определяет энергию и размеры электронных
орбиталей, удаленность уровня от ядра. Принимает целые значения (n =
1, 2, 3... до +) и соответствует номеру периода.
Число n показывает, сколько подуровней имеет каждый уровень, и какой энергетический уровень является внешним. Чем больше n, тем выше энергия. Оболочки (уровни) имеют буквенные обозначения
n = 1 2 3 4 5 6 7
K L M N O P Q
Слайд 16Физический смысл n
Определяет Энергию электрона на уровне
Е=-13,6 z2/n2, где
n- глав. кв. число,
Z – заряд ядра.
Е – энергия
электрона на эн. Уровне, эВ.
Слайд 17Орбитальное квантовое число
Орбитальное (побочное или азимутальное ()) квантовое число определяет
форму атомной орбитали и характеризует энергетические подуровни.
Величина принимает
целочисленные значения от 0 до (n – 1) и может обозначаться буквами.
Подуровень s р d f g
Орбитальное квантовое число = 0 1 2 3 4
Каждому значению соответствует орбиталь особой формы, например s-орбиталь имеет сферическую форму, р-орбиталь – гантель.
В одной и той же оболочке энергия подуровней возрастает в ряду Es < Ep < Ed < Ef < Eg. В первой оболочке (n = 1) может быть одна s-; во второй (n = 2) две s- и р-, в третьей (n = 3) s-, р- и d-, в четвертой (n = 4) s-, р-, d- и f- подоболочки и т. д.
Слайд 18О Р Б И Т А Л И
Орбитали могут иметь
разную форму.
Так, каждый новый энергетический уровень в атоме
начинается
с s-орбитали, которая имеет сферическую
Форму.
На втором и последующих уровнях после одной
S-орбитали появляются p-орбитали гантелеобразной
Формы.
Слайд 19Магнитное квантовое число
Магнитное квантовое число (m) характеризует ориентацию орбиталей в
пространстве относительно внешнего магнитного или электрического поля и их максимального
количества для подуровней. В отсутствие внешнего магнитного поля все орбитали одного подуровня имеют одинаковое значение энергии.
Величина m принимает целочисленные значения от – до +, включая ноль, и меняется скачкообразно. Это означает, что для каждой формы орбитали существует (2 + 1), энергетически равноценных ориентации в пространстве.
Так при = 0 m = 0 – это s-подуровень, имеющий одну орбиталь шарообразной формы;
при = 1 m = -1; 0; +1 – это p- -подуровень, имеющий три оболочки гантелеобразной формы (рис. 1);
при = 2 m = -2; -1; 0; +1; +2 – это d подуровень -пять орбиталей сложной конфигурации,
а при = 3 m = -3; -2; -1; 0; +1; +2; +3 это f- подуровень семь орбиталей сложной конфигурации.
Слайд 21Спиновое квантовое число
Спиновое квантовое число (ms) характеризует механический момент
движения электронов и имеет два значения +1/2 и –1/2, соответствующие
противоположным направлениям вращения. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↑ ↓.
Каждая электронная орбиталь в атоме (или атомная орбиталь (АО)) характеризуется тремя квантовыми числами: n, и m.
Общие число АО равно n2. Условно атомную орбиталь обозначают в виде клеточки.
Состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами n, , m, и ms.
Слайд 22Строение многоэлектронных атомов
Запись распределения электронов в атоме по уровням, подуровням
и орбиталям получила название электронной конфигурации элемента.
При составлении электронных конфигураций
многоэлектронных атомов учитывают: принцип минимальной (наименьшей) энергии, принцип Паули, правила Гунда (Хунда) и Клечковского.
Принцип минимальной энергии: электроны в невозбужденном атоме распределяются по орбиталям таким образом, чтобы суммарная энергия атома была минимальной (n + ). Первыми заполняются орбитали с минимальными уровнями энергии.
Слайд 23Cr
24
1s2
3s2
3p6
2s2
2p6
3d5
1s2
2p6
3s2
4s1
3p6
3d5
2s2
Электронная формула
и электронно-графическая схема
Слайд 24Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит
в порядке возрастания суммы квантовых чисел n + , а
при равной сумме n + в порядке возрастания n.
Соответственно этому правилу подуровни выстраиваются в следующий ряд:
1s < 2s < 2p < 3s < 3p < 4s 3d < 4p < 5s 4d < 5p < 6s 5d 4f < 6p < 7s и т. д.
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый «провал электронов», например Cu, Ag, Cr, Mo, Pd, Pt.
Слайд 25Принцип Паули (1925): на одной атомной орбитали не может быть
более двух электронов, причем они должны иметь противоположные (антипараллельные) спины.
По-другому можно сказать: в атоме не может быть двух электронов, обладающих одинаковым набором 4 квантовых чисел n, , m, и ms. Поэтому допускается заполнение и не допускается заполнение и .
Слайд 26Правило Гунда (Хунда):
Правило Гунда (Хунда): заполнение электронами подуровня происходит т.о.,
чтобы суммарный спин был максимален, т.е при наличии нескольких пустых
или наполовину заполненных АО данного подуровня электроны занимают максимально возможное число АО.
Слайд 27 Периодические свойства атомов элементов
Энергия ионизации (J), или, первый ионизационный
потенциал (J1) представляет собой наименьшую энергию, необходимую для удаления электрона
от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность. Э + J = Э+ + е-
Энергию ионизации выражают в килоджоулях на моль (кДж/моль), либо в электронвольтах (эВ/моль).
1 эВ= 96.32 кДж/моль
J3, J4,
(для многоэлектронного атома существуют также понятия второго, третьего
и т. д. ионизационных потенциалов, - Это энергия удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д.
Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.),
Слайд 30Энергия ионизации характеризует восстановительную способность элемента. Чем ниже энергия ионизации,
тем выше восстановительная способность элемента. Энергия ионизации определяется электронным строением
элементов и ее изменение имеет периодический характер.
Энергия ионизации возрастает по периоду.
В группе энергия ионизации уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов. Наименьшие значения энергии ионизации имеют щелочные элементы, что объясняется эффектом экранирования.
Он заключается в уменьшении воздействия на внешние электроны положительного заряда ядра из-за наличия между ними других электронов.
Эффект экранирования противоположен эффекту проникновения электрона во внутренние области атома.
Слайд 31Сродство к электрону
Сродство к электрону – это энергетический эффект присоединения
моля электронов к молю нейтральных атомов. Например: Э + е-
= Э- +Ее. Количественно сродство к электрону Е е- выражается в кДж/моль или эВ и зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, наименьшие и даже отрицательные значения ее – элементы с электронной конфигурацией s2 (He, Be, Mg, Zn), c полностью или наполовину заполненными p-подуровнями (Ne, Ar, Kr, N, P, As).
Слайд 32Зависимость сродства к электрону атома от атомного номера элемента
Слайд 33Электроотрицательность
Электроотрицательность (ЭО) – это характеристика способности атомов в соединениях притягивать
к себе электроны.
Имеется несколько шкал ЭО. Согласно P. Малликену
(США) ЭО равна полусумме энергии ионизации и энергии сродства к электрону.
Относительная ЭО (ОЭО) по Л. Полингу (США) – это разность энергии диссоциации соединения А-В и образующих его молекул А-А и В-В. За единицу в ней принята ЭО лития.
ОЭО (F)=4. Величина ЭО возрастает по периоду и несколько убывает в группах с возрастанием номера периода
Слайд 35Атомные радиусы
Атомные радиусы элементов не имеют строго определенных границ из-за
корпускулярно-волнового характера электронов. Поэтому абсолютное значение радиуса атома определить невозможно.
Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности (орбитальный радиус атома) или половину расстояния между центрами 2-х смежных атомов в кристаллах (эффективные радиусы атомов).
Слайд 36Эффективные атомные и ионные радиусы
R(F-)=0,113 нм,
а расстояние Na-F 0,231
нм, отсюда
R(Na+)= 0,231 - 0,113 нм=0,118нм.
Для одного и того же
элемента эфф. радиусы (ков., ион.,мет.)не совпадают между собой.
Слайд 37Орбитальный радиус атома
Для любого атома может быть только один орб.
радиус в нормальном состоянии и много в возбужденных.
Орб. радиусы
ближе к истинному размеру атома, чем эффективные.
R(F-)=0,04 нм,
R(Na+)=0,019 нм.
Слайд 38Периодичность изменение атомных радиусов
Наблюдается периодичность изменение атомных радиусов (эффект. и
орбит.), особенно у s- и p-элементов. У d- и f-элементов
кривая изменения радиусов атомов по периоду имеет более плавный характер.
В одной и той же группе с увеличением номера периода атомные радиусы, как правило, возрастают в связи с увеличением числа электронных оболочек.
Однако увеличение заряда ядра в периодах при этом производит к уменьшению ат. радиусов, поэтому увеличение атомных радиусов с увеличением номера периода относительно невелико, а в некоторых случаях, например у p-элементов III группы значение орбитального радиуса у Al больше, чем у Ga.
Уменьшение ат. рад. с увеличением ат. массы носит название лантаноидного (актиноидного) сжатия.
Слайд 40Диагональная аналогия
При переходе по периоду слева направо радиусы атомов и
ионов уменьшаются настолько, насколько они увеличиваются при переходе сверху вниз
по группе., т.е радиусы атомов элементов, расположенных по диагонали (Li и Mg,
Be и Al)т близки, это положение было отмечено Менделеевыми называется диагональной аналогией:
Li - Be Ве - В
Mg Al
Слайд 41Вторичная периодичность
Изменение свойств энергии ионизации, атомных радиусов в подгруппах элементов
имеют немонотонный характер
Н-р в ряду С-Si-Ge-Sn-Pb имеются внутренние минимумы
и максимумы. Немонотонность изменения свойств элементов в подгруппе называется вторичной периодичностью.
Открыта русским физико-химиком Е.В. Бироном в 1915 г, доказана С.А. Щукаревым
Слайд 42Физ. смысл периодического закона
В свете учения о строении атомов:
Свойства
простых веществ, а также формы и свойства их соединений находятся
в периодической зависимости от заряда ядра атомов элементов.
Физ. смысл периодического закона заключается в периодическом изменении свойств атомов элементов в результате периодически возобновляющихся сходных электронных оболочек атома при последовательном возрастании значений главного квантового числа
Слайд 43Периодическая система Д.И. Менделеева
Период –это горизонтальный ряд элементов, начинающийся щел.
Ме и заканчив. Благ. Газом. (малые, большие, незавершенный).
Типическими
элементами Д.И. Менделеев называл элементы II и III периодов
Ряды элементов (четные, нечетные), семейства, триады
В периодах наблюдается горизонтальная аналогия (в семействах, триадах)
Слайд 44Группа элементов- вертикальные столбцы, в кот. входят сходные по свойствам
элементы.
Главные подгруппы состоят из элементов и больших и малых периодов,
побочные только из эл. больших периодов
В подгруппах наблюдается групповая (вертикальная)аналогия.
Слайд 45Различные формы периодической системы: Короткая 8 клеточная:
Слайд 46Полудлинная 18 клеточная: элементы вставных декад занимают клетки между s
и p элементами, но f элем. Остаются за пределами ПС.
Группы элементов дополнительно обозначены арабскими цифрами.
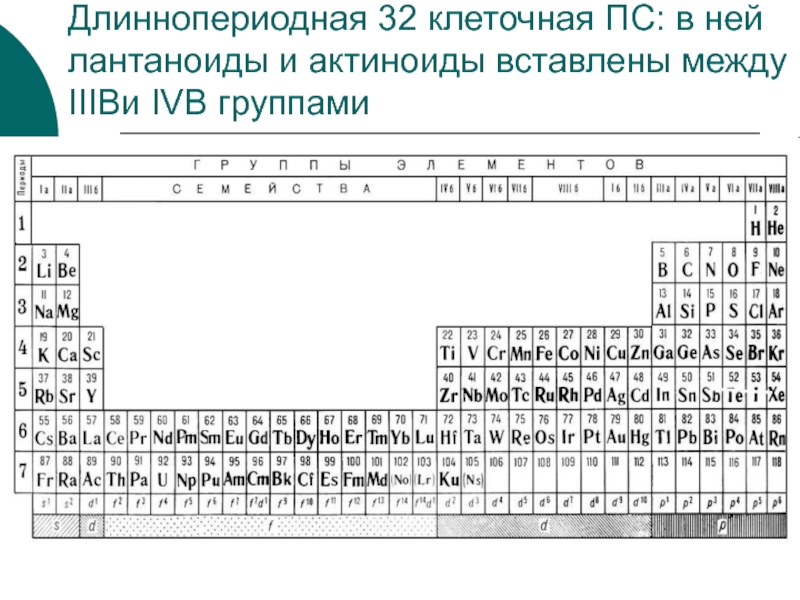
Слайд 47Длиннопериодная 32 клеточная ПС: в ней лантаноиды и актиноиды вставлены
между IIIBи IVB группами