Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема 8. Жидкие системы
Содержание
- 1. Тема 8. Жидкие системы
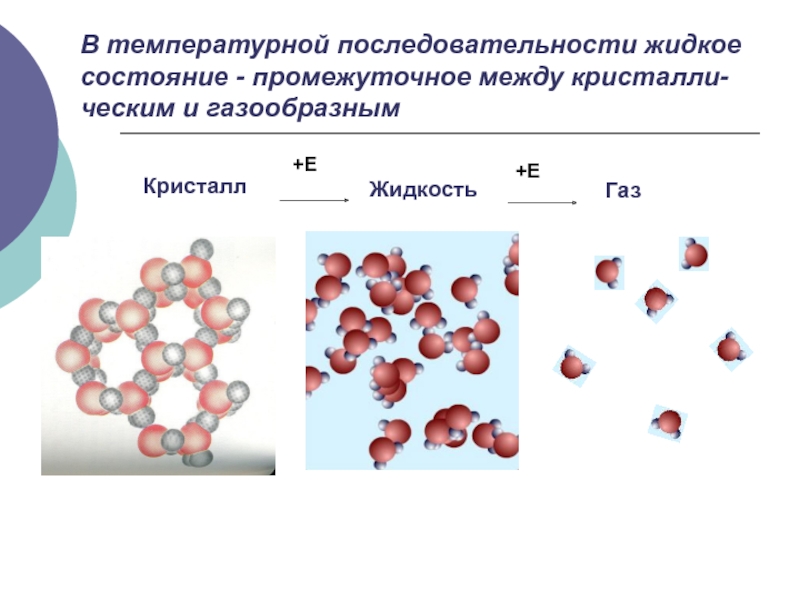
- 2. КристаллЖидкостьГазВ температурной последовательности жидкое состояние - промежуточное между кристалли-ческим и газообразным
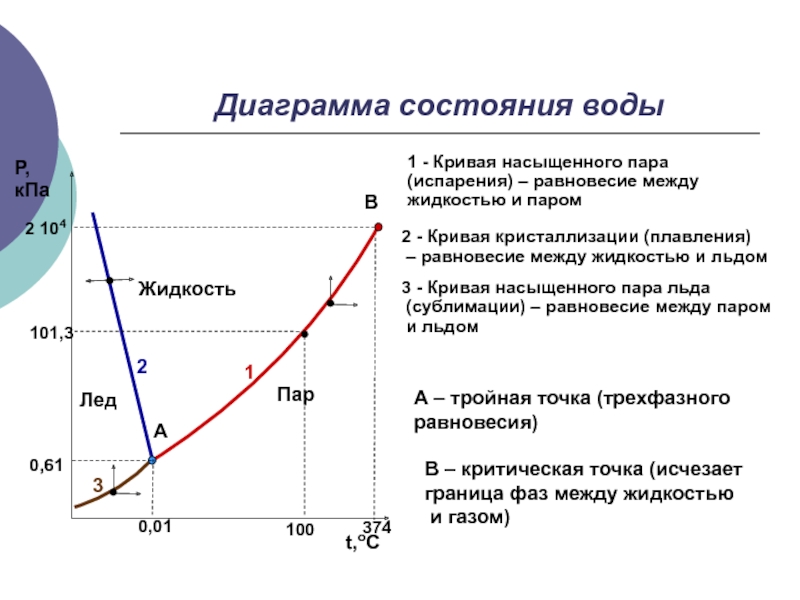
- 3. Диаграмма состояния воды1 - Кривая насыщенного пара
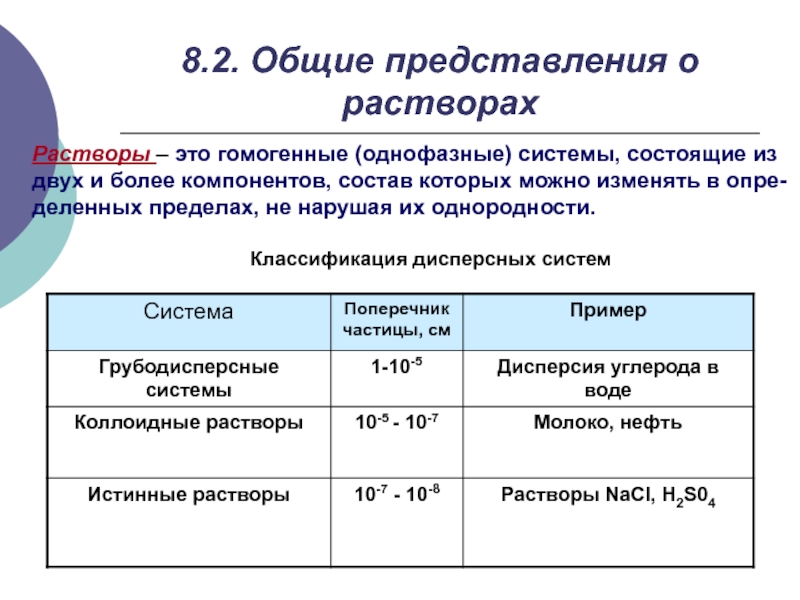
- 4. 8.2. Общие представления о растворахРастворы – это
- 5. Классификация растворов (по агрегатному состоянию) РастворыГазообразныеВоздух, природный
- 6. Способы выражения состава растворовМассовая доля – масса
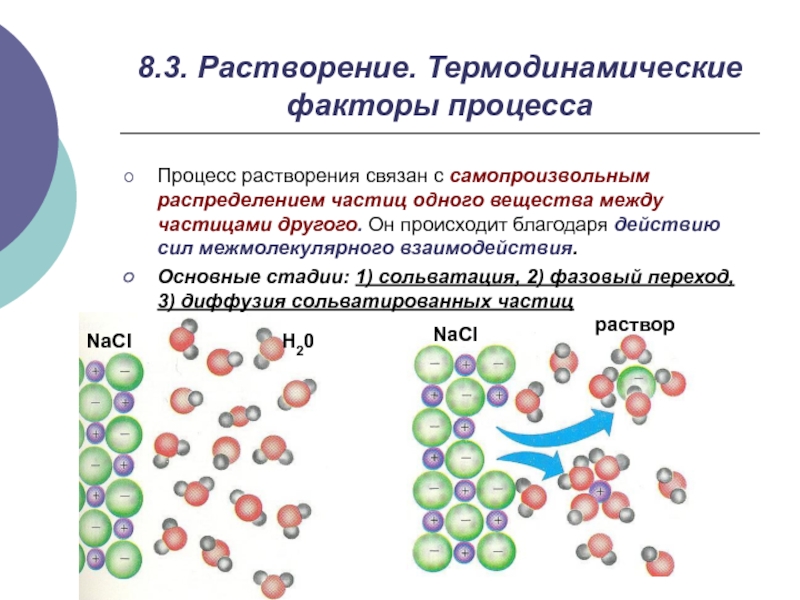
- 7. 8.3. Растворение. Термодинамические факторы процессаПроцесс растворения связан
- 8. Растворение – самопроизвольный процесс: ΔG0 независимо от
- 9. Тепловой эффект процесса растворения определяется соотношением |
- 10. Изменение энтропии: ΔSр. = ΔSсольв.+ ΔSф.п.+ ΔSдифΔSсольв0
- 11. Процесс растворения определяется: - природой растворителя и растворенного вещества; - агрегатным состоянием растворяемого вещества; - температурой.
- 12. 8.4. РастворимостьРастворенное вещество + растворитель = раствор,
- 13. 8.5. Общие свойства растворовИдеальным называется гипотетический раствор,
- 14. Закон Рауля (1888 г) Сs,ps0,5Сs, 0,5psОтносительное
- 15. Следствия из закона РауляПовышение температуры кипения ипонижение
- 16. Осмос. IIIIIIРастворенное веществоЯвление, связанное со способностью
- 17. Закон Вант-Гоффа (1887 г)
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Кристалл
Жидкость
Газ
В температурной последовательности жидкое состояние - промежуточное между кристалли-ческим и
газообразным
Слайд 3Диаграмма состояния воды
1 - Кривая насыщенного пара (испарения) – равновесие
между жидкостью и паром
0,01
100
374
0,61
101,3
2 104
1
2
3
А – тройная точка (трехфазного
равновесия)2 - Кривая кристаллизации (плавления)
– равновесие между жидкостью и льдом
3 - Кривая насыщенного пара льда
(сублимации) – равновесие между паром
и льдом
В – критическая точка (исчезает
граница фаз между жидкостью
и газом)
Слайд 48.2. Общие представления о растворах
Растворы – это гомогенные (однофазные) системы,
состоящие из
двух и более компонентов, состав которых можно изменять
в опре-деленных пределах, не нарушая их однородности.
Классификация дисперсных систем
Слайд 5Классификация растворов (по агрегатному состоянию)
Растворы
Газообразные
Воздух, природный газ
Жидкие
Растворы NaCl, H2S04
Твердые
Стали и сплавы
Раствор состоит из растворителя и растворенного вещества
(веществ).
Растворенное
вещество – компонент раствора, определяющий его химические свойства.
Если один из компонентов – вода, она всегда считается
растворителем.
Слайд 6Способы выражения состава растворов
Массовая доля – масса растворенного вещества, отнесенная
к массе всего раствора, выражается в долях единицы (1) или
в процентах (2)1) 2)
Моляльность – количес-тво растворенного ве-щества в 1000 г (1 кг) рас-творителя, моль/1000г H2O
Молярность – количество растворенного вещества в 1 литре раствора, моль/л
Нормальность – количес-тво эквивалентов рас-творенного вещества в 1 литре раствора,
моль экв/л
Слайд 78.3. Растворение. Термодинамические факторы процесса
Процесс растворения связан с самопроизвольным распределением
частиц одного вещества между частицами другого. Он происходит благодаря действию
сил межмолекулярного взаимодействия.Основные стадии: 1) сольватация, 2) фазовый переход, 3) диффузия сольватированных частиц
NaCl
H20
NaCl
раствор
Слайд 8Растворение – самопроизвольный процесс: ΔG
независимо от фазового состояния растворяемого вещества. Связана с нейтрализацией зарядов
→с понижением энергетического уровня системы;ΔHф.п>0 при растворении твердого вещества. Для разрушения кристаллической решетки необходимо затратить энергию.
ΔHдиф>0 независимо от фазового состояния растворяемого вещества . Диффундируя, сольватированные частицы должны преодолевать силы межмолекулярного взаимодействия растворителя.
Если | ΔHф.п+ ΔHдиф| > | ΔHсольв|, процесс растворения – эндотермический.
Если | ΔHф.п+ ΔHдиф| < | ΔHсольв|, процесс растворения – экзотермический.
Слайд 9Тепловой эффект процесса растворения определяется соотношением | ΔHф.п|, |ΔHдиф| и
| ΔHсольв|
С повышением температуры
- растворимость твердых веществ в
жидкостях повышается, т.к. | ΔHф.п+ ΔHдиф| >| ΔHсольв| поскольку величина ΔHф.п – велика (высокая энергия связи в кристаллической решетке.- растворимость жидкостей в жидкостях как правило понижается, т.к. | ΔHф.п+ ΔHдиф| <| ΔHсольв|, поскольку, например, у серной кислоты высокая энергия сольватации
- растворимость газов в жидкостях понижается: с повышением температуры кинетическая энергия газа в газовой фазе увеличивается значительно сильнее, чем кинетическая энергия газа в жидкости. Поэтому молекулам газа с повышением температуры гораздо легче покинуть жидкость, чем перейти из газового состояние в жидкое.
Слайд 10
Изменение энтропии:
ΔSр. = ΔSсольв.+ ΔSф.п.+ ΔSдиф
ΔSсольв
упорядочиванием зарядов
ΔSф.п0
для твердых веществΔSдиф >0
Слайд 11Процесс растворения определяется:
- природой растворителя и растворенного вещества;
- агрегатным состоянием
растворяемого вещества;
- температурой.
Слайд 128.4. Растворимость
Растворенное вещество + растворитель = раствор, ΔG
вещество + растворитель = раствор, ΔG=0 раствор ненасыщенный
Растворенное вещество +
растворитель = раствор, ΔG>0 раствор пересыщенныйКонцентрация растворенного вещества в насыщенном растворе называется его растворимостью.
Слайд 138.5. Общие свойства растворов
Идеальным называется гипотетический раствор, образованный веществами, имеющими
строго одинаковые размеры частиц и строго одинаковую энергию межмолекулярного взаимодействия.
Слайд 14Закон Рауля
(1888 г)
Сs,ps
0,5Сs, 0,5ps
Относительное понижение давления
насыщенного пара растворителя
над
раствором равно мольной доле рас-
творенного вещества
р0 – давление насыщенного
пара над чистым растворителем;р0 – давление насыщенного пара над раствором
ν1 – количество молей растворенного вещества
ν1 – количество молей растворителя
Сμ –мольная доля раствора
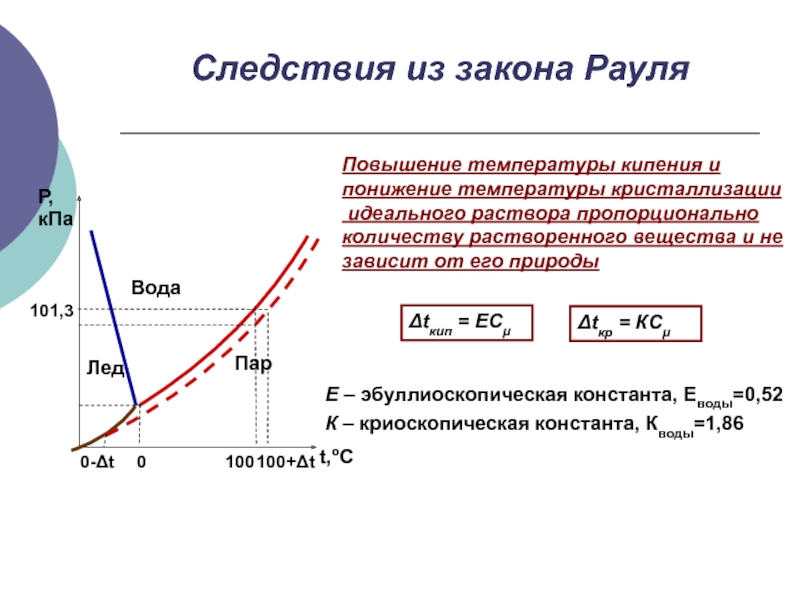
Слайд 15Следствия из закона Рауля
Повышение температуры кипения и
понижение температуры кристаллизации
идеального
раствора пропорционально
количеству растворенного вещества и не
зависит от его природы
Δtкип
= ECμΔtкр = КCμ
Е – эбуллиоскопическая константа, Еводы=0,52
К – криоскопическая константа, Кводы=1,86
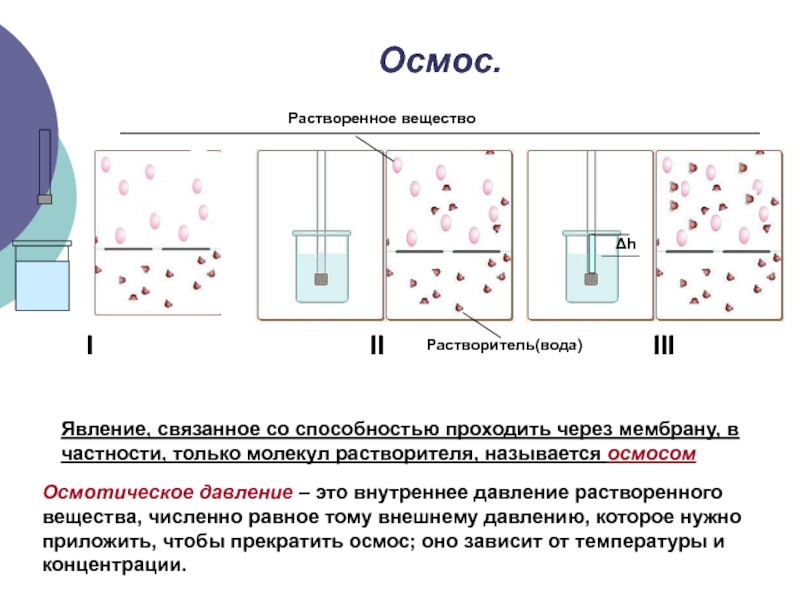
Слайд 16Осмос.
I
II
III
Растворенное вещество
Явление, связанное со способностью проходить через мембрану, в
частности, только молекул растворителя, называется осмосом
Растворитель(вода)
Осмотическое давление – это
внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации. Слайд 17Закон Вант-Гоффа
(1887 г)
Осмотическое давление раствора численно
равно тому газовому давле-нию, которое имело бы растворенное вещество, будучи
переведенным в газо-образное состояние в том же объеме и при той же температуре.О
Π – осмотическое давление
ν - количество растворенного вещества
R – универсальная газовая постоянная
Т - температура раствора
V – объем раствора