Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕМА: Общие подходы в решении расчетных задач по химии (задание
Содержание
- 1. ТЕМА: Общие подходы в решении расчетных задач по химии (задание
- 2. Задание 34Расчёты с использованием понятий «растворимость», «массовая
- 3. уравнения всех происходящих реакций, расчеты с применением
- 4. Какие расчеты нужно уметь делать?
- 5. Расчеты соотношений количеств веществ по химическому уравнению:
- 6. Какие расчеты нужно уметь делать?
- 7. Массовая доля
- 8. Массовая доля
- 9. Массовая доля
- 10. Массовая доля
- 11. Растворимость
- 12. Кристаллогидрат
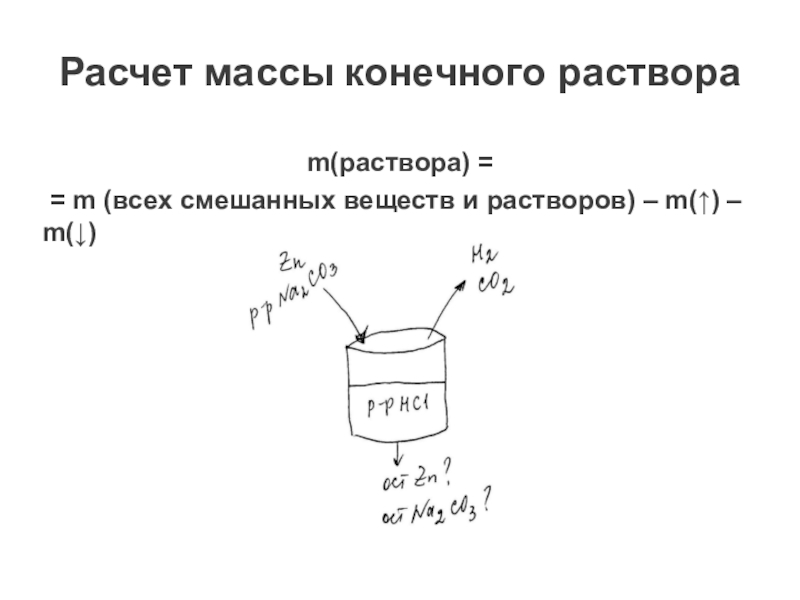
- 13. m(раствора) = = m (всех смешанных веществ
- 14. Решение задач с применением понятия «растворимость»Задача 1(34)
- 15. Решение задач с применением понятия «растворимость»
- 16. Решение задач с применением понятия «растворимость»Определим количество
- 17. Mассу второго раствора можно найти по пропорции:395,4
- 18. Задача 2(34)Решение задач с применением понятия «растворимость»
- 19. Запишем уравнения реакций:Na2SO3 + 2HNO3 = Na2SO4
- 20. Пусть по первому уравнению в реакцию вступает
- 21. Определим массу 2 раствора:50,4 г (Na2SO3) –
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Задание 34
Расчёты с использованием понятий «растворимость», «массовая доля вещества в
растворе».
Расчёты массы (объёма, количества вещества) продуктов реакции, если одно
из веществ дано в избытке (имеет примеси). Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного.
Расчёты массовой доли (массы) химического соединения в смеси
Спецификация ЕГЭ по химии (2020 г.)
Слайд 3уравнения всех происходящих реакций,
расчеты с применением значений для исходных
веществ,
логические рассуждения и расчеты по нахождению определяемых величин,
получение
окончательного ответаОбязательные элементы задачи
Слайд 5Расчеты соотношений количеств веществ по химическому уравнению:
0,2 моль
х=0,6 моль
H3PO4 + 3KOH = K3PO4 + 3H2O1 моль 3 моль
Какие расчеты нужно уметь делать?
Слайд 13m(раствора) =
= m (всех смешанных веществ и растворов)
– m(↑) – m(↓)
Расчет массы конечного раствора
Слайд 16Решение задач с применением понятия «растворимость»
Определим количество вещества карбоната натрия:
n(Na2CO3)
= 95,4г : 106г/моль = 0,9 моль
Раствор разделили на 2
части, они не равные!Определим количества вещества осадка, который выпал в первой части раствора:
n(СaCO3) =50 г : 100г/моль = 0,5 моль ⇒ n(Na2CO3 )по 1 уравнению тоже 0,5 моль
Во втором растворе содержалось 0,9 – 0,5 = 0,4 моль (Na2CO3)
m(Na2CO3 во 2 р-ре) = 0,4 моль ∙ 106 г/моль = 42,4 г
В него добавили m (HNO3) = 0,3 ∙ 252 г = 75,6 г
Определим n (HNO3) = 75,6 г : 63 г/моль = 1,2 моль
На реакцию с карбонатом натрия во втором растворе израсходуется 0,8 моль HNO3.
nост (HNO3) = 1,2 моль – 0,8 моль = 0,4 моль
mост (HNO3) = 0,4 моль ∙ 63 г/моль = 25,2 г
Слайд 17Mассу второго раствора можно найти по пропорции:
395,4 г раствора -
содержит 95,4 г Na2CO3
х г раствора – содержит 42,4 г
Na2CO3х = 42,4 ∙ 395,4 : 95,4 = 175,7 г
m (конечного раствора из 2 части) = m2(р-ра Na2CO3) +
+ m (р-ра HNO3) – m(CO2)
m(CO2) = 0,4 моль ∙ 44г/моль = 17,6 г
m (конечного раствора из 2 части) = 175,7 + 252 – 17,6 = 410,1 (г)
w (HNO3) = 25,2 : 410,1 = 0,061 или 6,1%
Решение задач с применением понятия «растворимость»
Слайд 19Запишем уравнения реакций:
Na2SO3 + 2HNO3 = Na2SO4 + 2NO2 +
H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Определим массу
сульфита в насыщенном растворе:25,2 г (Na2SO3) – растворяется в 100 г воды
х г (Na2SO3) – растворяется в 300 г воды
х= 25,2 ∙ 300 : 100 = 75,6 г
m (насыщенного раствора) = 300 г + 75,6 г = 375,6 г
Определим количество вещества сульфита натрия:
n(Na2SO3) = 75,6 г : 126 г/моль = 0,6 моль
Решение задач с применением понятия «растворимость»
Слайд 20Пусть по первому уравнению в реакцию вступает х моль сульфита
натрия, тогда в результате реакции выделяется 2х моль бурого газа.
Пусть по второму уравнению в реакцию вступает y моль сульфита калия, тогда образуется у моль сернистого газа. Получаем систему уравнений:3x = 0,6
x = 0,2 моль
y = 0,4 моль
m2р-р (Na2SO3) = 0,4 моль ∙ 126 г/моль = 50,4 г
Решение задач с применением понятия «растворимость»
Слайд 21Определим массу 2 раствора:
50,4 г (Na2SO3) – растворяется в a
г раствора
75,6 г (Na2SO3) – растворяется в 375,6 г раствора
a
= 50,4 ∙ 375,6 : 75,6 = 250,4 (г)по 2 уравнению n(NaCl) = 2n(SO2) = 0,8 моль
m(NaCl) = 0,8 моль ∙ 58,5 г/моль = 46,8 г
m (конечного раствора) = m(2 части р-ра Na2SO3) +
+ m(р-ра HCl) – m(SO2)
m(SO2) = 0,4 моль ∙ 64 г/моль = 25,6 г
m (конечного раствора) = 250,4 + 300 – 25,6 = 524,8 (г)
w(NaCl) = 46,8 : 524,8 = 0,0891 или 8,91%
Решение задач с применением понятия «растворимость»