Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика и статистическая физика
Содержание
- 1. Термодинамика и статистическая физика
- 2. Лекция № 11. Состояние термодинамического равно-
- 3. СТАТИСТИЧЕСКИЙ И ТЕРМО- ДИНАМИЧЕСКИЙ МЕТОДЫ
- 4. Слайд 4
- 5. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА. ПАРАМЕТРЫ СОСТОЯНИЯ Термодинамической системой
- 6. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ СОСТОЯНИЯПараметры состояния не
- 7. РАВНОВЕСНЫЕ ПРОЦЕССЫТермодинамическим процессом называется переход системы
- 8. Состояние термодинамической системы, не изменяющееся во
- 9. ТЕМПЕРАТУРА Если два тела находятся в
- 10. В физике и технике за абсолютную шкалу
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Сэр Уильям Томсон (лорд Кельвин) 26 июня
- 16. ФАРЕНГЕЙТ, ДАНИЭЛЬ ГАБРИЭЛЬ (Fahrenheit, Daniel Gabriel) (1686–1736)-
- 17. Абсолютная температура Т не может
- 18. Слайд 18
- 19. Давление. Основное уравнение молекулярно-кинетической теории
- 20. Находящиеся под давлением
- 21. Давление внутри газа или жидкости можно измерить,
- 22. Поскольку среда покоится, на каждую грань куба
- 23. Внутреннее давление является
- 24. Вычислим давление, оказываемое газом
- 25. Слайд 25
- 26. Каждая молекула обладает импульсом m0υx, но стенка
- 27. Наивно полагать, что все молекулы
- 28. Под скоростью
- 29. Следовательно, на другие стенки будет точно такое
- 30. Слайд 30
- 31. Единицы измерения давления. По определению,
- 32. Чтобы связать энергию с температурой, Больцман ввел
- 33. Величину T называют абсолютной температурой и измеряют
- 34. Тогдa для NA частиц идеального газа:
- 35. Основное уравнение молекулярно-кинетической теории можно записать
- 36. Из уравнения
- 37. Основные законы идеального газа В
- 38. 1.Изохорический процесс. V = const. Изохорическим
- 39. ШАРЛЬ (Charles) Жак Александр Сезар (1746-1823)- французский
- 40. График изохорического процесса на РТ диаграмме называется
- 41. 2. Изобарический процесс. Р = const.
- 42. Жозеф Луи Гей-Люссак
- 43. График изобарического процесса на VT диаграмме называется
- 44. 3. Изотермический процесс. T = const.
- 45. Роберт Бойль (1627 — 1691
- 46. МАРИОТТ Эдм (1620 - 1684) французский физик.
- 47. Полезно знать графики изотермического процесса на VT
- 48. 4. Адиабатический процесс (изоэнтропийный). Процесс, происходящий
- 49. 6. Закон Авогадро. При одинаковых давлениях и
- 50. Авогадро Амедео (1776 – 1856) – итальянский
- 51. 7. Закон Дальтона. Давление смеси идеальных
- 52. Джон Дальтон1766-1844английский физик. Изучение состава и свойств
- 53. 8. Объединённый газовый закон (Закон Клапейрона).
- 54. Слайд 54
- 55. Менделеев объединил известные нам законы Бойля-Мариотта, Гей-Люссака
- 56. Слайд 56
- 57. Если обозначим
- 58. Согласно закону Дальтона: полное давление смеси
- 59. ЛЕКЦИЯ ЗАКОНЧЕНА!
- 60. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Лекция № 1
1. Состояние термодинамического равно-
весия. Температура.
2.
Модель идеального газа. Давление. Абсолютная температура. Уравнение состояния системы.
Клапейрона-Менделеева. Основные законы идеального газа.Слайд 3 СТАТИСТИЧЕСКИЙ И ТЕРМО- ДИНАМИЧЕСКИЙ МЕТОДЫ
Существуют два способа
описания процессов, происхо-
дящих в макроскопических телах (телах, состоящих из
большого
числа частиц) – статистический и термодина-мический. Статистический метод изучает свойства макро-
скопических тел исходя из свойств образующих тело
частиц и взаимодействий между ними. Свойства тел,
наблюдаемые на опыте, объясняются как усредненный
результат действия отдельных молекул. Термодинамический метод изучает свойства тел, не
вдаваясь в их микроскопическую структуру, а опираясь на
фундаментальные законы ( начала термодинамики),
установленные обобщением экспериментальных фактов.
Слайд 5ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА. ПАРАМЕТРЫ СОСТОЯНИЯ
Термодинамической системой называется совокупность
макроскопических
тел, которые могут обмениваться энер-
гией между собой и окружающей средой.
Термодинамическая система может находиться в различ-ных состояниях, различающихся температурой, давлением,
объемом, плотностью… Подобные величины, характери-
зующие состояние системы,
называются параметрами
состояниями. Термодинами-
ческие системы, которые не
обмениваются с внешней сред-
ой ни энергией, ни веществом
называются замкнутыми
(изолированными).
Слайд 6 РАВНОВЕСНЫЕ И
НЕРАВНОВЕСНЫЕ СОСТОЯНИЯ
Параметры состояния не всегда име-
ют определенные значения
(одина-
ковые во всех точках системы).
Состояние, в котором хотя бы один
из параметров не имеет определен-
ного значения, называется неравно-
весным.
Состояние термодинамической сис-
темы будет равновесным, если все
параметры cостояния имеют опре-
деленные значения, не изменяющие-
ся с течением времени.
Слайд 7 РАВНОВЕСНЫЕ ПРОЦЕССЫ
Термодинамическим процессом называется переход системы из
одного состояния в
другое. Такой переход всегда связан с нару-
шением равновесия системы. Например,
при сжатии газа давление в первую оче-
редь возрастет вблизи поршня – равнове-
сие нарушится. Нарушение равновесия
будет тем значительнее, чем быстрее пере-
мещать поршень. Если двигать поршень
очень медленно, то равновесие нарушает-
ся незначительно и давление в разных точ-
ках мало отличается от равновесного для
данного объема газа. В пределе, при беско-
нечно медленном сжатии процесс окажется состоящим
из последовательности равновесных состоя-
ний. Процесс называется равновесным или квазистатическим.
Слайд 8 Состояние термодинамической системы, не изменяющееся во времени и не
сопровожда-ющееся переносом через систему вещества или энергии, называется термодинамическим равновесием.
Параметры состояния при термодинамическом равновесии можно считать постоянными.Изолированная система со временем всегда
приходит к равновесному состоянию и не может самопроизвольно из него выйти.
Данное утверждение часто называю нулевым началом термодинамики.
Слайд 9ТЕМПЕРАТУРА
Если два тела находятся в состоянии термодина-
мического равновесия,
то есть не обмениваются
энергией путем теплопередачи, то этим телам
приписывается
одинаковая температура. Температура – физическая величина, характе-
ризующая степень нагретости тел и определяет
направление передачи тепла.
Если между телами происходит направленный
теплообмен, то телу отдающему энергию припи-
сывают большую температуру по сравнению с
телом, получающим тепловую энергию.
Слайд 10 В физике и технике за абсолютную шкалу температур принята шкала
Кельвина, названная в честь знаменитого английского физика, лорда Кельвина. 1
К – одна из основных единиц системы СИ Кроме того, используются и другие шкалы: – шкала Фаренгейта (немецкий физик 1724 г.) – точка таянья льда 32F, точка кипения воды 212F. – шкала Цельсия (шведский физик 1742г.) – точка таянья льда 0С, точка кипения воды 100С. 0С = 273,15 К. На рисунке приведено сравнение разных темпера- турных шкал.Слайд 14
Цельсий Андерс (1701 – 1744) –
шведский а астроном и физик. Работы относятся к астрономии, геофизике, математике, физике. Предложил в 1742 г. стоградусную шкалу термометра, в которой за ноль градусов принял температуру таяния льда, а за 100 градусов – температуру кипения воды.Слайд 15Сэр Уильям Томсон (лорд Кельвин) 26 июня 1824 г. –
17 декабря 1907 г.
В круг научных интересов Томсона входили термодина-мика,
гидродинамика, электромагнетизм, теория упругости, теплота, математика, техника.В 1851 г. У. Томсон сформулировал (независимо от Р. Клаузиуса) 2-е начало термодинамики.
В 1892 г. У. Томсону за его большие научные заслуги был присвоен титул барона Кельвина (по имени речки Кельвин, протекающей вблизи его университета в г. Глазго ).
Слайд 16ФАРЕНГЕЙТ, ДАНИЭЛЬ ГАБРИЭЛЬ (Fahrenheit, Daniel Gabriel) (1686–1736)- немецкий физик.
Почти всю жизнь прожил в Голландии, где занимался изготовлением
точных метеорологических приборов. Он был высококлассным
стеклодувом, изготовлял первые точно проверенные термометры, ареометры и термобарометры. Весовой ареометр Фаренгейта знали во многих странах Европы. В 1724 году Фаренгейт, приняв за основу температуры плавления льда +32° и кипения воды +212°, предложил температурную шкалу, названную впоследствии его именем.
Слайд 17 Абсолютная температура Т не может быть отрицательной величиной. Своеобразие
температуры заключается в том, что она не аддитивна (аддитивный –
получаемый сложением). Если мысленно разбить тело на части, то температура всего тела не равна сумме температур его частей (длина, объём, масса, сопротивление, и так далее – аддитивные величины). Поэтому температуру нельзя измерять, сравнивая её с эталоном. Современная термомет-рия основана на шкале идеального газа, где в качестве термометрической величины используют давление. Шкала газового термометра – является абсолютной (Т = 0; Р = 0).Слайд 18
Модель идеального газа
Абстрактная модель, отражающая существенные черты
явления, аналогичная материальной точке. 1. Молекулы (или атомы) газа не имеют собственного объема, то есть рассматриваются как материальные точки.
2. Силы взаимодействия между атомами и молекулами идеального газа пренебрежимо малы. Поэтому потенциальной энергией взаимодействия можно пренебречь. Отсюда, внутренняя энергия идеального газа – сумма кинетических энергий хаотического движения всех молекул. Взаимодействие же молекул сводится к упругим столкновениям.
Справедливо для газов в разреженном состоянии. Отсюда – идеальный газ: система невзаимодействующих материальных точек.
Слайд 19 Давление. Основное уравнение молекулярно-кинетической теории
Рассмотрим подробнее, что представляет собой один из основных параметров
состояния – давление P.Ещё в XVIII веке Даниил Бернулли предположил, что давление газа – есть следствие столкновения газовых молекул со стенками сосуда.
Именно давление чаще всего является единственным сигналом присутствия газа.
Слайд 20 Находящиеся под давлением газ или жидкость
действуют с некоторой силой на любую поверхность, ограничивающую их объем.
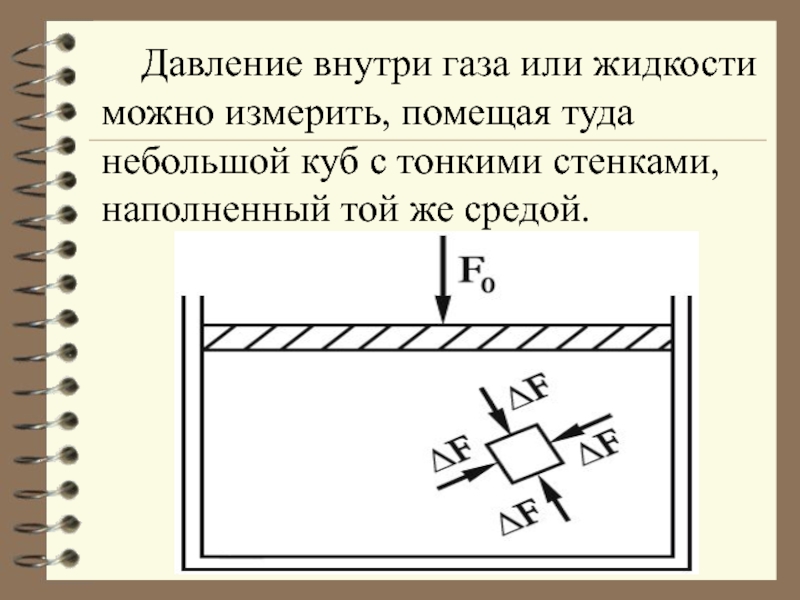
В этом случае сила действует по нормали к ограничивающей объем поверхности. Давление на поверхность равно: где ΔF–сила, действующая на поверхность площадь ΔS.Слайд 21 Давление внутри газа или жидкости можно измерить, помещая туда небольшой
куб с тонкими стенками, наполненный той же средой.
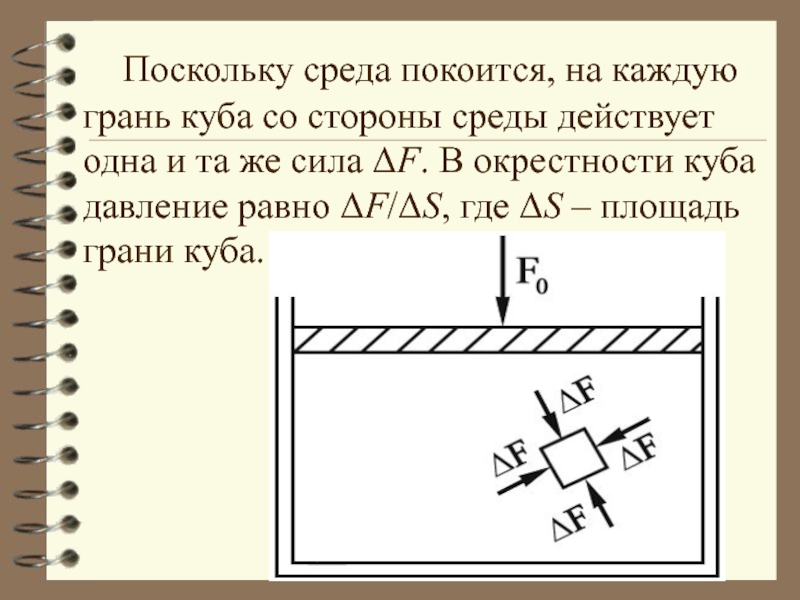
Слайд 22 Поскольку среда покоится, на каждую грань куба со стороны среды
действует одна и та же сила ΔF. В окрестности куба
давление равно ΔF/ΔS, где ΔS – площадь грани куба.Слайд 23 Внутреннее давление является одним и тем
же во всех направлениях, и, во всем объеме независимо от
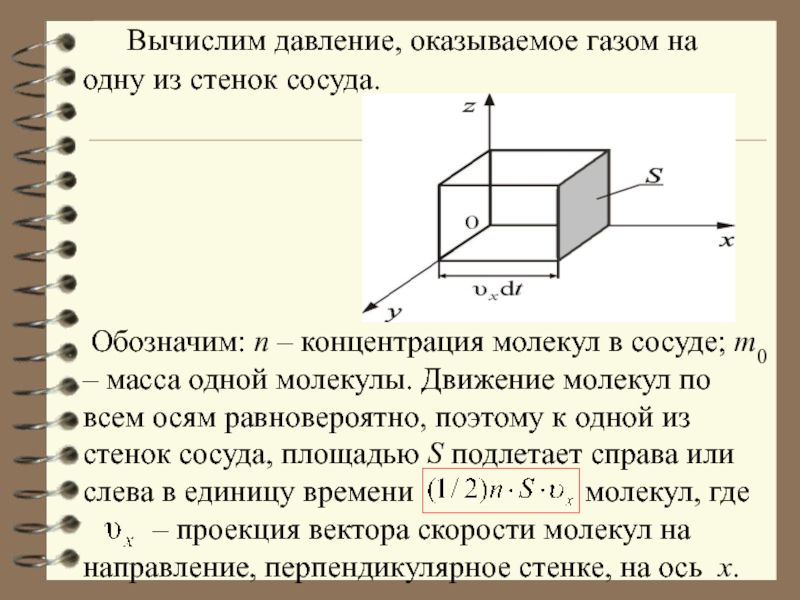
формы сосуда. Этот результат называется законом Паскаля: если к некоторой части поверхности, ограничивающей газ или жидкость, приложено давле- ние P0, то оно одинаково пере- дается любой части этой поверхности.Слайд 24 Вычислим давление, оказываемое газом на одну из
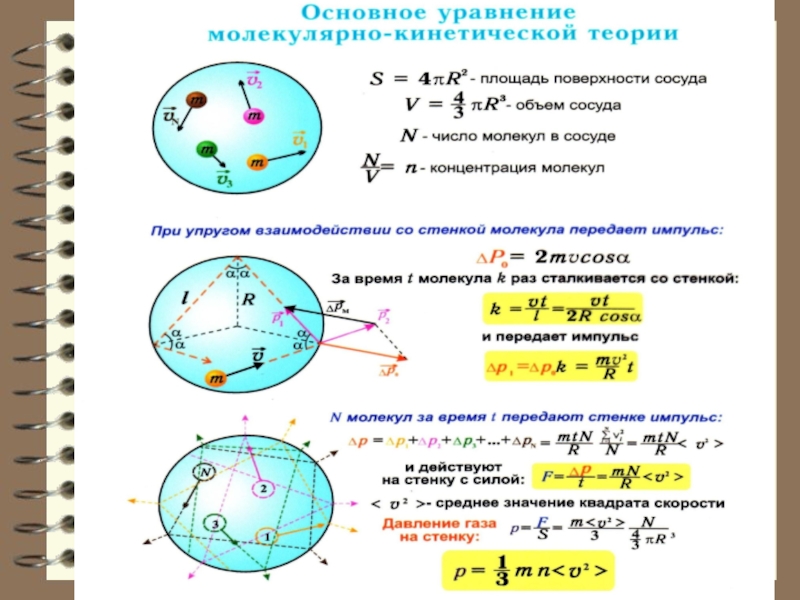
стенок сосуда.
Обозначим: n – концентрация молекул в сосуде; m0 – масса одной молекулы. Движение молекул по всем осям равновероятно, поэтому к одной из стенок сосуда, площадью S подлетает справа или слева в единицу времени молекул, где – проекция вектора скорости молекул на направление, перпендикулярное стенке, на ось x.Слайд 26Каждая молекула обладает импульсом m0υx, но стенка получает импульс
(при абсолютно-упругом ударе
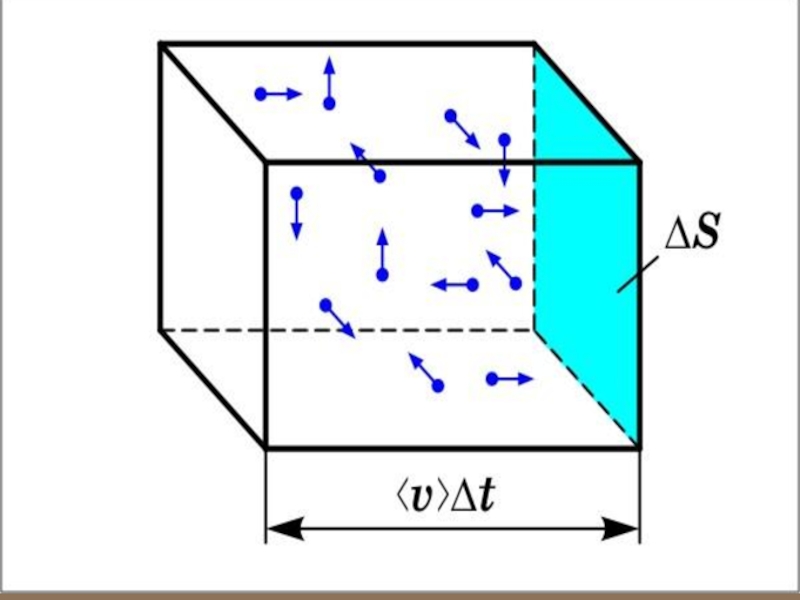
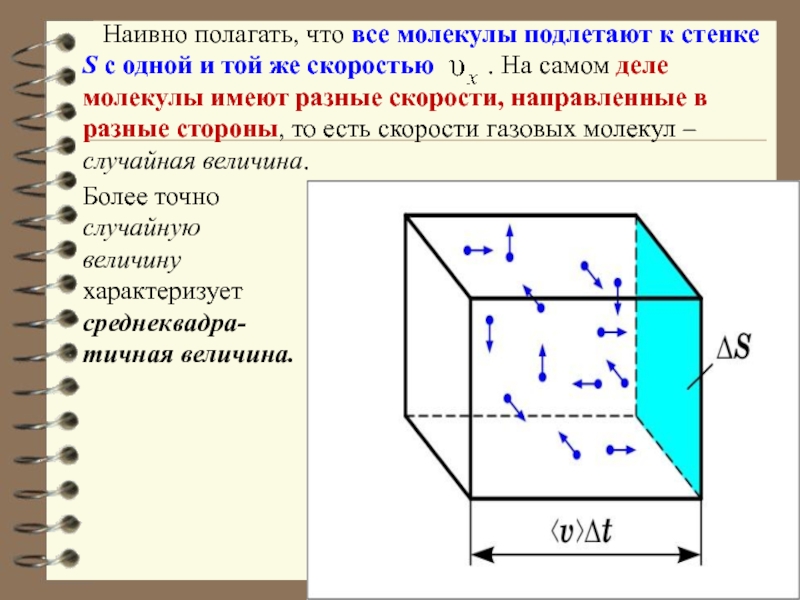
). За время dt о стенку площадью S успеет удариться число молекул, которое заключено в объёме V: Общий импульс, который получит стенка S: Разделив обе части равенства на S и dt; получим выражение для давления:Слайд 27 Наивно полагать, что все молекулы подлетают к стенке
S с одной и той же скоростью
. На самом деле молекулы имеют разные скорости, направленные в разные стороны, то есть скорости газовых молекул – случайная величина.Более точно случайную величину характеризует среднеквадра-тичная величина.
Слайд 28 Под скоростью понимаем среднеквадратичную скорость
Вектор скорости, направленный произвольно в
пространстве, можно разделить на три составляющих: Ни одной из этих проекций нельзя отдать предпочтение из-за хаотичного теплового движения молекул, то есть в среднем:Слайд 29 Следовательно, на другие стенки будет точно такое же давление. Тогда
можно записать в общем случае, заменяя< > на
> или где – средняя кинетич. энергия одной молекулы. Это основное уравнение молекулярно-кинетической теории газов. Итак, давление газов определяется средней кинетической энергией поступательного движения молекул.Слайд 31 Единицы измерения давления. По определению,
поэтому размерность давления 1 Н/м2
= 1 Па; 1 атм.=760 мм рт.ст.= 1,013∙105 Па ≈ ≈ 105 Па 1 мм рт.ст. = 1 тор = 1/760 атм. = 133,3 Па 1 бар = 105 Па; 1 атм. = 0,98 бар.Слайд 32 Чтобы связать энергию с температурой, Больцман ввел коэффициент пропорциональ-ности k,
который впоследствии был назван его именем:
где k – постоянная Больцмана k = 1,38·1023 Дж·К1.Слайд 33 Величину T называют абсолютной температурой и измеряют в градусах Кельвина
(К). Она служит мерой кинети-ческой энергии теплового движения частиц идеального
газа. Формула применима для расчетов на одну молекулу идеального газа. Обозначим: где R – универсальная газовая постоянная:Слайд 34Тогдa для NA частиц идеального газа: следовательно,
– это формула кинетической энергии для молярной массы газа.
Слайд 35 Основное уравнение молекулярно-кинетической теории можно записать по другом Т.к. Отсюда: В
таком виде основное уравнение молекулярно-кинетической теории употребляется чаще.
Слайд 36 Из уравнения
, зная, что в
объёме V
содержится N частиц и концен-трация их n = N/V , получим:
Если ввести величину - число молей,
то и получаем:
- уравнение Клапей-
рона-Менделеева
Слайд 37 Основные законы идеального газа
В XVII – XIX
веках были сформулированы опытные законы идеальных газов, которые подробно изучаются
в школьном курсе физики. Кратко напомним их.Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
Слайд 38 1.Изохорический процесс. V = const. Изохорическим процессом называется процесс, протекающий
при постоянном объёме V. Поведение газа при этом изохорическом процессе
подчиняется закону Шарля: P/Т = const: «При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным».Слайд 39ШАРЛЬ (Charles) Жак Александр Сезар (1746-1823)- французский физик.
Ученый, изобретатель и
воздухоплаватель, член Парижской АН.
В 1787 году он установил закон
изменения давления
данной массы идеального газа с измене-
нием температуры при постоян-
ном объеме (закон Шарля), изобрёл
ряд приборов. Вслед за братьями
МОНГОЛЬФЬЕ Шарль построил воздушный шар с обо-лочкой из прорезиненной ткани, который первым напол-нил водородом. По имени изобретателя его назвали шарльером, а ученый совершил на нем несколько рекордных подъемов.
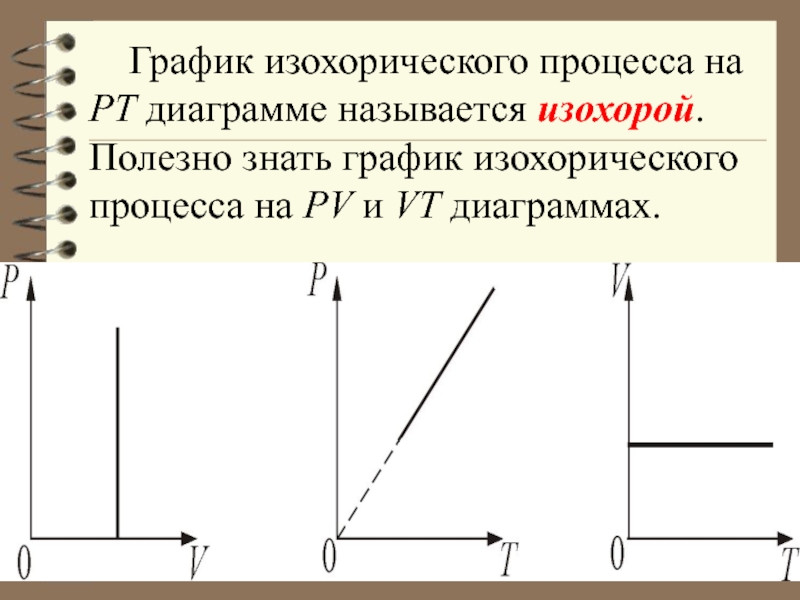
Слайд 40 График изохорического процесса на РТ диаграмме называется изохорой. Полезно знать
график изохорического процесса на РV и VT диаграммах.
Слайд 41 2. Изобарический процесс. Р = const. Изобарическим процессом называется
процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом
процессе подчиняется закону Гей-Люссака: V/T = const «При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным».Слайд 42 Жозеф Луи Гей-Люссак
(1778 - 1850)
Французский химик
и физик, член АН в Париже (1806). В 1802 Гей-Люссак открыл один из газовых законов – закон теплового расширения газов, позже названный его именем.
В 1804 совершил два полета на воздушном шаре (поднявшись на высоту 4 и 7 км), во время которых выполнил ряд научных исследований, в частности измерил температуру и влажность воздуха.
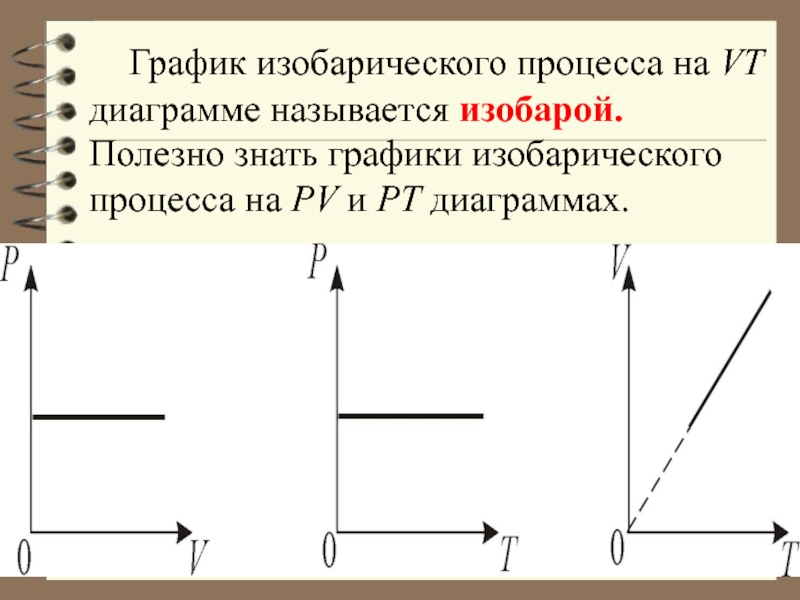
Слайд 43 График изобарического процесса на VT диаграмме называется изобарой. Полезно знать
графики изобарического процесса на РV и РT диаграммах.
Слайд 44 3. Изотермический процесс. T = const. Изотермическим процессом называется процесс,
протекающий при постоянной температуре Т. Поведение идеального газа при
изотермическом процессе подчиняется закону Бойля-Мариотта: РV = const «При постоянной температуре и неизменных значениях массы газа и его мо-лярной массы, произведение объёма газа на его давление остаётся постоянным». График изотермического процесса на РV – диаграмме называется изотермой.Слайд 45 Роберт Бойль (1627 — 1691 ) — английский
физик, химик и
богослов, один из учредителей Лондонского королевского общества.
Был
одним из первых ученых, которые систематически проводили исследования в области получения холода.Началом разработки холодильных машин можно, очевидно, считать открытие англичанином Робертом Бойлем и немецким физиком Отто фон Герике в конце XVII в. факта, что вода в вакууме испаряется при низких температурах.
Слайд 46МАРИОТТ Эдм (1620 - 1684) французский физик. Работы относятся к
механике, теплоте, оптике. В 1676 установил закон изменения объема данной
массы газа от давления при постоянной температуре (закон Бойля-Мариотта).Предсказал разнообразные применения этого закона, в частности расчет высоты местности по данным барометра.
Экспериментально подтвердил формулу Торричелли относительно скорости истечения жидкости, исследовал высоту подъема фонтанов, составил таблицы зависимости высоты подъема от диаметра отверстия. Изучал столкновение упругих тел, колебания маятника.
Слайд 484. Адиабатический процесс (изоэнтропийный). Процесс, происходящий без теплообмена с окружающей
средой. 5. Политропический процесс. Процесс, при котором теплоёмкость
газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.Слайд 496. Закон Авогадро.
При одинаковых давлениях и одинаковых температурах, в
равных объёмах различных идеальных газов содержится одинаковое число молекул.
В одном моле различных веществ содержится
молекул (число Авогадро).
Слайд 50Авогадро Амедео (1776 – 1856) – итальянский физик и химик.
Основные физические работы посвящены молекулярной физике. Уже первыми своими исследова-ниями
в этой области заложил основы молекулярной теории, выдвинув молекулярную гипотезу. Открыл важный для химии и физики закон, по которому в равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул (закон Авогадро). Исходя из этого закона, разработал метод определения молекулярного и атомного весов.Слайд 517. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных
давлений Р, входящих в неё газов
(Р1 – давление, которое оказывал бы определённый газ из смеси, если бы он занимал весь объём).Слайд 52Джон Дальтон
1766-1844
английский физик.
Изучение состава и свойств воздуха привело его
к открытию газовых законов:
- названный его именем, закон
независимости парциальных давлений компонентов смеси (1801);- за несколько месяцев до Гей-Люссака, он установил закон теплового расширения газов (1802);
- закон растворимости газов в жидкостях (1803).