Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
Содержание
- 1. ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
- 2. 3. БУФЕРНЫЕ СИСТЕМЫ. Состав буферных систем
- 3. 4. рН и рОН буферных систем Для
- 4. Так как сильные электролиты диссоциируют практически полностью,
- 5. Аналогично получим соотношение для вычисления концентрации ионов
- 6. 5. Влияние разбавления на рН буферных
- 7. 6. Буферная ёмкостьБуферная ёмкость раствора характеризует способность
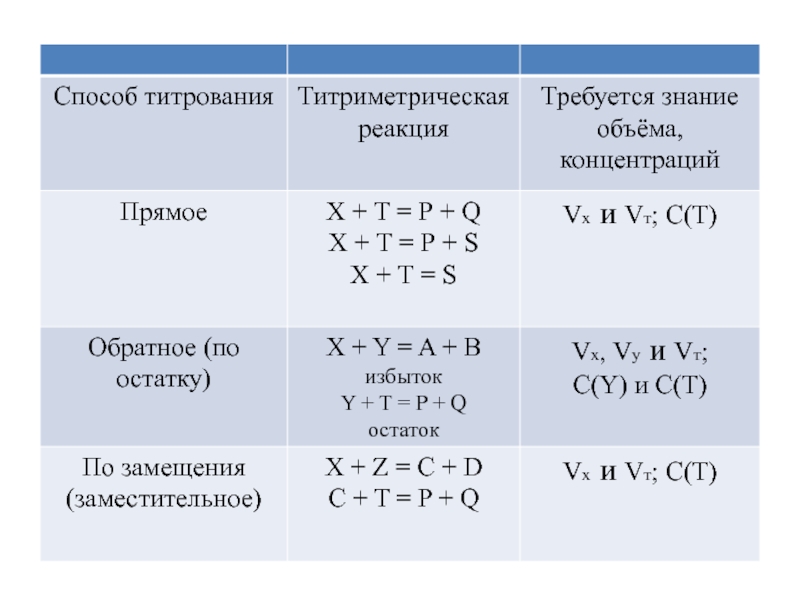
- 8. 7. Сущность титриметрического (объёмного) анализа. Титрование
- 9. Независимо от характера титрования знание точных объёмов
- 10. Реагент, добавляемый к анализируемому веществу (раствору), называют
- 11. -быть устойчивыми достаточно длительное время;- обеспечивать возможность
- 12. Любая титриметрическая реакция д.б.: селективной, стехиометричной, практически
- 13. 8. Основные приёмы титрованияТитриметрические методы дифферинцируют по
- 14. - индикаторное титрование – конечную точку титрования
- 15. По способу выполнения различают прямое и косвенное
- 16. Слайд 16
- 17. Обратным титрованием определяют содержание карбоната кальция в
- 18. (CH3)2CO + 6I2 + 4NaOH = CHI3
- 19. Образовавшуюся в результате обменной реакции щавелевую кислоту
- 20. 9. Основные методы титрования. 9.1. Метод
- 21. Титрование сильного электролита кислоты сильном электролитом щелочью.
- 22. Кривая титрования сильного электролита кислоты сильном электролитом щелочью (HCl + NaOH; 0,1 н. растворы)
- 23. Расчёт титрованияполкапли HCl - 0,02 мл.
- 24. Расчёт титрованияОколо точки эквивалентности объём титруемого раствора
- 25. Если под конец титрования подавать раствор из
- 26. 9.2. Индикаторы. метиловый оранжевый (рН < 7)
- 27. 9.3. Метод осаждения. аргентометрия
- 28. 9.4. Метод комплексообразования.
- 29. Для определения ряда катионов применяют специальный органический
- 30. 9.5. Метод окисления-восстановления. 9.5.1. Перманганатометрия. (Fe+2, C2O4-2,
- 31. Для определения ряда окислителей (K2Cr2O7, KСlO3, KMnO4,
- 32. 9.5.2. Иодометрия. Для определения восстановителей (As2O3,
- 33. 9.5.2. Иодометрия. Для определения окислителей (K2Cr2O7,
- 34. 10. Потенциометрическое титрование. При титровании того или
- 35. Потенциометрическое титрование применимо для целого ряда объемно-аналитических
- 36. Кроме того, потенциометрический метод титрования применяется в
- 37. Титрование кислот и щелочей. Для определения точки
- 38. Исследуемый раствор помещают в низкий стакан, в
- 39. Определив потенциал титруемого раствора, начинают титрование. Для
- 40. Точка перегиба полученной кривой будет совпадать с
- 41. При титровании такой смеси в конце титрования
- 42. 11. Кондуктометрическое титрование.Под кондуктометрическим титрованием понимают такой
- 43. Электропроводность – величина, обратная сопротивлению – пропорциональна
- 44. Изменение электропроводности раствора при его титровании происходит
- 45. Гидроксильные ионы при прибавлении соляной кислоты постепенно
- 46. Если титруется малодиссоциированное соединение, то электропроводность раствора
- 47. Для выполнения кондуктометрического титрования раствора едкого натра
- 48. Затем приливают из бюретки 1 мл кислоты.
- 49. После изменения направления передвижения контакта достаточно для
- 50. Результаты измерений затем наносят на график. При
- 51. Слайд 51
- 52. Скачать презентанцию
3. БУФЕРНЫЕ СИСТЕМЫ. Состав буферных систем Буферными называют растворы, одновременно содержащие слабую кислоту и ее соль (слабое основание и его соль) и обладающие свойством сохранять практически неизменной концентрацию ионов водорода
Слайды и текст этой презентации
Слайд 1ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
1. Ионное произведение воды.
Водородный и гидроксильный показатели.
Сильные и слабые
электролиты
Слайд 23. БУФЕРНЫЕ СИСТЕМЫ.
Состав буферных систем
Буферными называют растворы, одновременно содержащие
слабую кислоту и ее соль (слабое основание и его соль)
и обладающие свойством сохранять практически неизменной концентрацию ионов водорода при разбавлении, добавлении небольших количеств кислот или щелочей.Буферные растворы подразделяются на кислотные и основные.
Слайд 34. рН и рОН буферных систем
Для любой слабой кислоты НА:
Кдис.кисл.
= Н+ × А- / НА
Н+ = Ккисл × НА
/ А-При добавлении к раствору слабой кислоты раствора сильного электролита (соли этой кислоты) концентрация аниона А- значительно возрастает за счет диссоциации соли.
Слайд 4Так как сильные электролиты диссоциируют практически полностью, то концентрацию аниона
А- можно считать равной концентрации соли:
А- = соли.
Концентрацию
недиссоциированной части слабой кислоты можно приравнять к общей концентрации кислоты, пренебрегая очень малой долей распавшихся молекул:НА = кисл.
Отсюда: Н+ = Ккисл × кисл / соли
Слайд 5Аналогично получим соотношение для вычисления концентрации ионов ОН- в буферном
растворе, содержащем слабое основание и его соль:
ОН- = Косн ×
осн. / солиН+ = КН2О × соли / Косн × осн
Слайд 65. Влияние разбавления
на рН буферных систем
Т.к. при разбавлении буферного
раствора концентрация кислоты (основания) и соли изменяется одинаково, то рН
раствора не меняется.Незначительное изменение рН объясняется увеличением степени диссоциации кислоты (основания) при разбавлении.
Слайд 76. Буферная ёмкость
Буферная ёмкость раствора характеризует способность буферного раствора поддерживать
постоянное значение рН при добавлении кислоты или щелочи.
Буферную ёмкость
раствора выражают количеством кислоты или щёлочи, которое необходимо добавить к 1 л буферного раствора, чтобы понизить или повысить рН раствора на единицу. Добавление к буферному раствору кислоты понижает, а добавление щёлочи увеличивает рН раствора.
Буферная ёмкость раствора тем больше, чем выше концентрация его компонентов.
Слайд 87. Сущность титриметрического
(объёмного) анализа.
Титрование – непрерывно контролируемый процесс
постепенного, небольшими порциями добавления одного вещества к другому.
Методы анализа, в
основе которых лежит процесс титрования, называют титриметрическим.Обычно добавляют вещество, количество которого можно точно измерить, т.е. концентрация которого известна.
Слайд 9Независимо от характера титрования знание точных объёмов растворов двух веществ
при известной концентрации одного из них – необходимое и достаточное
условие успешного определения неизвестной концентрации другого.Момент, в который при титровании добавлено строго эквивалентное количество вещества, отвечающее стехиометрическому равновесию, называется точкой эквивалентности.
Слайд 10Реагент, добавляемый к анализируемому веществу (раствору), называют титрантом.
Обычно титранты это
растворы с точно известной концентрацией, называемые рабочими или стандартными.
Титранты независимо
от их агрегатного состояния должны:- легко и быстро приготавливаться;
- анализироваться простыми и общедоступными методами;
- растворяться (смешиваться) в необходимых соотношениях с титруемым раствором;
Слайд 11-быть устойчивыми достаточно длительное время;
- обеспечивать возможность необходимого количественного взаимодействия
с определяемым компонентом;
- быть окрашенными.
Реакции между добавляемым и анализируемым веществом
в процессе титрования условно называют титриметрическими лил реакциями титрования.К ним относятся реакции кислотно-основного взаимодействия, окисления-восстановления, комплексообразования и осаждения.
Слайд 12Любая титриметрическая реакция д.б.: селективной, стехиометричной, практически необратимой, достаточно быстрой,
обеспечивающей возможность быстрого и точного фиксирования точки эквивалентности.
Желательно, чтобы она
протекала в обычных условиях. Слайд 138. Основные приёмы титрования
Титриметрические методы дифферинцируют по типу титриметрической реакции,
способу фиксирования конечной точки титрования, способу титрования, природе растворителя.
В соответствии
с типом титриметрической реакции различают методы кислотно-основного, окислительно-восстановительного, комплексообразовательного и осадительного титрования.По способу определения (индикации) конца титрования выделяют:
Слайд 14- индикаторное титрование – конечную точку титрования устанавливают по изменению
какого-либо визуально наблюдаемого свойства раствора (окраски индикатора, появление или исчезновение
мути, свечения и т.п.).- безиндикаторное титрование – конечную точку титрования устанавливают по изменению какого-либо измеряемого физико-химического свойства раствора (электродного потенциала, электропроводности и т.п.).
Слайд 15По способу выполнения различают прямое и косвенное титрование:
При прямом определяемый
компонент непосредственно титруют подходящим рабочим раствором,
при косвенном титруют не
сам определяемый компонент, а продукт его взаимодействия со специально добавленным веществом (метод замещения) или избыток такого специально добавленного вещества, который остаётся по завершении его взаимодействия с определяемым компонентом (метод обратного титрования).Слайд 17Обратным титрованием определяют содержание карбоната кальция в известняке. Для этого
к навеске минерала добавляют точно известный объём стандартного раствора соляной
кислоты. По окончании реакции остаток непрореагировавшей кислоты оттитровывают раствором щёлочи известной концентрации.Используя указанный способ можно йодометрически определить ацетон. Для этого к раствору, содержащему ацетон, добавляют щёлочь и йод, в количестве большем, чем требуется для полного протекания реакции. Избыток оставшегося после реакции йода титруют стандартным раствором тиосульфата натрия.
Слайд 18(CH3)2CO + 6I2 + 4NaOH = CHI3 + 3NaI +
CH3COONa + 3H2O
I2 + 3Na2S2O3 = Na2S4O6 + 2NaI
Примером титрования
по замещению может служить перманганатометрическое определение вещества, не обладающего восстановительными свойствами. Так, при определении кальция в раствор его соли вводят оксалат-ион. Образовавшийся осадок оксалата кальция растворяют в растворе соответствующей кислоты.
Слайд 19Образовавшуюся в результате обменной реакции щавелевую кислоту оттитровывают стандартным раствором
перманганата калия.
CaCl2 + Na2C2O4 = CaC2O4 + 2NaCl
CaC2O4 + H2SO4
= CaSO4 + H2C2O45H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O
Слайд 209. Основные методы титрования.
9.1. Метод нейтрализации
H2SO4, HCl, H3PO4, CH3COOH,
H2C2O4, KOH, Ca(OH)2
Na2CO3, NaHCO3, Na3PO4, Na2HPO4, NH4Cl).
Реакция нейтрализации: H+
+ OH- H2O,H++ CH3COO- CH3COOH
индикатор (метиловый оранжевый, фенолфталеин и др.).
ионообменные смолы или «иониты»
катионит анионит.
KCl + HR HCl + KR
раствор катионит раствор катионит
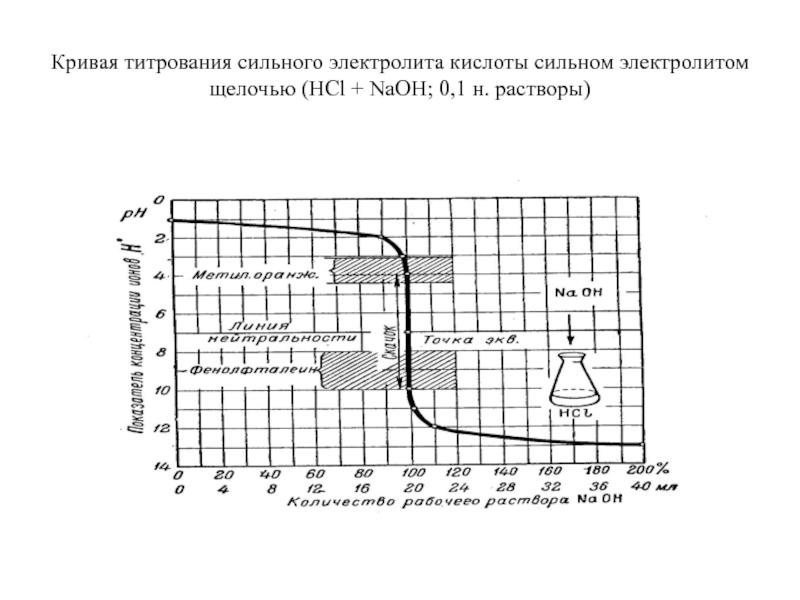
Слайд 22Кривая титрования сильного электролита кислоты сильном электролитом щелочью (HCl +
NaOH; 0,1 н. растворы)
Слайд 23Расчёт титрования
полкапли HCl - 0,02 мл.
рН = 4.
рОН = 4 и рН = 14 – 4 = 10.
скачок титрования.
В данном случае скачок выражается изменением рН на 6 единиц при изменении количества рабочего раствора на 0,2 % (от недостатка его 0,1 % до такого же избытка, т.е. от – 0,1 % до + 0,1 %).
Слайд 24Расчёт титрования
Около точки эквивалентности объём титруемого раствора будет не 20
мл, а 20 + 20 = 40 мл за счёт
добавленных 20 мл NaOH.Поэтому концентрация Н+ будет, например, при 99,9 % NaOH не 10-4, как получалось выше, а , и рН = 4,3 (lg0,5 = -0,3), а не 4.
Таким образом, точнее, скачок титрования 0,1 н растворов будет от 4,3 до 9,7; скачок же титрования от 4 до 10 соответствует титрованию 0,2 н. раствора HCl 0,2 н раствором NaOH.
Слайд 25Если под конец титрования подавать раствор из бюретки не целыми
каплями, а долями их, или титровать более разбавленными растворами, то
скачок титрования будет не так широк. Например, скачок от прибавления полукапли будет выражаться изменением рН не от 4,3 до 9,7, а от 4,6 до 9,4.При титровании 0,01 н растворами скачок будет наблюдаться в интервале от 5,3 до 8,7.
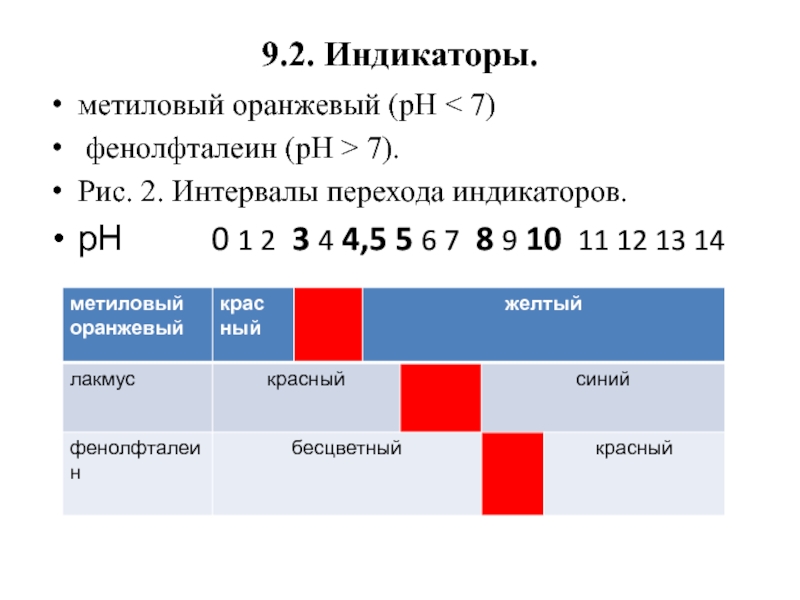
Слайд 269.2. Индикаторы.
метиловый оранжевый (рН < 7)
фенолфталеин (рН >
7).
Рис. 2. Интервалы перехода индикаторов.
рН
0 1 2 3 4 4,5 5 6 7 8 9 10 11 12 13 14Слайд 279.3. Метод осаждения.
аргентометрия
Ag+ + Cl- AgCl
ионы: Cl-, Br-, J-, Ag+, CN-, CNS-, PO-34, и т.п.
меркурометрия
K2Zn3Fe(CN)62, (UO2)NH4PO4, BaSO4.
Слайд 289.4. Метод комплексообразования.
2CN-
+ Ag+ Ag(CN)2-;при незначительном избытке ионов Ag+ образуется осадок
Ag(CN)2- + Ag+ 2AgCN.
Образованием комплексных цианистых соединений пользуются при определении Cu+2, Hg+2 и т.п. Образование неонизированных соединений двухвалентной ртути HgCl2, Hg(CNS)2 и т.п. используется при определении Cl-, Br-, CN-, CNS- (меркуриметрия); точка эквивалентности этих реакций обнаруживается с помощью чувствительного реактива на Hg+2 - нитропруссида натрия (при титровании CNS- индикатором может служить Fe+3).
Слайд 29Для определения ряда катионов применяют специальный органический реактив «комплексон», являющийся
производным уксусной кислоты и этилендиамина
(H2N – CH2 – CH2 –
NH2). Этот реактив образует очень прочные недиссоциированные и хорошо растворимые с Ca+2, Mg+2 и другими двухвалентными катионами.
Слайд 309.5. Метод окисления-восстановления.
9.5.1. Перманганатометрия.
(Fe+2, C2O4-2, NO2-, CNS-);
Для
определения Ca+2 применяют реакцию его с C2O4-2; перманганатом оттитровывают ионы
C2O4-2 либо связавшиеся с Ca+2 в осадок (титрование замещающегося вещества), либо оставшиеся после реакции в избытке (обратное титрование).
Таким методом определяют главным образом элементы II и III групп периодической системы – Ca, Sr, Ba, Zn, Cd, Ce, La, а также Cu, Ag, Pb, Bi, Ni.
Слайд 31Для определения ряда окислителей (K2Cr2O7, KСlO3, KMnO4, Na3VO4 и т.п.)
методом перманганатометрии используется прием обратного титрования.
Для этого к окислителю
прибавляют в избытке измеренное количество раствора FeSO4 (или соли Мора) и затем остаток Fe+2 оттитровывают раствором перманганата. Эти же реакции могут служить и для определения хрома и марганца, так как Cr+3 и Mn+2 могут быть предварительно окислены например, посредством (NH4)2S2O8 до Cr2O7-2 или MnO4-.
Таким методом определяют, например, хром и марганец в стали.
Слайд 329.5.2. Иодометрия.
Для определения восстановителей (As2O3, H2S, SO2, Sn+2) применяют
реакции окисления их йодом.
Темнобурый рабочий раствор йода при реакции титрования
обесцвечивается восстановителем, так как свободный йод переходит в анион йода S-2 + J2 2J- + S
В точке эквивалентности обесцвечивание прекращается (ничтожный избыток йода в присутствии крахмала окрашивает раствор в синий цвет).
Слайд 339.5.2. Иодометрия.
Для определения окислителей (K2Cr2O7, KMnO4, KJO3, FeCl3) иодометрическим
методом применяют титрование замещающего вещества: к раствору окислителя прибавляют избыток
KJ и оттитровывают выделившийся йод тиосульфатом.Слайд 3410. Потенциометрическое титрование.
При титровании того или иного иона изменению его
концентрации соответствует изменение потенциала на электроде, погружённом в титруемый раствор.
Около
точки эквивалентности происходит скачок потенциала.Это позволяет вести титрование с помощью потенциометра. Таким образом электрод является в данном случае как бы индикатором и носит название индикаторного электрода, а сам метод титрования называется потенциометрическим методом титрования.
Слайд 35Потенциометрическое титрование применимо для целого ряда объемно-аналитических определений, решаемых методом
нейтрализации, окислительно-восстановительными методами или методами осаждения. Область применения потенциометрического титрования
велика. Особенно большое удобство способ потенциометрического титрования представляет для тех случаев, когда приходится вести титрование сильно окрашенных или мутных жидкостей. В этих случаях обычные индикаторные методы не приемлемы.Слайд 36Кроме того, потенциометрический метод титрования применяется в тех случаях, когда
для обычного титрования не удается найти достаточно чувствительный индикатор, изменяющий
окраску около точки эквивалентности. Потенциометрическим методом удобно определять несколько точек эквивалентности при титровании раствора, содержащего несколько веществ.Слайд 37Титрование кислот и щелочей.
Для определения точки эквивалентности титрования кислоты или
щелочи можно применять в качестве индикаторного электрода любой из электродов:
водородный, хингидронный и стеклянный.Хингидронный электрод можно применять при рН не более 8,5, но нельзя применять при титровании сильных и слабых оснований.
Схемы включения приборов такие же, как и при измерении рН.
Слайд 38Исследуемый раствор помещают в низкий стакан, в который погружают электрод,
или другой ему подобный, и одно плечо электролитического мостика. Иногда
стакан снабжают мешалкой, вместо которой во многих случаях можно применять размешивание стеклянной палочкой от руки.Другое плечо электролитического мостика соединяют с каломелевым или хингидронным электродами. Над стаканчиком укрепляют бюретку с рабочим раствором кислоты или щелочи.
Слайд 39Определив потенциал титруемого раствора, начинают титрование. Для этой цели спускают
каждый раз из бюретки в титруемую жидкость определенное количество рабочего
раствора (0,5 – 2,0 мл). После прибавления размешивают в течение 2 - 3 мин. и затем делают отсчет разности потенциалов.Около точки эквивалентности рабочий раствор добавляют меньшими порциями (0,1 – 0,05 мл). Полученные данные наносят на оси координат: на абсциссу – миллилитры рабочего раствора, на ординату – рН или потенциал. Получаемые при этом кривые совершенно аналогичны кривым объемного анализа.
Слайд 40Точка перегиба полученной кривой будет совпадать с точкой эквивалентности. Особенно
резко перегиб кривой замечается при титровании сильных кислот сильными основаниями.
Значительно менее ясно он выступает при титровании слабых кислот и слабых оснований. При титровании смеси сильной и слабой кислот вначале титруется сильная кислота, затем слабая. Резкого перелома в конце титрования сильной кислоты не замечается, так как после него идет титрование слабой кислоты и поэтому сглаживается резкость скачка, который наблюдается при титровании сильной кислоты в отсутствие слабой.Слайд 41При титровании такой смеси в конце титрования сильной кислоты наблюдается
только небольшой перегиб кривой рН, который соответствует концу титрования сильной
кислоты и началу титрования слабой. Такой же ход кривой рН наблюдается для случая титрования смеси слабого и сильного оснований сильной кислотой.Слайд 4211. Кондуктометрическое титрование.
Под кондуктометрическим титрованием понимают такой метод количественного электрообъмного
анализа, при котором точку эквивалентности определяют по электропроводности раствора.
Такой
метод титрования позволяют довольно точно определить малые концентрации вещества, так как именно для них электропроводность сильно зависит от концентрации. Слайд 43Электропроводность – величина, обратная сопротивлению – пропорциональна общей концентрации катионов
и анионов, их валентности и их подвижности.
Подвижность иона зависит главным
образом от его размера (от диаметра гидратированного иона) и от вязкости растворителя. Для большинства ионов подвижности мало различаются и в водных растворах равны около 50; от этой величины значительно отличаются подвижность ионов ОН- - 180 и Н+ - 320. Слайд 44Изменение электропроводности раствора при его титровании происходит как за счет
изменения концентрации ионов, так и за счет замены ионов, имеющих
одну подвижность, ионами с другой подвижностью.Таким способом можно титровать щелочь кислотой (например, NaOH соляной кислотой)
(Na+ + OH-) + (H+ + Cl-) = Na+ + Cl- + H2O.
При этой реакции ион гидроксила связывается ионом водорода в практически недиссоцииро-ванную воду. Едкий натр, кроме катионов Na+, остающихся при реакции неизменными, содержит подвижные ионы гидроксила.
Слайд 45Гидроксильные ионы при прибавлении соляной кислоты постепенно исчезают, соединяясь с
водородными катионами, и замещаются медленно передвигающимися анионами Cl-, вследствие чего
электропроводность постепенно уменьшается. Как только количества щелочи и кислоты станут эквивалентными, прибавляемая в дальнейшем кислота перестанет нейтрализоваться, и быстро движущиеся катионы водорода, увеличиваясь в концентрации, будут увеличивать электропровод-ность. В нейтральной точке, поэтому величина электропроводности имеет минимум, следователь-но, последний как раз и показывает конец титрования.Слайд 46Если титруется малодиссоциированное соединение, то электропроводность раствора возрастает с самого
начала. Обычно изменения электропроводности выражается двумя прямыми, пересекающимися в точке
эквивалентности.При кондуктометрическом титровании точка эквивалентности определяется обычно с точностью в 0,5 – 1 %.
Изменение температуры сильно влияет на электропроводность (25% на 10), поэтому во время титрования необходимо поддерживать постоянную температуру.