Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТНиС 03
Содержание
- 1. ТНиС 03
- 2. Теплоемкости газов Теплоемкость – это теплота, которую
- 3. Соотношения между теплоемкостями где Q – теплота,
- 4. Теплоемкости смесей газов Чтобы повысить температуру смеси
- 5. Массовая, объемная и мольная теплоемкости Учтем, что:
- 6. I закон термодинамики для изохорного и
- 7. Теплоемкости cp и cv В изобарном процессе
- 8. Показатель адиабаты А отношение теплоемкостей cp и
- 9. Истинная теплоемкость На графике
- 10. Средняя теплоемкость двухатомных газов Теплота, подведенная
- 11. Определение теплоемкостей по формулам и таблицам
- 12. Табличные теплоемкости Теплоту, подведенную к газу
- 13. Средние мольные теплоемкости (μс)р, кДж/(кмоль·К)Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
- 14. Термодинамическая поверхность идеального газа T1>T2>T3T1=constT2=constT3=constpvTp=constv=constpvvTp1>p2>p3p1=constp2=constp3=constТеплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
- 15. Термодинамическая поверхность воды ОбластьсублимацииvВлажный парТрПерегретыйпарЛедОбластьплавленияВодаvкp=constpк=constT=constTк=constКрк=221,2 барtк=374,12
- 16. Термодинамические процессы Изохорный – процесс при неизменном
- 17. Исследование термодинамических процессов Чтобы выявить
- 18. Методика исследования термодинамических процессов 5. Находится
- 19. Исследование изохорного процесса 1.
- 20. Изохорный процесс 4. Изменение внутренней энергии: Δu=cvΔT. 5. Работа
- 21. Исследование изобарного процесса 1.
- 22. Изобарный процесс 4. Изменение внутренней энергии: Δu=cvΔT.
- 23. Преобразование выражения I закона термодинамики Запишем
- 24. Параметр состояния энтальпия Тогда можно записать аналитическое
- 25. Исследование изотермического процесса
- 26. Исследование изотермического процесса 4. Изменение внутренней энергии:
- 27. Исследование адиабатного процесса Уравнение адиабаты выводится из
- 28. Преобразования выражения I закона термодинамикиС учетом
- 29. Уравнение адиабатного процесса После приведения подобных членов
- 30. pv-диаграмма адиабатного процесса
- 31. Соотношения между параметрами3. Соотношения между p и
- 32. Внутренняя энергия и работа газа Подставляем (2)
- 33. Теплота и работа Окончательно работа газа, Дж/кг:
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ТНиС 03
● Теплоемкости газов
● Термодинамические процессы
Теплоносители и их свойства ©
Шаров Ю. И. © НГТУ, 2014
Слайд 2Теплоемкости газов
Теплоемкость – это теплота, которую надо подвести
к
единичному количеству вещества, чтобы увеличить его
температуру на
1 К.Различают теплоемкости:
● массовую c, Дж/(кг·К) – Q=mcΔT;
● объемную c’, Дж/(м³·К) – Q=V0c’ΔT;
● мольную (μс), Дж/(кмоль·К) – Q=M(μс)ΔT,
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 3Соотношения между теплоемкостями
где Q – теплота, Дж;
m –
масса газа, кг;
V0 – объем газа при нормальных физических
условиях, м³;
M – число кило молей газа.
Соотношения между теплоемкостями:
c=(μс)/μ;
c’=(μс)/(μv)0=(μс)/22,4;
c’=cρ0.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 4Теплоемкости смесей газов
Чтобы повысить температуру смеси газов на
ΔT К, надо
на столько же нагреть каждый из ее
компонентов:; .
Поделим:
каждое уравнение на ΔT;
левое выражение на массу смеси m;
правое – на объем смеси при нормальных условиях V0.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 5Массовая, объемная и мольная теплоемкости
Учтем, что:
mi /m=gi –
массовая доля компонента;
V0i /V0=ri – объемная доля компонента.
Тогда соответственно массовая, объемная и мольная теплоемкости смеси:
; ; .
Два последних выражения похожи, так как мольная
и объемная доли равнозначны.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 6I закон термодинамики
для изохорного и изобарного процессов
Запишем выражение I закона термодинамики для этих
случаев:
при v=Const: dqv=du=cvdT;
при p=Const:
dqp=du+pdv=cvdT+RdT=cpdT.
В изохорном процессе подведенная теплота расходуется
только на изменение внутренней энергии газа.
dqp
dqv
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 7Теплоемкости cp и cv
В изобарном процессе подведенная теплота
расходуется
на изменение внутренней энергии газа и на совершение
работы
против внешних сил. Сократив на dT последнее равенство, получим соотношение
между этими теплоемкостями (уравнение Майера):
для 1 кг газа – cp=cv+R
для 1 кмоля газа – (μcp)=(μcv)+(μR).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 8Показатель адиабаты
А отношение теплоемкостей cp и cv– показатель адиабаты:
k=cp /cv.
Одноатомные газы: k=1,67;
двухатомные газы: k=1,41;
трех- и многоатомные газы: k=1,29.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
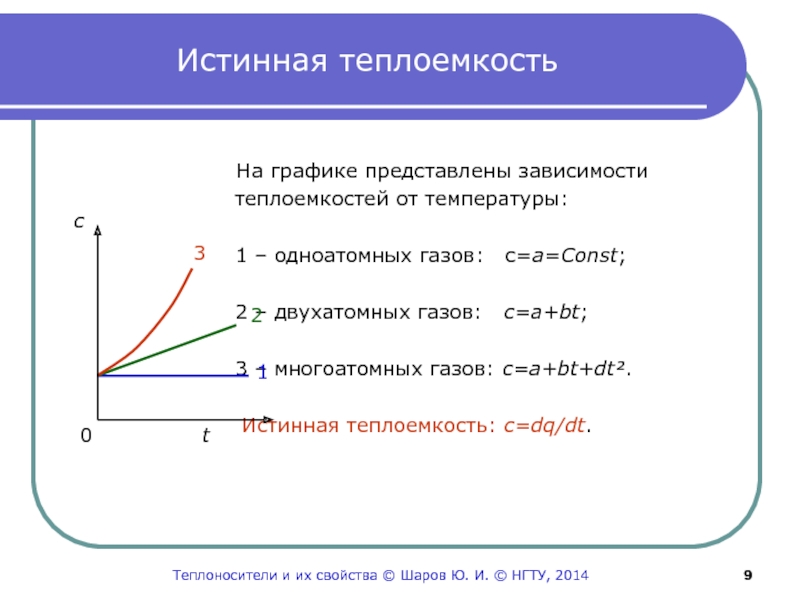
Слайд 9Истинная теплоемкость
На графике представлены зависимости
теплоемкостей от температуры:
1 – одноатомных газов: c=a=Const;
2 – двухатомных газов: c=a+bt;
3 – многоатомных газов: c=a+bt+dt².
Истинная теплоемкость: c=dq/dt.
с
0 t
1
2
3
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 10Средняя теплоемкость
двухатомных газов
Теплота, подведенная к двухатомному газу,
запишется
как dq=cdt, или в интегральном виде:
.
С учетом
того, чтоt22 – t12 = (t2 – t1)(t2 + t1),
средняя теплоемкость:
cm t1t2=a+b(t1 + t2)/2.
с
0
1
2
t
4
3
q
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 11Определение теплоемкостей
по формулам и таблицам
На предыдущих слайдах
были приведены формулы
истинных и средних теплоемкостей газов, в которых
константы a, b, d для каждого газа можно найти в
справочниках.
В справочниках также приводятся посчитанные по этим
формулам значения истинных (при температуре t) и
средних теплоемкостей разных газов в диапазоне
температур от 0 до t.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
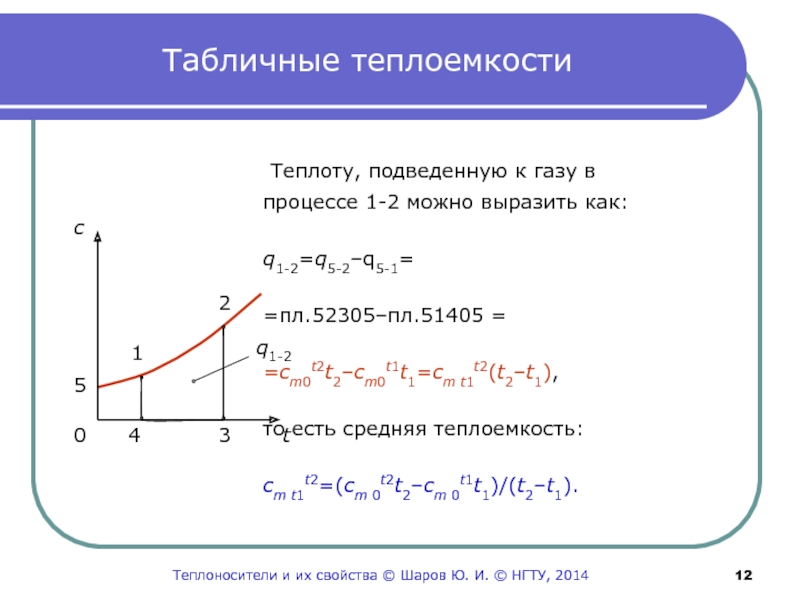
Слайд 12Табличные теплоемкости
Теплоту, подведенную к газу в
процессе 1-2 можно выразить как:
q1-2=q5-2–q5-1=
=пл.52305–пл.51405 =
=cm0t2t2–cm0t1t1=cm t1t2(t2–t1),
то есть средняя теплоемкость:
cm t1t2=(cm 0t2t2–cm 0t1t1)/(t2–t1).
с
0 4 3 t
1
2
5
q1-2
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
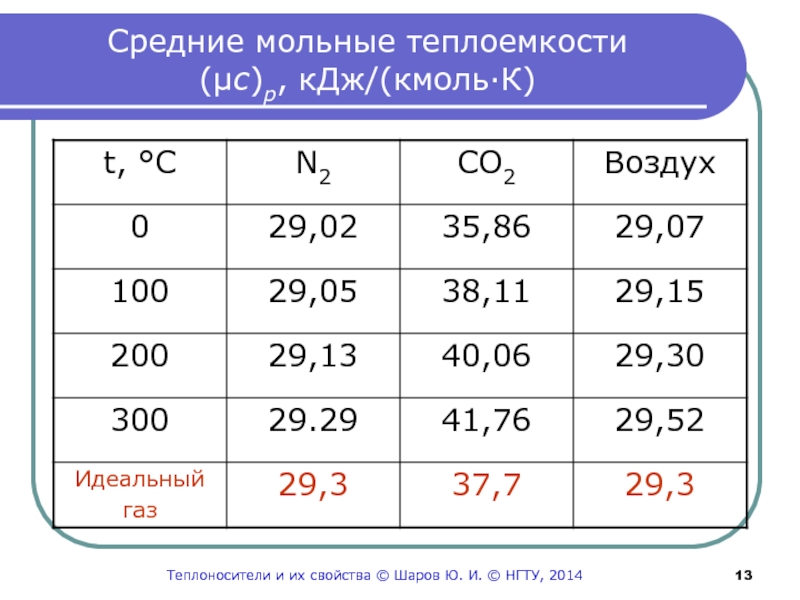
Слайд 13Средние мольные теплоемкости
(μс)р, кДж/(кмоль·К)
Теплоносители и их свойства © Шаров Ю.
И. © НГТУ, 2014
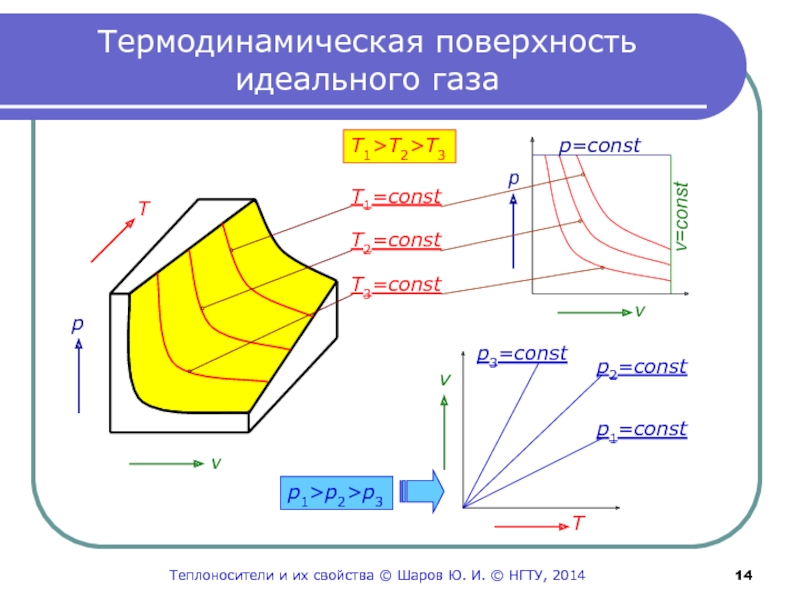
Слайд 14Термодинамическая поверхность идеального газа
T1>T2>T3
T1=const
T2=const
T3=const
p
v
T
p=const
v=const
p
v
v
T
p1>p2>p3
p1=const
p2=const
p3=const
Теплоносители и их свойства ©
Шаров Ю. И. © НГТУ, 2014
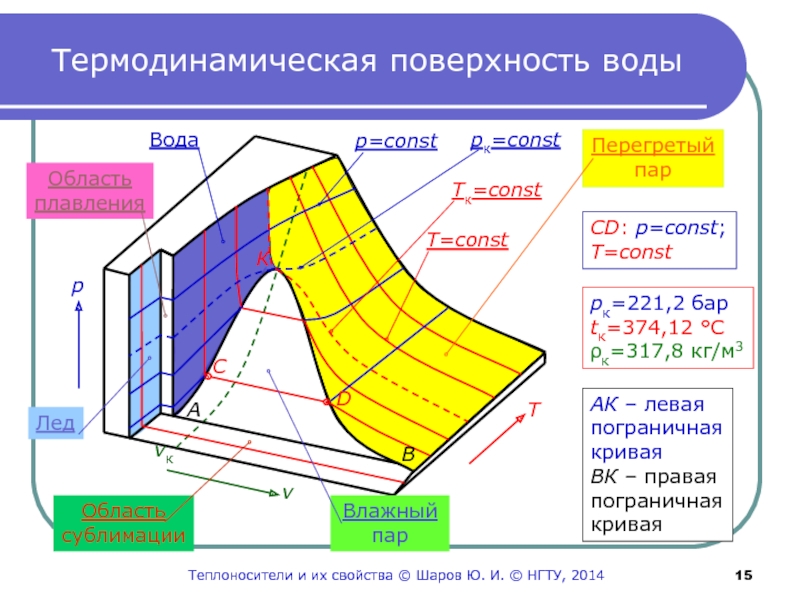
Слайд 15Термодинамическая поверхность воды
Область
сублимации
v
Влажный
пар
Т
р
Перегретый
пар
Лед
Область
плавления
Вода
vк
p=const
pк=const
T=const
Tк=const
К
рк=221,2 бар
tк=374,12 °С
ρк=317,8 кг/м3
А
В
АК –
левая
пограничная
кривая
ВК – правая
пограничная
кривая
С
D
СD: p=const;
T=const
Теплоносители и их свойства © Шаров Ю.
И. © НГТУ, 2014Слайд 16Термодинамические процессы
Изохорный – процесс при неизменном объеме газа:
v=сonst.
Изобарный – при постоянном давлении газа:
p=сonst.
Изотермический – при постоянной температуре газа: T=сonst.
Адиабатный – без теплообмена между газом и
окружающей средой:
q=0.
Политропный – процесс без ограничений.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 17Исследование
термодинамических процессов
Чтобы выявить основные закономерности изменения
состояния
газа и особенностей превращения энергии,
выполняется исследование термодинамических процессов
по
единой методике:1. Выводится уравнение процесса;
2. Приводится pv-диаграмма процесса;
3. Выводятся соотношения между параметрами p,v,T;
4. Определяется изменение внутренней энергии газа по
единой формуле, Дж/кг:
Δu=cvΔT;
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 18Методика исследования
термодинамических процессов
5. Находится работа газа против внешних
сил .
6. Определяется теплота,
подведенная к газу:● по I закону термодинамики
q=Δu+l;
● или через теплоемкость
q=c(t2-t1),
где c – массовая теплоемкость газа в данном процессе;
7. Находится энергетический коэффициент φ=Δu/q,
показывающий долю теплоты, затраченной на изменение
внутренней энергии.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 19Исследование изохорного процесса
1. Уравнение v=сonst.
2. pv-диаграмма.
3. Соотношения между p,v,T –
из уравнения Клапейрона:
p1v=RT1 и p2v=RT2:
p1/T1=p2/T2 или p/T=сonst.
p
0 v v
(p1,T1)
(p2,T2)
1
2
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 20Изохорный процесс
4. Изменение внутренней энергии: Δu=cvΔT.
5. Работа ,
так как v=сonst.
6. Теплота: из I закона термодинамики –
q=Δu; или через теплоемкость – q=cvΔT.
7. Энергетический коэффициент: φ=Δu/q=1.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 21Исследование изобарного процесса
1. Уравнение p=сonst.
2. pv-диаграмма.
3. Соотношения между
p,v,T – из уравнения Клапейрона
pv1=RT1 и pv2=RT2:
v1/T1=v2/T2 или v/T=сonst.
p
0 v1 v2 v
1(p,v1) 2(p,v2)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 22Изобарный процесс
4. Изменение внутренней энергии: Δu=cvΔT.
5. Работа:
=p(v2-v1)=R(T2-T1).
6. Теплота: из I закона термодинамики –
q=Δu+l или через теплоемкость – q=cpΔT.
7. Энергетический коэффициент:
φ=Δu/q=cvΔT/cpΔT=1/k.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 23Преобразование выражения
I закона термодинамики
Запишем выражение I закона
термодинамики и преобразуем
его следующим образом:
dq=du+pdv+vdp-vdp=
=du+d(pv)-vdp=d(u+pv)-vdp.
Обозначим (u+pv)=h и назовем ее энтальпией, Дж/кг. Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 24Параметр состояния энтальпия
Тогда можно записать аналитическое выражение I
закона
термодинамики через энтальпию:
dq=dh-vdp.
Здесь h=u+pv=cvT+RT=(cv+R)T=cpT,
то есть
энтальпия – это теплота, необходимая для нагревания 1 кг газа от 0 до Т, К в изобарном процессе.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 25Исследование изотермического процесса
1. Уравнение T=сonst.
2. pv-диаграмма.
3. Соотношения между p,v,T
– из уравнения Клапейрона
p1v1=RT и p2v2=RT:
p1v1=p2v2 или pv=сonst.
P
0 v1 v2 v
p1
p2
1(p1,v1)
2(p2,v2)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 26Исследование изотермического процесса
4. Изменение внутренней энергии:
Δu=cvΔT=0.
Подстановка для
работы pv=p1v1; p=p1v1/v.
5. Работа:
.
6. Теплота:
из I закона термодинамики:q=l=RTln(p1/p2).
7. Энергетический коэффициент: φ=Δu/q=0.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 27Исследование адиабатного процесса
Уравнение адиабаты выводится из I закона термодинамики:
dq=0=du+pdv или cvdT+pdv=0.
Сделаем подстановку из уравнения Клапейрона:
pv=RT;
T=pv/R; dT=(pdv+vdp)/R.После подстановки имеем: cv(pdv+vdp)/R+pdv=0.
Умножим полученное выражение на R/cv:
pdv+vdp+Rpdv/cv=0.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 28Преобразования выражения
I закона термодинамики
С учетом уравнения Майера R=cp-cv:
pdv+vdp+(cp-cv)pdv/cv=0.
Или с учетом показателя адиабаты cp/cv=k:
pdv+vdp+(k-1)pdv=0.
После
приведения подобных членов и сокращения имеем: vdp+kpdv=0.
Разделим переменные, поделив уравнение на pv:
dp/p+kdv/v=0.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 29Уравнение адиабатного процесса
После приведения подобных членов и сокращения имеем:
vdp+kpdv=0.
Разделим переменные, поделив уравнение на pv:
dp/p+kdv/v=0.
После интегрирования при k=сonst: lnp+klnv=сonst
или ln(pvk)=ln(сonst).
После потенцирования получаем уравнение адиабатного
процесса:
pvk=сonst.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 30pv-диаграмма адиабатного процесса
2. pv-диаграмма.
Легко доказать, что адиабата идет
круче изотермы.
При p1=idem, p2=idem:
v2T/v1=p1/p2; (v2a/v1)k=p1/p2;
v2a/v1=(p1/p2)1/k.
При k=1,67-1,29 для газов
(p1/p2)1/k
P
0 v1 v2a v2T v
p1
p2
1(p1,v1)
pv = Const
pvk = Const
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 31Соотношения между параметрами
3. Соотношения между p и v из уравнения
процесса:
p1v1k=p2v2k: p2/p1=(v1/v2)k; (1)
(p2/p1)1/k=v1/v2 . (2)
Из уравнения Клапейрона
p1v1=RT1;
p2v2=RT2; или (p2/p1)v2/v1=T2/T1 . (3)
Подставляем (1) в (3): (v1/v2)k(v1/v2)-1=T2/T1,
получаем соотношение между v и T: T2/T1=(v1/v2)k-1 . (4)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 32Внутренняя энергия и работа газа
Подставляем (2) в (3): (p2/p1)(p2/p1)-1/k=T2/T1,
получаем соотношение между p и T: T2/T1=(p2/p1)(k-1)/k. (5)
4. Изменение внутренней
энергии: Δu=cvΔT. 5. Для работы нужна подстановка: p1v1k=pvk; p=v-kp1v1k.
Итак, работа газа с учетом p1v1k=p2v2k:
.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 33Теплота и работа
Окончательно работа газа, Дж/кг:
l=(p1v1-p2v2)/(k-1); l=(T1-T2)R/(k-1).
6. Теплота по I закону термодинамики:
q= 0=Δu+l ,
то есть работа газа в адиабатном процессе совершается за
счет уменьшения его внутренней энергии:
l=-Δu.
7. Энергетический коэффициент:
φ=Δu/q=Δu/0=∞.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014