Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТНиС 05
Содержание
- 1. ТНиС 05
- 2. Реальные газы В реальных газах молекулы представляют
- 3. К выводу уравнения Ван-Дер-Ваальса Обозначим собственный объем
- 4. Константа Ван-Дер-Ваальса Давление – это результат
- 5. Уравнение Ван-Дер-Ваальса Итак, уравнение состояния реальных газов
- 6. Уравнение состояния реальных газов Более
- 7. Термодинамическая поверхность воды ОбластьсублимацииvВлажный парТрПерегретыйпарЛедОбластьплавленияВодаvкp=constpк=constT=constTк=constКрк=221,2 барtк=374,12
- 8. Парообразование на поверхности воды (испарение) Испарение –
- 9. Воздушно-испарительное охлаждение При вылете из воды самых
- 10. Парообразование во всем объеме воды (кипение) Когда
- 11. Конденсация пара. Насыщенный пар При охлаждении пара
- 12. Влажный насыщенный пар При неполном испарении воды
- 13. Водяной пар Водяной пар является рабочим телом
- 14. рv-диаграмма водяного пара aa’
- 15. К pv-диаграмме Слева от пограничной кривой
- 16. Процессы и состояния воды и пара точка
- 17. pt-диаграмма В pt -диаграмме процессы изменения
- 18. Тройная точка воды Линия АВ – зависимость
- 19. Возгонка или сублимация. Параметры состояния Если лед нагревать при p
- 20. Теплота нагрева воды до температуры насыщения
- 21. Изменение энтропии Увеличение энтропии воды в изобарном
- 22. Парообразование Изобарно-изотермическое парообразование происходит в точке «b»,
- 23. Энтальпия и энтропия воды и пара В
- 24. Влажный пар Удельный объем влажного пара находится
- 25. Перегрев пара Теплота перегрева пара до температуры
- 26. Энтропия перегретого пара Изменение энтропии при перегреве
- 27. К Ts-диаграмме Начало отсчета параметров состояния:
- 28. Ts-диаграмма водяного пара В тепловой Ts-диаграмме площади
- 29. hs-диаграмма водяного пара
- 30. Расчеты процессов водяного пара В практических расчетах
- 31. Таблицы термодинамических свойств воды и водяного
- 32. Внутренняя энергия В таблицах и диаграммах нет
- 33. Влажный пар Параметры состояния влажного пара находятся
- 34. Простейшая схема паротурбинной установки с турбиной типа
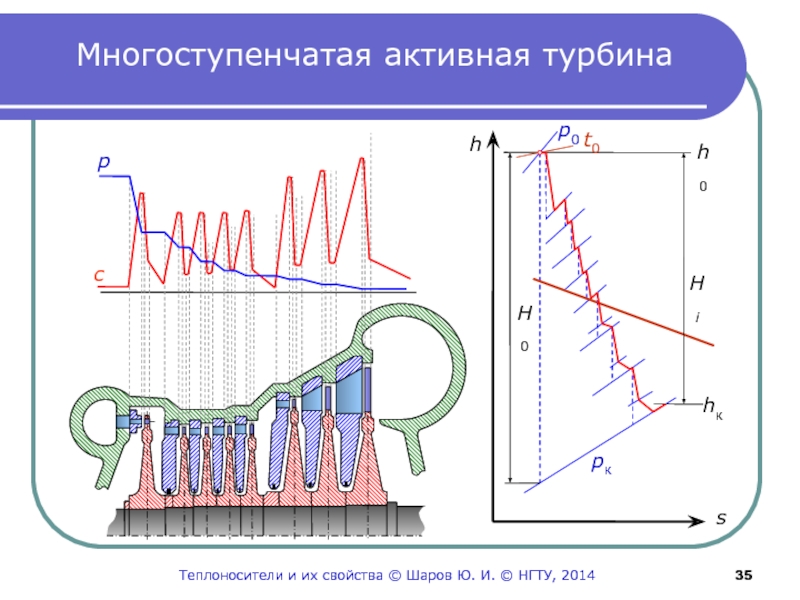
- 35. Многоступенчатая активная турбинаpсst0Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
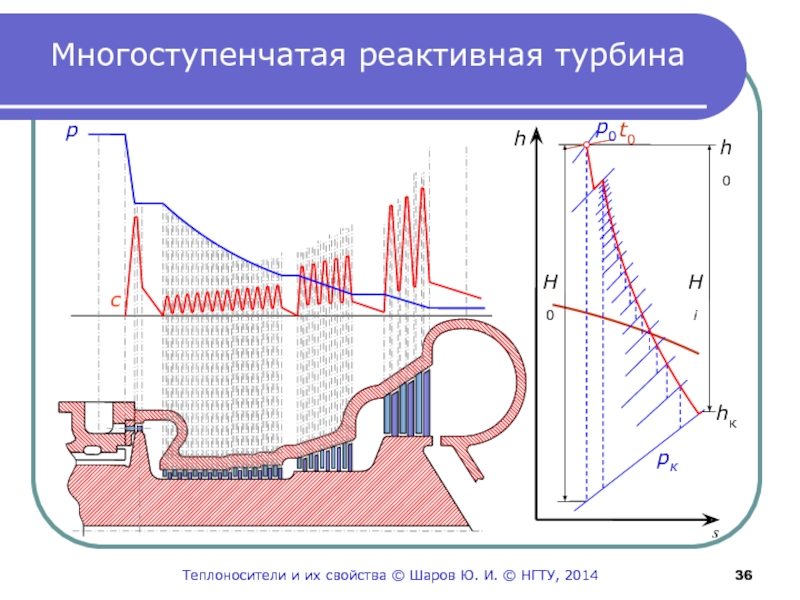
- 36. Многоступенчатая реактивная турбинаpсТеплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
- 37. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ТНиС 05
● Реальные газы
● Уравнения состояний
● Тройная точка воды
Теплоносители
и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 2Реальные газы
В реальных газах молекулы представляют собой упругие
тела,
имеют собственный объем и взаимодействуют между
собой.
Исторически первое
уравнение состояния реальных газов было получено Ван-Дер-Ваальсом.
Из уравнения состояния идеальных газов (Клапейрона)
pv=RT; v=RT/p,
то есть при p=∞: v=0,
что не соответствует действительности.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 3К выводу уравнения Ван-Дер-Ваальса
Обозначим собственный объем молекул реального газа
буквой b,
тогда: v-b=RT/p,
то есть при p=∞: (v-b)
0; v b,где b – константа Ван-Дер-Ваальса.
Выразим из полученного уравнения давление
p=RT/(v-b)
и учтем взаимодействие между молекулами.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 4Константа Ван-Дер-Ваальса
Давление – это результат ударов молекул о
● ● стенки сосуда.
●
Притяжение
других молекул ослабляет силу удара молекулы на поправку Δp, которая пропорциональна
числу притягиваемых и притягивающих молекул,
то есть: Δp=aρ2=a/v2,
где а – константа Ван-Дер-Ваальса.
C учетом этого: p=RT/(v-b)-Δp=RT/(v-b)-a/v2.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 5Уравнение Ван-Дер-Ваальса
Итак, уравнение состояния реальных газов Ван-Дер-Ваальса:
.
Ван-Дер-Ваальс учел только два фактора, отличающих
реальные газы от
идеальных, поэтому его уравнение не очень точное.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 6Уравнение состояния реальных газов
Более точным является уравнение
Вукаловича-Новикова, в
котором учтены дополнительно ассоциация (объединение в
многомолекулярные комплексы)
и диссоциация (раздробление) комплексов.
С учетом ассоциации и диссоциации 2-х молекулярных
комплексов уравнение Вукаловича-Новикова, имеет вид:
.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
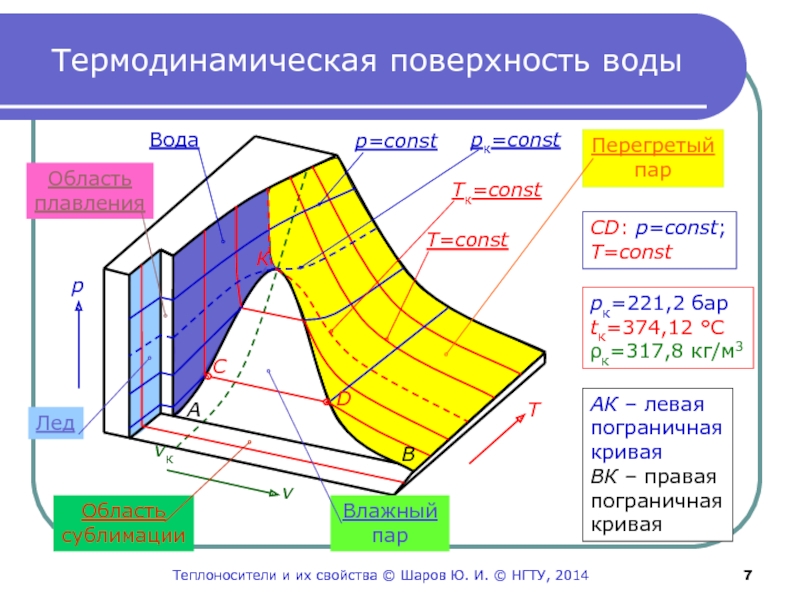
Слайд 7Термодинамическая поверхность воды
Область
сублимации
v
Влажный
пар
Т
р
Перегретый
пар
Лед
Область
плавления
Вода
vк
p=const
pк=const
T=const
Tк=const
К
рк=221,2 бар
tк=374,12 °С
ρк=317,8 кг/м3
А
В
АК –
левая
пограничная
кривая
ВК – правая
пограничная
кривая
С
D
СD: p=const;
T=const
Теплоносители и их свойства © Шаров Ю.
И. © НГТУ, 2014Слайд 8Парообразование на поверхности воды
(испарение)
Испарение – это парообразование на поверхностиводы,
которое происходит при любой температуре.
Явление заключается в том,
что молекулы воды с повышенной кинетической энергией преодолевают силу притяжения
соседних молекул и вылетают в воздух.
Интенсивность испарения возрастает с увеличением
температуры воды, так как при этом растет кинетическая
энергия движения молекул и уменьшается сила
взаимодействия между ними.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 9Воздушно-испарительное охлаждение
При вылете из воды самых быстрых молекул уменьшается
средняя кинетическая энергия движения молекул воды, то есть
температура воды
падает. Это так называемое воздушно-испарительное охлаждение
широко используется в технике (брызгальные бассейны,
градирни, барботажные теплообменники).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 10Парообразование во всем объеме воды
(кипение)
Когда вода нагрета до температуры
кипения (насыщения),
начинается парообразование во всем объеме (кипение).
При
кипении температура воды остается постоянной.Центрами парообразования являются шероховатости
поверхности нагрева, пылинки и пузырьки воздуха в воде.
С повышением давления растет температура кипения (вода
атмосферного давления кипит при температуре 100 °С).
Идеально чистая вода в сосуде с полированными стенками
может быть перегрета до температуры, превышающей
температуру кипения (нет центров парообразования).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 11Конденсация пара.
Насыщенный пар
При охлаждении пара происходит его конденсация, то
есть
превращение пара в воду.
Образовавшаяся при этом вода
называется конденсатом. При парообразовании в закрытом сосуде часть молекул из
парового пространства могут снова вернуться в жидкость.
При динамическом равновесии: число молекул, вылетающих
из воды, равно числу молекул пара, возвращающихся в воду,
пар называется насыщенным.
Сухой насыщенный пар получается при переходе в пар всей
воды.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 12Влажный насыщенный пар
При неполном испарении воды пар называется влажным
насыщенным.
Массовая доля пара во влажном паре (смеси пара
с капельками воды) называется степенью сухости пара «х».
Для сухого насыщенного пара х=1.
Степень сухости пара х=0 соответствует воде на линии
насыщения (закипающей воде).
Если сухой насыщенный пар подогревать, он становится
перегретым с температурой t, степень перегрева которого
равна разности температур t-tн.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 13Водяной пар
Водяной пар является рабочим телом паротурбинных
установок
(ПТУ).
Водяной пар – это реальный газ, состояние которого
можно описать уравнением состояния Вукаловича-Новикова.
Для удобства, состояния пара были просчитаны в большом
диапазоне параметров, а результаты представлены в виде
таблиц термодинамических свойств воды и пара и в форме
pv-, Ts-, hs-диаграмм.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
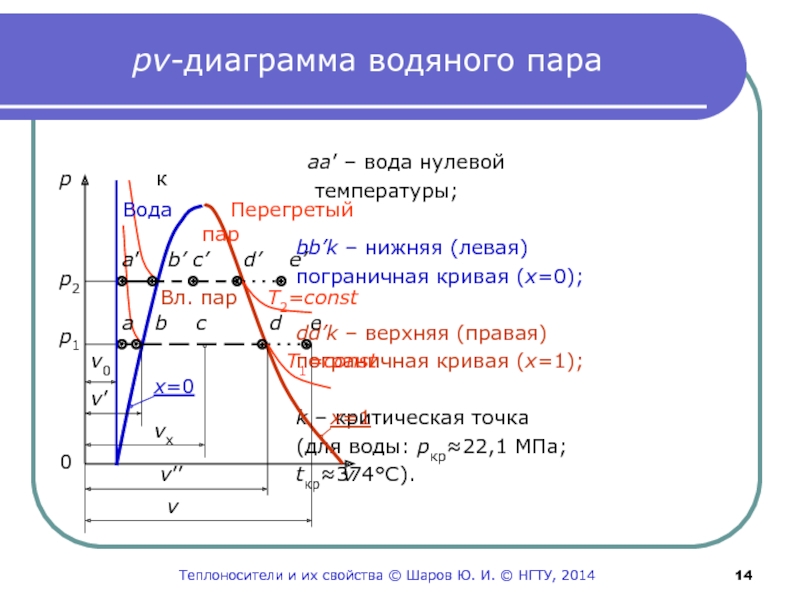
Слайд 14рv-диаграмма водяного пара
aa’ – вода нулевой
температуры;
bb’k – нижняя (левая)
пограничная кривая (х=0);dd’k – верхняя (правая)
пограничная кривая (х=1);
k – критическая точка
(для воды: pкр≈22,1 МПа;
tкр≈374С).
p к
p2
p1
a’ b’ c’ d’ e’
a b c d e
v0
v’
vx
v’’
v
x=0
x=1
T2=сonst
T1=сonst
Вода Перегретый
пар
Вл. пар
0
v
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 15К pv-диаграмме
Слева от пограничной кривой – вода;
между пограничными кривыми – влажный пар;
правее верхней пограничной кривой
– перегретый пар.На верхней пограничной кривой – сухой, насыщенный пар.
Точка а(v0) – вода нулевой температуры;
процесс ab – изобарный нагрев воды от 0С до температуры
кипения (насыщения) tн;
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 16Процессы и состояния воды и пара
точка b (v’;
х=0) – вода на линии насыщения (закипающая);
процесс
bd – изобарно-изотермическое парообразование (кипение воды) при tн=Const;
точка d (v”; х=1) – сухой, насыщенный пар;
точка c – влажный, насыщенный пар (х – степень сухости
пара: массовая доля пара во влажном паре);
процесс de – изобарный перегрев пара;
точка e (v) – перегретый пар.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 17pt-диаграмма
В pt -диаграмме процессы
изменения агрегатного состояния
(2-фазные
состояния при t=const)
изображаются точками
(«b» – таяние льда;
«c»
– испарение воды; «k» – возгонка или сублимация).
Процессы: аb – изобарный нагрев
льда до температуры плавления;
(ek – нагрев до температуры
сублимации);
bс – изобарный нагрев воды до температуры кипения;
cd и km – перегрев пара.
р
t
A
B
C
D
a
b
c
d
e
k
m
Вода
Лед Пар
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 18Тройная точка воды
Линия АВ – зависимость температуры плавления льда
от
давления; она является границей твердой и жидкой фаз.
Линия АС – зависимость температуры кипения воды от
давления; она разделяет жидкую и газообразную фазы.
При снижении давления эти две линии сходятся в точке «А»,
которая называется тройной точкой воды (рА=613 Па; tA=0,0075
°С).
В тройной точке воды все три фазы воды (твердая, жидкая и
газообразная) находятся в состоянии равновесия.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 19Возгонка или сублимация.
Параметры состояния
Если лед нагревать при p
он сразу переходит в пар,
минуя жидкое состояние (воду). Такой
процесс называется возгонкой или сублимацией.
Линия АD – зависимость температуры сублимации льда от
давления; она разделяет твердую и газообразную фазы.
Так как при практических расчетах находятся изменения
параметров состояния, а не их абсолютные значения, то за
начало отсчета калорических параметров состояния принята
температура 0 °С и соответствующее ей давление насыщения
рН=611 Па (u’0=0; h’0=0; s’0=0).
Индекс «‘» относится к воде на линии насыщения.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 20Теплота нагрева воды
до температуры насыщения
Для изобарного нагрева bc
1 кг воды от t0=0 °C до температуры
насыщения (кипения)
tн к ней надо подвести теплоту, Дж/кг:(1)
или из I закона термодинамики:
. (2)
Но u’0=0, а работа расширения воды при умеренных давлениях
ничтожна: .
В изобарном процессе теплоту можно выразить также через
разность энтальпий:
, (3)
то есть из (1…3) следует:
. (4)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 21Изменение энтропии
Увеличение энтропии воды в изобарном процессе в интервале
температур t=0…tн (Т=273…Тн) можно найти по формуле,
Дж/(кг·К):
. (5)
При
t0=0 °С (273 К) энтропия воды нулевой температуры s’0=0, а теплоемкость воды срв=4187 Дж/(кг·К), тогда из (5)
энтропия воды на линии насыщения, Дж/(кг·К):
.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 22Парообразование
Изобарно-изотермическое парообразование происходит
в точке «b», при этом теплота,
затраченная на преобразование
1 кг воды в пар, называется скрытой
теплотой парообразования; по I закону термодинамики:
. (6)
Здесь: u”-u’=ρ – внутренняя теплота парообразования,
пошедшая на изменение внутренней энергии;
l”=p(v”-v’)=ψ – внешняя теплота парообразования,
израсходованная на работу против внешних сил (на работу
расширения).
Таким образом: . (7)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 23Энтальпия и энтропия воды и пара
В изобарном процессе r=h”-h’;
значения энтальпий сухого насыщенного пара h” и воды на
линии
насыщения h’ приведены в термодинамических таблицах, а значения u”, ρ и ψ находятся по формулам (6…8).
Изменение энтропии в процессе парообразования:
, (9)
то есть: . (10)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 24Влажный пар
Удельный объем влажного пара находится как для смеси
воды
и сухого насыщенного пара, м3/кг:
, (11)
где х
– степень сухости пара (массовая доля сухого насыщенного пара во влажном паре).
Энтальпия влажного пара, Дж/кг:
; (12)
энтропия влажного пара, Дж/(кг·К):
. (13)
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 25Перегрев пара
Теплота перегрева пара до температуры Т, Дж/кг:
, (13)
где срп – средняя теплоемкость перегретого пара (в диапазоне
от
Тн до Т, Дж/(кг·К). Энтальпия перегретого пара, Дж/кг:
, (14)
или по I закону термодинамики для изобарного процесса:
. (15)
Из выражения (15) можно найти внутреннюю энергию пара u.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 26Энтропия перегретого пара
Изменение энтропии при перегреве пара, Дж/(кг·К):
, (16)
откуда энтропия перегретого пара:
. (17)
Теплоносители
и их свойства © Шаров Ю. И. © НГТУ, 2014Слайд 27 К Ts-диаграмме
Начало отсчета параметров состояния:
внутренней энергии
u0=0;
энтальпии h0=0;
и энтропии s0=0
принимаем при 0
С (273 К) – точка а.Процесс abcde при p=const тот же, что был описан в
pv-диаграмме.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
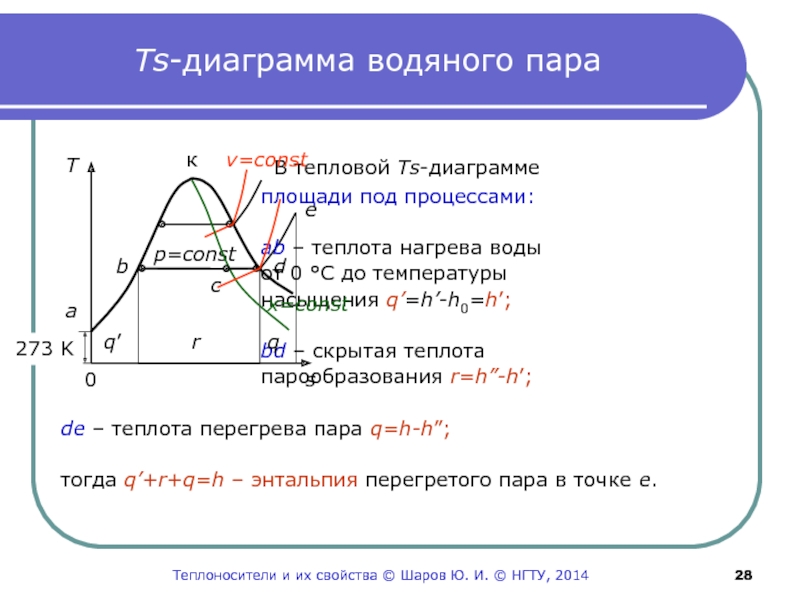
Слайд 28Ts-диаграмма водяного пара
В тепловой Ts-диаграмме
площади под процессами:
аb
– теплота нагрева воды
от 0 С до температуры
насыщения
q’=h’-h0=h’;bd – скрытая теплота
парообразования r=h”-h’;
de – теплота перегрева пара q=h-h”;
тогда q’+r+q=h – энтальпия перегретого пара в точке е.
T
273 K
q’
q
r
к v=const
p=const
0
s
a
x=const
b
c
d
e
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
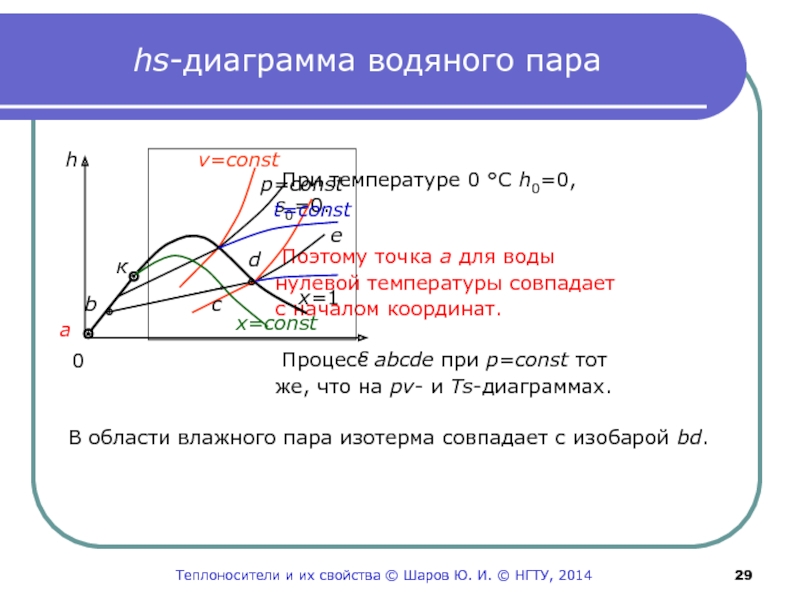
Слайд 29hs-диаграмма водяного пара
При температуре 0
С h0=0,
s0=0.
Поэтому точка а
для воды нулевой температуры совпадает
с началом координат.
Процесс abcde при p=const тот
же, что на pv- и Ts-диаграммах.
В области влажного пара изотерма совпадает с изобарой bd.
a
0
s
v=const
p=const
t=const
b
c
d
e
к
h
x=const
x=1
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 30Расчеты процессов водяного пара
В практических расчетах обычно используются
области
перегретого пара и влажного с высокими степенями сухости.
Поэтому изображается в большем масштабе выделенная рамкой часть диаграммы.
Более точные расчеты процессов водяного пара выполняется
по таблицам.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 31Таблицы термодинамических свойств
воды и водяного пара
Бывают таблицы термодинамических
свойств воды
на линии насыщения и сухого насыщенного пара:
(tн,
v’, v”, h’, h”, r, s’, s”)=f(pн)(pн, v’, v”, h’, h”, r, s’, s”),=f(tн)
где pн, tн – давление и температура насыщения;
v, h, s – удельный объем, энтальпия и энтропия;
индексы ’, ” относятся к воде на линии насыщения и
сухому насыщенному пару.
Таблицы термодинамических свойств перегретого пара:
(v, h, s)=f (p, t).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 32Внутренняя энергия
В таблицах и диаграммах нет внутренней энергии воды
и пара.
Она находится через энтальпию, Дж/кг:
u’=h’-pv’;
ux=hx-pvx;
u”=h”-pv”;
u=h-pv,
где давление подставляется в Па.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
Слайд 33Влажный пар
Параметры состояния влажного пара находятся по смесевым
формулам:
vx=v’(1-x)+v”x;
hx=h’(1-x)+h”x;
sx=s’(1-x)+s”x.
Теплоносители и их свойства © Шаров Ю. И.
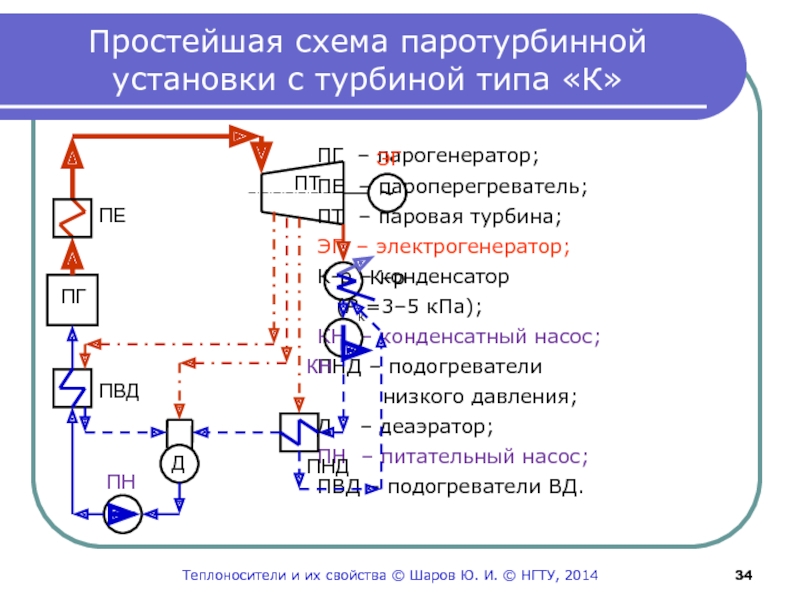
© НГТУ, 2014Слайд 34Простейшая схема паротурбинной установки с турбиной типа «К»
ПГ – парогенератор;
ПЕ
– пароперегреватель; ПТ – паровая турбина;
ЭГ – электрогенератор;
К-р – конденсатор
(Pк=3–5 кПа);
КН – конденсатный насос;
ПНД – подогреватели
низкого давления;
Д – деаэратор;
ПН – питательный насос;
ПВД – подогреватели ВД.
ПГ
ПЕ
ПТ
К-р
Д
КН
ПН
ПВД
ПНД
~
ЭГ
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014