sàng) để có những trách nhiệm đánh giá công nghệ
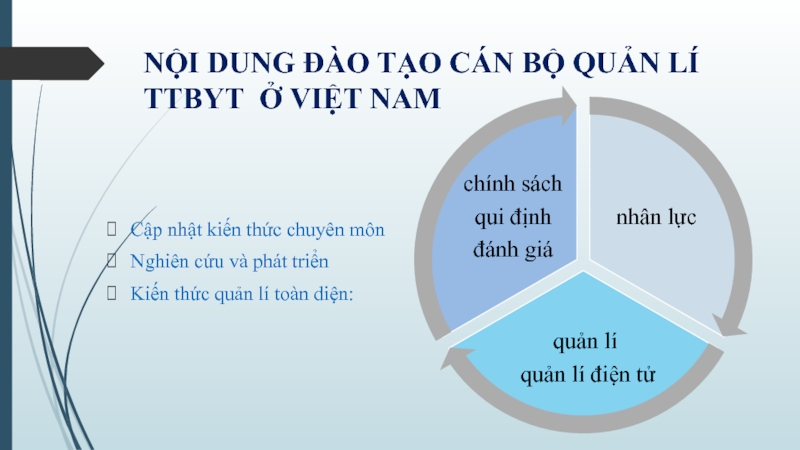
và lập kế hoạch, phát triển các công nghệ chiến lược kế hoạch với sự giúp đỡ của các bác sĩ chính, quản lý bộ phận, và giám đốc điều hành cấp cao.
Bệnh viện có thể thành lập một ban cố vấn công nghệ y tế (MTAC)
Lập kế hoạch và công nghệ hàng năm
Kiểm toán công nghệ ban đầu( Việc kiểm toán cho phép cho việc thu thập các thông tin về tình trạng của các cơ sở công nghệ hiện có và tăng cường năng lực của các ủy ban cố vấn công nghệ y tế)
Tất cả các thông tin thu thập được từ các kết quả kiểm toán công nghệ và đánh giá công nghệ được sử dụng trong chiến lược phát triển ngân sách
BIỆN PHÁP LẬP CHIẾN LƯỢC CÔNG NGHỆ [3]
[3] Yadin David et al.: clinical engineering , CRC Press, 2006





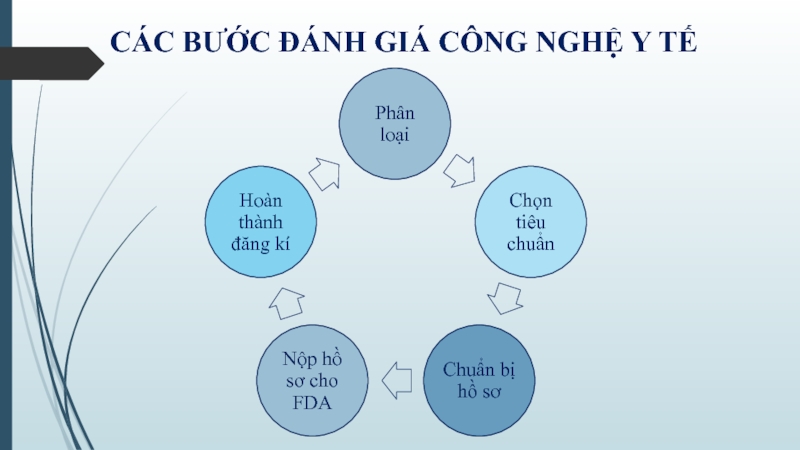








![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.2 ĐÁNH GIÁ CÔNG NGHỆ [3]Để thành công, một quá trình 2.2 ĐÁNH GIÁ CÔNG NGHỆ [3]Để thành công, một quá trình đánh giá công nghệ liên tục](/img/thumbs/fa063c327bf76fb531def3d9ee4adb65-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH QUY TRÌNH ĐÁNH GIÁ CÔNG NGHỆ[5][5] David Y. Medical Technology 2001. CPA Healthcare Conference, 1992 QUY TRÌNH ĐÁNH GIÁ CÔNG NGHỆ[5][5] David Y. Medical Technology 2001. CPA Healthcare Conference, 1992](/img/thumbs/b96a649d6e690669a9e8cdd84fa91618-800x.jpg)


![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.3.1 QUY ĐỊNH ĐỔI MỚI VỀ THIẾT BỊ Y TẾ [2]1938: 2.3.1 QUY ĐỊNH ĐỔI MỚI VỀ THIẾT BỊ Y TẾ [2]1938: thiết bị y tế lần đầu tiên trở thành](/img/tmb/4/307482/67c9157086cf096f7c72f27151334613-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.3.2 Bốn quy tắc tiếp thị thiết bị y tế ở 2.3.2 Bốn quy tắc tiếp thị thiết bị y tế ở thị trường Mỹ[2]:1234Giới thiệu quản lí](/img/thumbs/7cf2844359b42d0c356bab3bc71db6d7-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.3.3 Nghiên cứu khả thi[2][2] John D. Enderle, Joseph D. Bronzino 2.3.3 Nghiên cứu khả thi[2][2] John D. Enderle, Joseph D. Bronzino , Introduction to Biomedical Engineering,Connecticut, 2011](/img/tmb/4/307482/9ba8a4b416b777dec5810dccb969da69-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.3.4 Y đức trong trường hợp cấp cứu[2] FDA đã cho phép 2.3.4 Y đức trong trường hợp cấp cứu[2] FDA đã cho phép sử dụng các thiết bị đề](/img/thumbs/a79e4ed30fc0d482f46e831f0cf691a7-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.3.5 Vấn đề đạo đức trong điều trị[2]FDA cho phép sử 2.3.5 Vấn đề đạo đức trong điều trị[2]FDA cho phép sử dụng các thuốc chưa được chấp](/img/thumbs/bcf523e2e633eda10e492782a9f9a2dc-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 2.4 TRIỂN KHAI VÀ THU HỒI THIẾT BỊ [3][3] Yadin David 2.4 TRIỂN KHAI VÀ THU HỒI THIẾT BỊ [3][3] Yadin David et al.: clinical engineering , CRC](/img/tmb/4/307482/437b94009d29bbc874b6ddc91c11e80f-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH [3] Yadin David et al.: clinical engineering , CRC Press, 2006QUI TRÌNH TIẾP NHẬN CÔNG NGHỆ [3] Yadin David et al.: clinical engineering , CRC Press, 2006QUI TRÌNH TIẾP NHẬN CÔNG NGHỆ](/img/tmb/4/307482/7124c6165bfbe019607e8bd0bec387d8-800x.jpg)

![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 3. SO SÁNH GIỮA QUẢN LÝ VÀ ĐÁNH GIÁ CÔNG NGHỆ 3. SO SÁNH GIỮA QUẢN LÝ VÀ ĐÁNH GIÁ CÔNG NGHỆ Y TẾ[1] World Health Organization ,](/img/thumbs/e3832c7f6c21d547b9a0615555199153-800x.jpg)
![TRƯỜNG ĐAI HỌC BÁCH KHOA TP.HCM KHOA KHOA HỌC ỨNG DỤNG MÔN CƠ SỞ KỸ THUẬT Y SINH 4. TÀI LIỆU THAM KHẢO[1] World Health Organization , Health technology 4. TÀI LIỆU THAM KHẢO[1] World Health Organization , Health technology assessment of medical devives, Switzerland, 2011[2]](/img/thumbs/db811c1aa7b117be63465ed1d54ac04d-800x.jpg)