Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ
Содержание
- 1. ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ
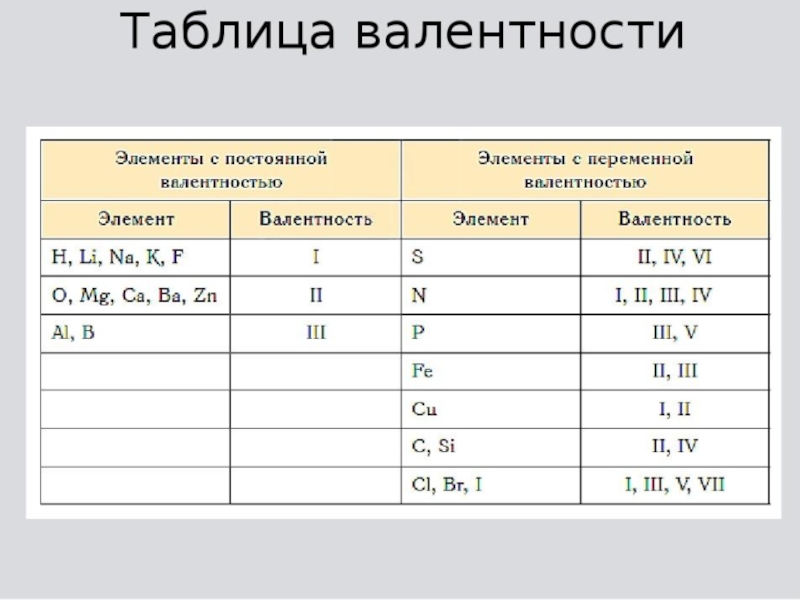
- 2. Валентность (от лат. «valentia» - сила) - способность атома присоединять
- 3. У металлов главных групп Периодической системы валентность
- 4. !Валентность водорода всегда принимают за 1.!Кислород всегда
- 5. Слайд 5
- 6. Слайд 6
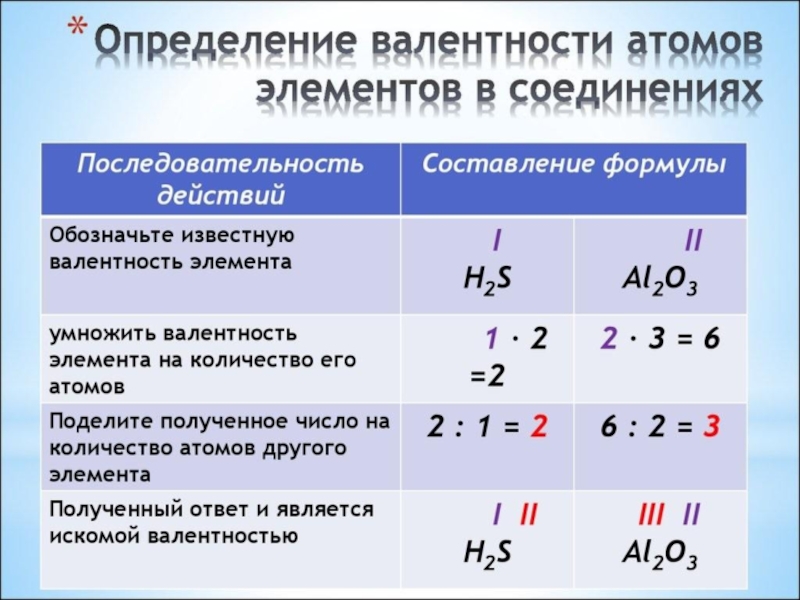
- 7. Na2OIII2НОК2/1 = 2
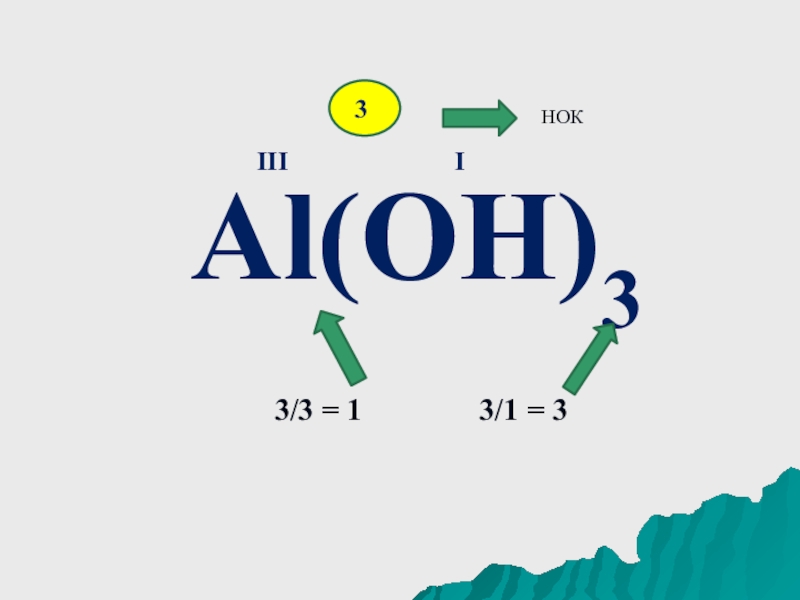
- 8. Al(OH)3IIII3НОК 3/3 = 1 3/1 = 3
- 9. Слайд 9
- 10. Степень окисления (с.о.) - условный заряд атома
- 11. У металлов главных подгрупп Периодической системы степень окисления
- 12. !Степень окисления простого вещества равна нулю.!Сумма всех
- 13. Слайд 13
- 14. Понятия «валентность» и «степень окисления» можно считать
- 15. Говоря о степени окисления, подразумевают, что атом
- 16. Для атома одного и того же элемента,
- 17. Скачать презентанцию
Валентность (от лат. «valentia» - сила) - способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи. Обозначается римскими цифрами
Слайды и текст этой презентации
Слайд 2Валентность (от лат. «valentia» - сила) - способность атома присоединять или замещать определённое
Слайд 3
У металлов главных групп Периодической системы валентность равна номеру группы.
У неметаллов высшая валентность элемента равна номеру его группы в
Периодической системе Д.И. Менделеева. Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элементСлайд 4
!Валентность водорода всегда принимают за 1.
!Кислород всегда проявляет в своих
соединениях валентность 2.
!Валентность алюминия и бора всегда равна 3
Слайд 10Степень окисления (с.о.) - условный заряд атома данного элемента в
соединении, вычисленный, исходя из предположения, что все атомы в молекуле
ионизированы, т.е. имеют заряд. Обозначается арабскими цифрами со знаком + или -Слайд 11
У металлов главных подгрупп Периодической системы степень окисления в соединениях равна
номеру группы: Na+1Cl−1, Li+12O−2, Mg+2F−12, Ba+2O−2.
Степень окисления алюминия равна +3: Al+32S−23.
У фтора степень окисления равна -1: H+1F−1, K+1F−1.
Кислород почти
всегда имеет степень окисления -2: Na+12O−2, C+4O2−2. Исключения - фторид кислорода и пероксиды: O+2F−12, H+12O−12.В большинстве соединений степень окисления водорода +1, но в соединениях с металлами она равна -1: H+1Br−1, N−3H+13, Na+1H−1, Ca+2H−12.
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы в Периодической системе. Минимальное значение степени окисления можно определить, если от номера группы отнять 8