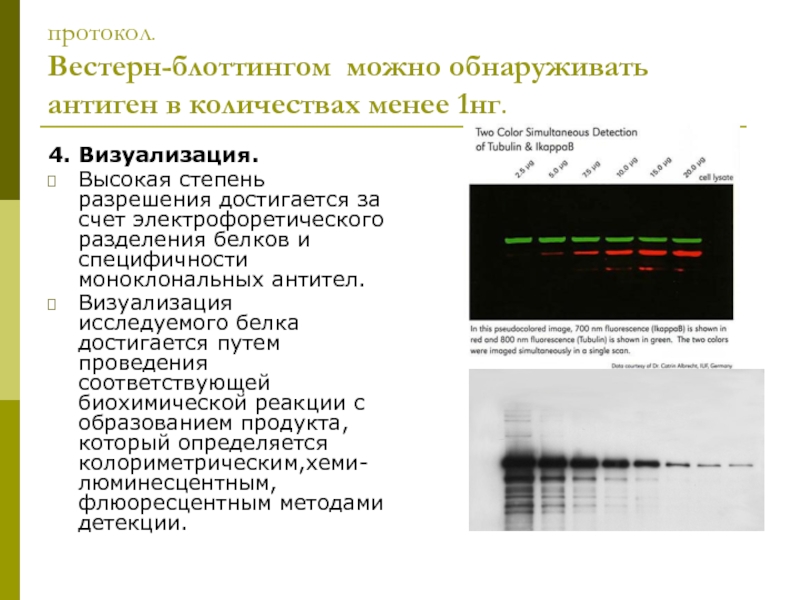
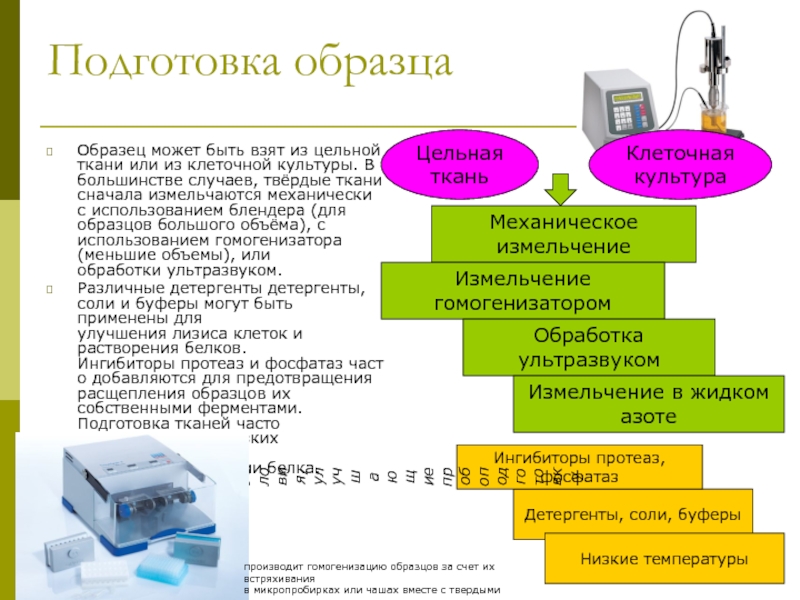
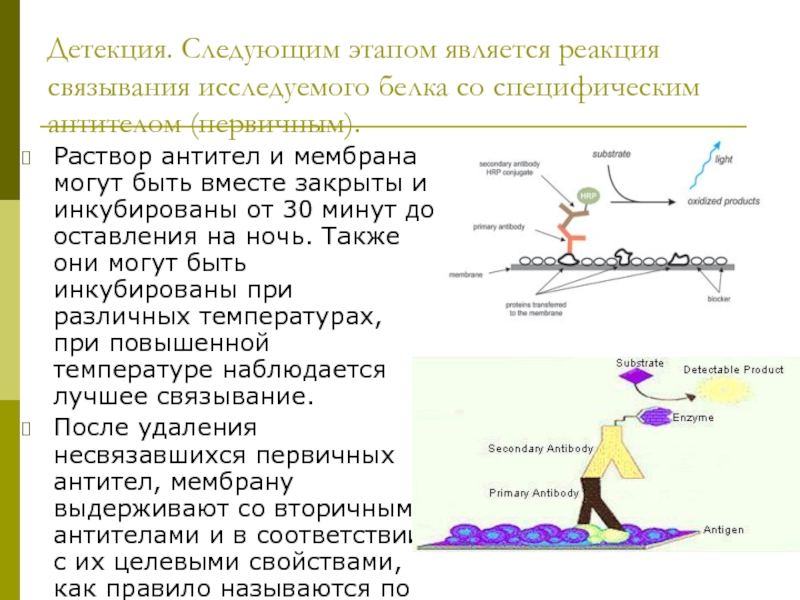
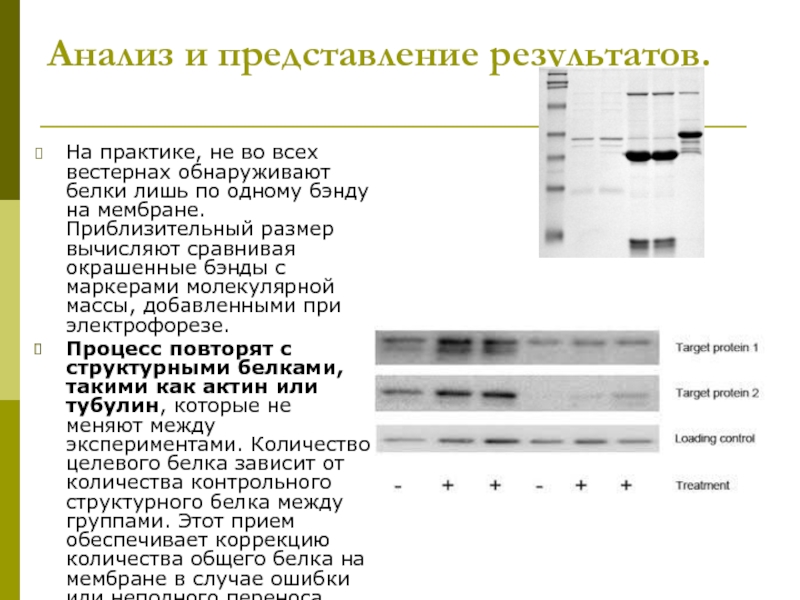
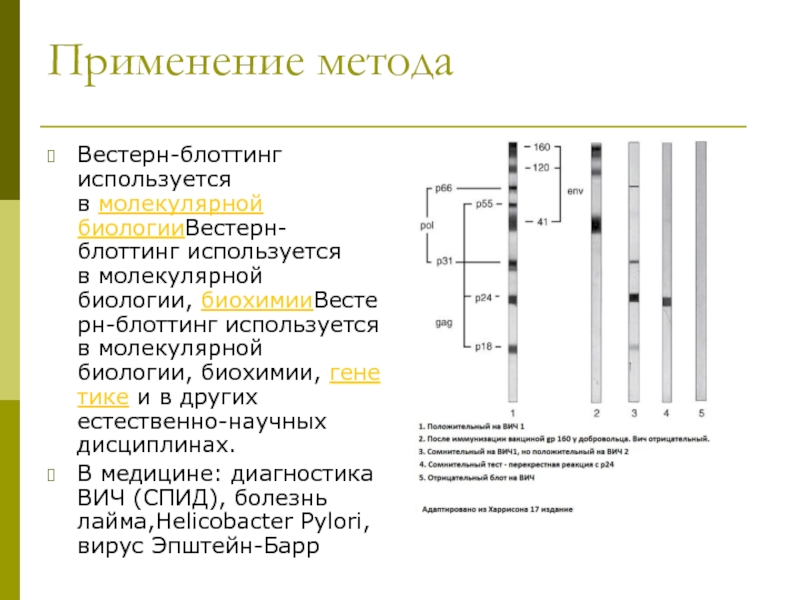
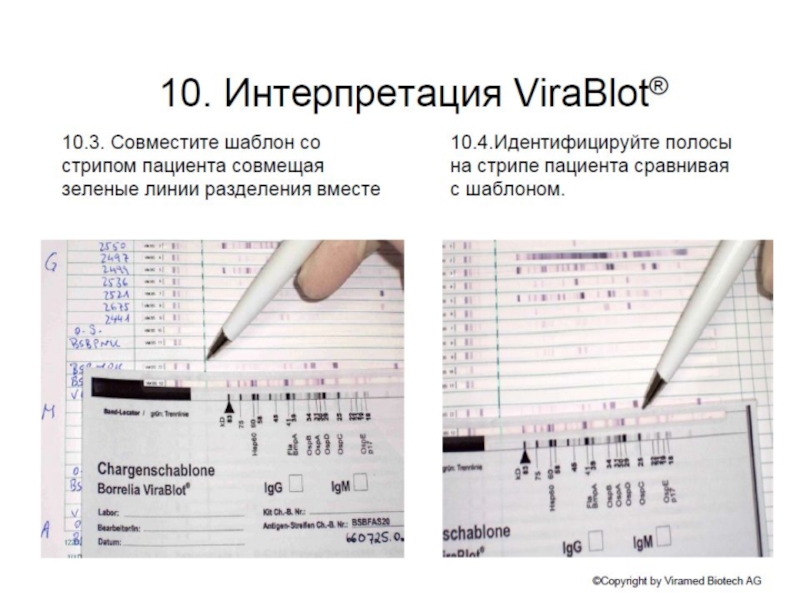
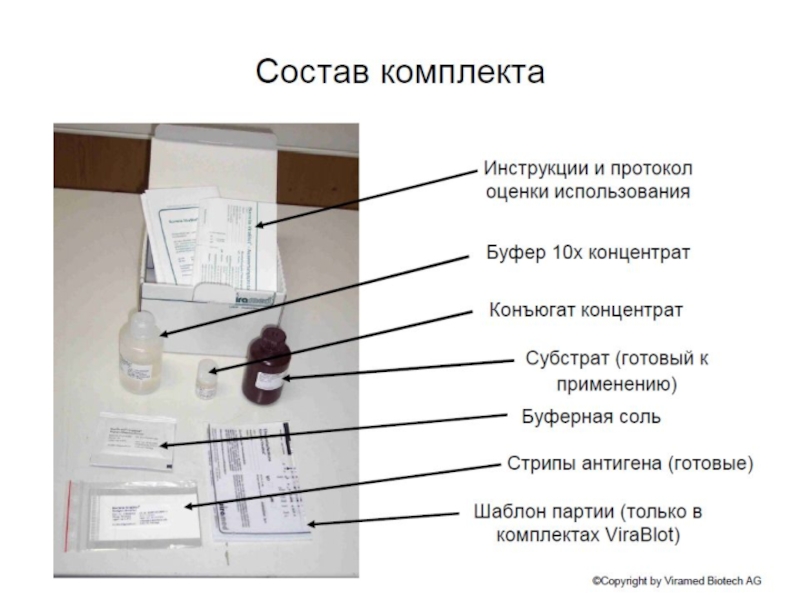
клеточной культуры. В большинстве случаев, твёрдые ткани сначала измельчаются механически
с использованием блендера (для образцов большого объёма), с использованием гомогенизатора (меньшие объемы), или обработки ультразвуком.
Различные детергенты детергенты, соли и буферы могут быть применены для улучшения лизиса клеток и растворения белков. Ингибиторы протеаз и фосфатаз часто добавляются для предотвращения расщепления образцов их собственными ферментами. Подготовка тканей часто выполняется при низких температурах, чтобы избежать денатурации белка.
Цельная ткань
Клеточная культура
Механическое измельчение
Измельчение гомогенизатором
Обработка ультразвуком
Измельчение в жидком азоте
Детергенты, соли, буферы
Ингибиторы протеаз, фосфатаз
Условия, улучшающие
пробоподготовку
Низкие температуры
производит гомогенизацию образцов за счет их встряхивания
в микропробирках или чашах вместе с твердыми шариками