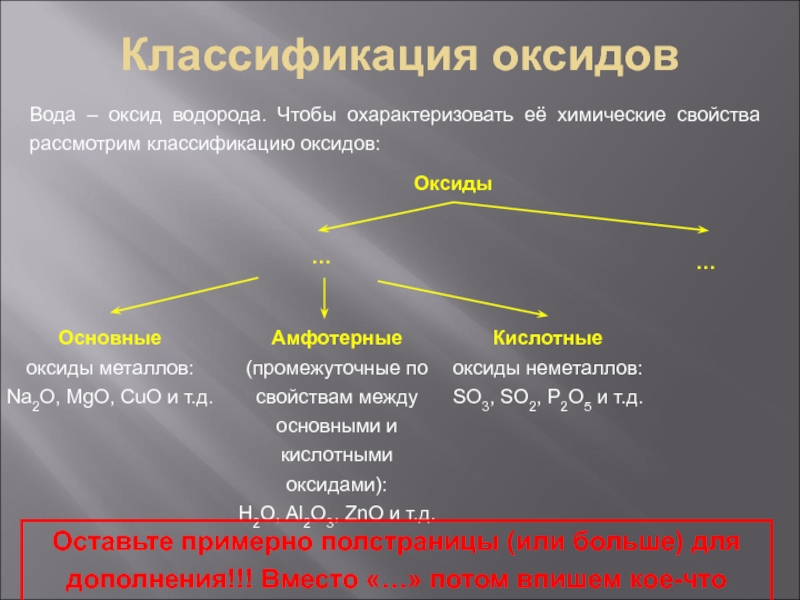
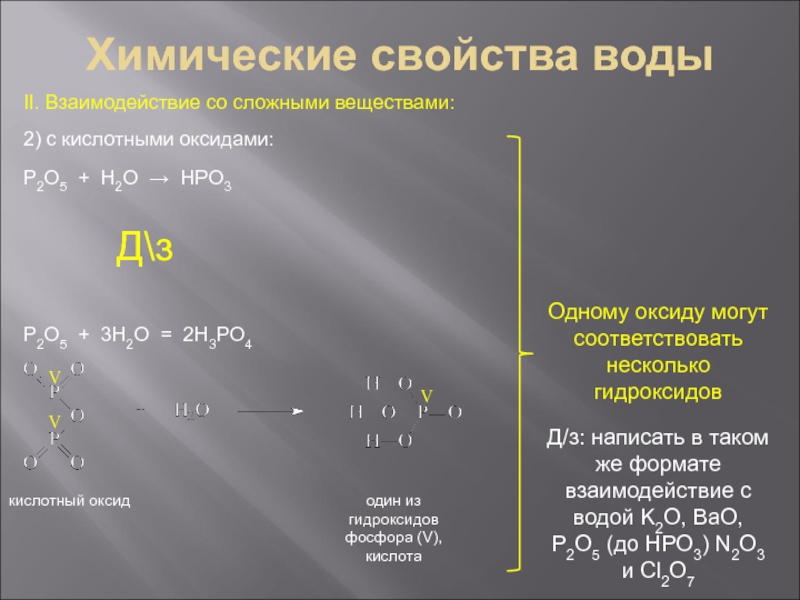
Температура плавления Тпл = 0˚С.
Температура кипения Ткип = 100˚С.
Плотность ρ
= 1 г/см3 – максимальная плотность (при Т = 4˚С)Теплоемкость Сp = 4,184 кДж/(кг˚С)
Полярная жидкость – хорошо растворяет полярные вещества, например, этиловый спирт С2Н5ОН неограниченно растворяется в воде.
при давлении р = 101325 Па (1 атм)