Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Введение в клиническую биохимию
Содержание
- 1. Введение в клиническую биохимию
- 2. Чувствительность – это доля больных, для которых
- 3. Специфичность – доля здоровых, для которых получен
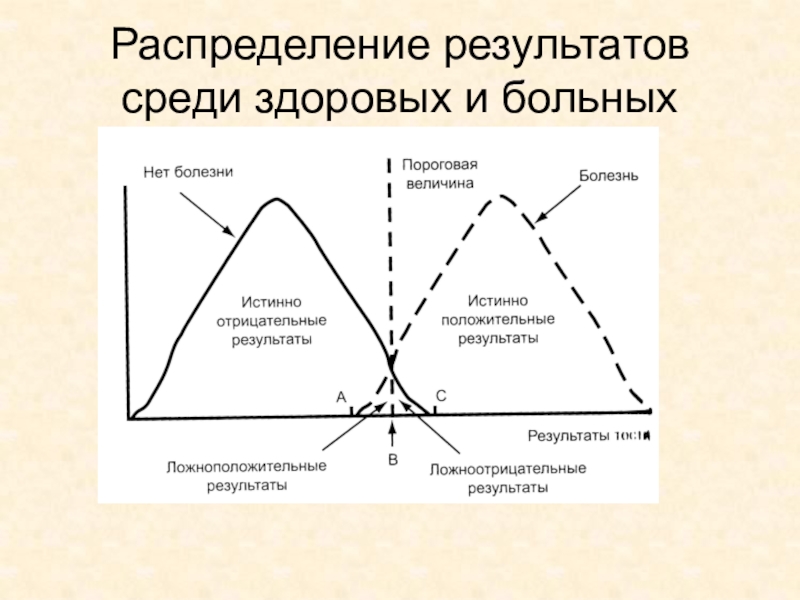
- 4. Распределение результатов среди здоровых и больных
- 5. Воспроизводимость тест-системы – способность давать устойчиво стабильных результат при многократном тестировании одного и того же пациента.
- 6. МЕТОДЫ КЛИНИЧЕСКОЙ БИОХИМИИФотометрияЭлектрофорезИммунологические методы
- 7. ИЗМЕРЕНИЕ ПО КАЛИБРОВОЧНОЙ КРИВОЙ
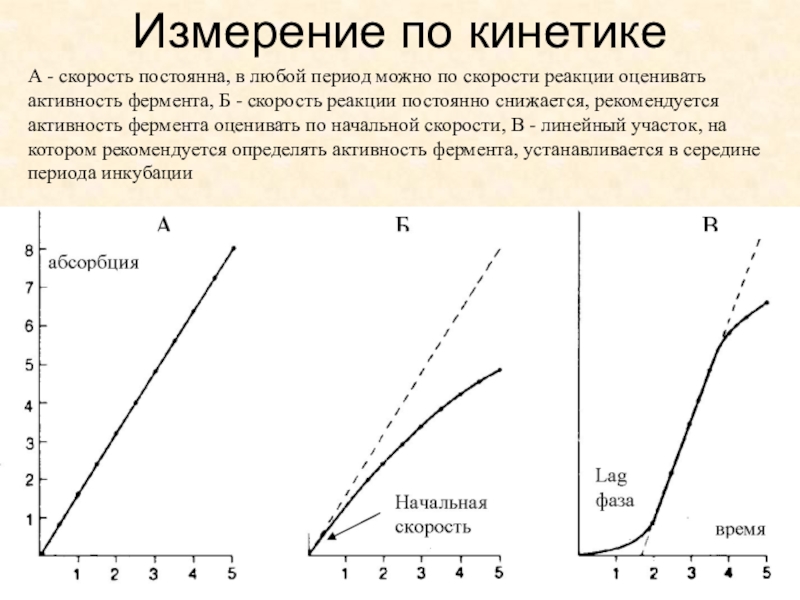
- 8. Измерение по кинетике А - скорость постоянна,
- 9. Кинетическое измерение требует обеспечения наряду с фотометрическим
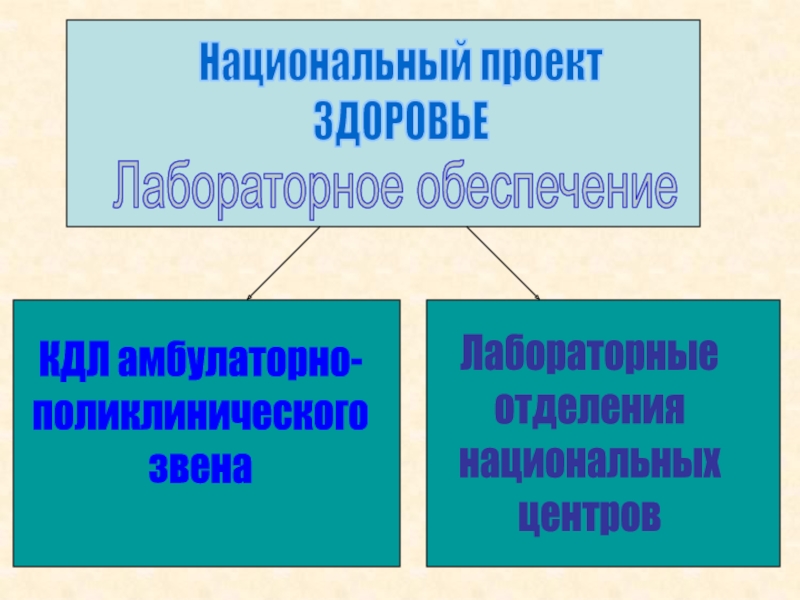
- 10. Национальный проект ЗДОРОВЬЕЛабораторное обеспечениеКДЛ амбулаторно-поликлиническогозвена Лабораторные отделениянациональных центров
- 11. Слайд 11
- 12. Контрольные материалы при проведении ВКК
- 13. Контрольный материал – это материал, используемый в
- 14. Требования к КМгомогенностьминимум два предела концентрации (норма-патология)
- 15. Правила использования КМ-срок годности стабилизированной формы материала-срок
- 16. Слайд 16
- 17. ВИДЫ КМПриготовлены самостоятельноКоммерческие КМ: с исследованным (аттестованным) и неисследованным (неаттестованным) содержанием вещества.
- 18. К исследованным материалам прилагается паспорт с перечнем
- 19. Универсальные – содержат большое количество компонентов,
- 20. Ошибки при манипуляции с лиофилизировнными КМ-ошибки, вызванные
- 21. Гематологические исследованияСтандартный раствор гемиглобинцианидаДонорская кровьРаствор лизированной кровиКонсервированная
- 22. Исследования химического состав мочислитую лиофилизированную мочу с
- 23. Коагулогические исследованияСмешанная свежая плазма от большого количества
- 24. Стадия 1: оценка сходимости результатов измерений методикиИсследуемый
- 25. Стадия 2Оценка воспроизводимости измерений по значениям коэффициента
- 26. Заключительный этапОкончательная оценка соответствия величин CV20, В20Построение контрольных карт
- 27. Оперативный ККИспользуют два неаттестованные или два аттестованного
- 28. САНЭПИДРЕЖИМИ ОХРАНА ТРУДА В ЛАБОРАТОРИИ
- 29. Профилактика внутрибольничных инфекций в лечебно-профилактических учреждениях является
- 30. 3. Ответственность за организацию и соблюдение противоэпидемического режима
- 31. Инструкцияпо противоэпидемическому режимуи соблюдению техники безопасности при
- 32. 4. В соответствии с приказами МЗ РФ от
- 33. II. Основные правила работы в лабораториях Медицинский
- 34. 3. Запрещается курить, пить, принимать пищу и пользоваться
- 35. III. Порядок забора кровиЗабор крови для исследования следует
- 36. Алгоритм эпидемиологически безопасного забора и подготовки крови
- 37. IV. Транспортировка и хранение биоматериала1. При транспортировке материал
- 38. Дезинфекция физическими методами
- 39. Дезинфекция с использованием химических средств производится способом
- 40. VI. Предстерилизационная очистка лабораторной посуды и изделий медицинского
- 41. VII. Стерилизация лабораторной посуды и изделий медицинского назначенияСтерилизацию
- 42. Бактериологический контроль за качеством стерилизации с помощью
- 43. VIII. Санитарно-противоэпидемическии режим содержания помещений лабораторийВлажная уборка
- 44. Алгоритм проведения генеральной уборки лабораторных помещений:помещение максимально
- 45. Весь уборочный инвентарь обеззаразить в дезинфицирующем растворе
- 46. Порядок ликвидации аварии, связанной с проливом или
- 47. Все загрязненные или подозрительные на загрязнение кровью
- 48. При аварии в центрифуге после ее остановки,
- 49. При повреждении кожных покровов необходимо немедленно обработать
- 50. В лаборатории должен быть журнал регистрации аварий,
- 51. КДЛ амбулаторно-поликлинического звена Состоявшееся решение - укрепить
- 52. ЛОТ № 1 (поставщик Эко-Мед-С)
- 53. Полуавтоматический биохимический анализатор КЛИМА-15Кювета Клима-15
- 54. Биохимический анализатор
- 55. Слайд 55
- 56. Слайд 56
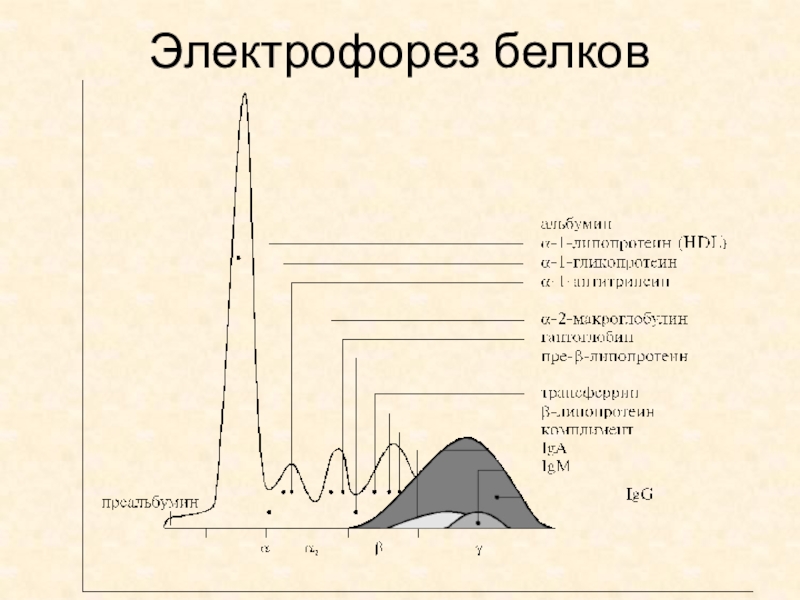
- 57. Электрофорез белков
- 58. Спасибо за внимание
- 59. Скачать презентанцию
Чувствительность – это доля больных, для которых получен положительный результат в данной тест-системе от общего количества исследованных больных. Оценивается по выборке сывороток крови, взятых от больных, которым достоверно поставлен диагноз.
Слайды и текст этой презентации
Слайд 1Введение в клиническую биохимию
Методы клинической биохимии. Контроль качества лабораторных исследований.
Слайд 2Чувствительность – это доля больных, для которых получен положительный результат
в данной тест-системе от общего количества исследованных больных. Оценивается по
выборке сывороток крови, взятых от больных, которым достоверно поставлен диагноз.Слайд 3Специфичность – доля здоровых, для которых получен отрицательный результат в
данной тест-ситеме, от общего количества обследованных здоровых людей. Оценивается по
выборке сывороток крови здоровых людей.Слайд 5Воспроизводимость тест-системы – способность давать устойчиво стабильных результат при многократном
тестировании одного и того же пациента.
Слайд 8Измерение по кинетике
А - скорость постоянна, в любой период
можно по скорости реакции оценивать активность фермента, Б - скорость
реакции постоянно снижается, рекомендуется активность фермента оценивать по начальной скорости, В - линейный участок, на котором рекомендуется определять активность фермента, устанавливается в середине периода инкубацииСлайд 9Кинетическое измерение требует обеспечения наряду с фотометрическим адекватным обеспечением, также
точного поддержания температуры в измерительной кювете и правильного отсчета временных
интервалов. Так, общепринятым считается поддержание температуры в измерительной ячейке в пределах 0,1 оССлайд 10Национальный проект
ЗДОРОВЬЕ
Лабораторное обеспечение
КДЛ амбулаторно-
поликлинического
звена
Лабораторные
отделения
национальных
центров
Слайд 13Контрольный материал – это материал, используемый в целях внутрилабораторного контроля
качества и внешней оценки качества и подвергаемый измерению в соответствии
с той процедурой измерения, что и проба с неизвестным содержанием.Слайд 14Требования к КМ
гомогенность
минимум два предела концентрации (норма-патология) по всем измеряемым
в лаборатории параметрам;
доступность в большом количестве (закупка производится на год
минимум)хорошая растворимость, если лиофилизирован
высокая стабильность веществ, содержащихся в КМ, до и после разведения;
произведен на основе человеческого матрикса или матрикса, близкого к человеческому;
удобство и простата в повседневном использовании.
Слайд 15Правила использования КМ
-срок годности стабилизированной формы материала
-срок годности после вскрытия
флакона или растворения лиофилизированной формы материала
-тип матрицы контрольного материала
-разрешается
использовать только КМ, предварительно проверенный относительно допусков по гомогенности, стабильности, вариабельности, разлива, растворения, а также отсутствия инфицированности-при выборе коммерческих КМ важно обратить внимание на стабильность по содержанию различных компонентов в данном материале
Для экономного использования жидкого КМ допускается разлить содержимое флакона в пробирки с герметическими крышками
При использовании реактивов и калибраторов одного производителя рекомендуется проверять характеристики аналитическй системы с помощью аттестованного КМ другого производителя.
Слайд 17ВИДЫ КМ
Приготовлены самостоятельно
Коммерческие КМ:
с исследованным (аттестованным) и неисследованным (неаттестованным)
содержанием вещества.
Слайд 18К исследованным материалам прилагается паспорт с перечнем значений концентраций для
каждого вещества, методов и наборов реактивов. Они используются для определения
правильности. К ним должны предъявляться требования наравне со стандартными образцами (ГОСТ 14263-69),КМ с неизвестным содержанием компонентов (неаттестованные) используются для контроля воспроизводимости. Для этих материалов известен лишь их грубый диапазон (норма, патология).
Слайд 19 Универсальные – содержат большое количество компонентов, концентрация или активность
которых исследована многими методами.
Специальные КС предназначены для контроля качества при
определении:показателей, исследуемых с определенной диагностической целью, например для диагностики анемий, повреждений сердечной мышцы, опухолей и т.д.
отдельных компонентов: С-реактивного белка, ревматоидного фактора, гормонов, газов крови и др.
компонентов, определяемых при терапевтическом мониторинге лекарств, в том числе, методами тонкослойной и высокоразрешающей газожидкостной хроматографии
компонентов, исследуемых методом сухой химии
Слайд 20Ошибки при манипуляции с лиофилизировнными КМ
-ошибки, вызванные пипетированием при взятии
растворителя
-потеря вещества лиофилизированной пробы при небрежном открывании флаконов;
-недостаточное выдерживание времени,
необходимого для полного растворения сыворотки;-сильное встряхивание или перегревание при растворении сыворотки;
-несоблюдение периода стабильности после растворения сыворотки;
-несоблюдение условий хранения растворенного контрольного материала.
Слайд 21Гематологические исследования
Стандартный раствор гемиглобинцианида
Донорская кровь
Раствор лизированной крови
Консервированная кровь
Фиксированные клетки крови
(суспензия)
Другие материалы, имитирующие клетки крови
Контрольные мазки (окрашенные и неокрашенные, нормальные
и патологические)Слайд 22Исследования химического состав мочи
слитую лиофилизированную мочу с исследованным и неисследованным
содержанием компонентов, а также применяют искусственные контрольные растворы, специально приготовленные
путем растворения в дистиллированной воде требуемых веществ.Слайд 23Коагулогические исследования
Смешанная свежая плазма от большого количества доноров (не менее
20 человек)
Контрольная человеческая плазма с точным содержанием факторов свертывания (н
и п)Контрольная плазма с дефицитом индивидуальных факторов свертывания
Контрольная плазма для контроля верхней и нижней границ терапевтической области при приеме антикоагулянтов.
В качестве основного контрольного материала используют слитую (только цитратную), плазму
Слайд 24Стадия 1: оценка сходимости результатов измерений методики
Исследуемый материал: КМ или
проба пациента со значением определяемого показателя в нормальном диапазоне.
Этапы: провести
10 измерений определяемого показателя в одном и том же материале в одной аналитической серии; рассчитать статистические значения; сравнить CV полученное с установленнымСлайд 25Стадия 2
Оценка воспроизводимости измерений по значениям коэффициента вариации;
Оценка правильности измерений
по величинам относительного смещения;
Определение контрольного предела и построения контрольных карт.
Слайд 26Заключительный этап
Окончательная оценка соответствия величин CV20, В20
Построение контрольных карт
Слайд 27Оперативный КК
Используют два неаттестованные или два аттестованного КМ
Образцы КМ равномерно
распределяют среди анализируемых проб пациентов
В каждой аналитической серии проводится по
одному измерению в каждом из двух контрольных материаловТочки, контрольных измерений наносятся на соответствующие контрольные карты
Оценку результатов исследования проводят с использованием контрольных правил
Слайд 29
Профилактика внутрибольничных инфекций в лечебно-профилактических учреждениях является комплексной проблемой и
включает проведение соответствующих мероприятий, как в клинико-диагностических отделениях, так и
в лабораторных подразделениях. Современные крупные стационары располагают серьезной лабораторной базой, призванной в полной мере обеспечить врача любого профиля широким спектром диагностических исследований, В их структуре работают такие лаборатории, как клинико-гематологическая, биохимическая, инфекционной иммунологии, бактериологическая, радиоиммунохимическая, экспресс-диагностики и др. Строгое соблюдение сотрудниками лабораторных подразделений санитарно-противоэпидемического режима и личной гигиены с учетом профиля работы призвано обеспечить профилактику внутрилабораторного заражения возбудителями инфекционных заболеваний, а также профессиональных заболеваний, связанных с вредным воздействием на организм диагностических препаратов и химических реактивов.Слайд 303. Ответственность за организацию и соблюдение противоэпидемического режима при работе с потенциально
опасными материалами возлагается на заведующих подразделений. В целях предупреждения профессиональных
заболеваний, в т. ч. внутрибольничных и внутрилабораторных инфекций, а также производственного травматизма со всеми работниками лабораторий проводится инструктаж по безопасным приемам и методам работы, который подразделяется на вводный (при приеме на работу), первичный на рабочем месте и периодический (повторный).Инструктаж медицинского персонала на рабочем месте и доведение положений данной инструкции и дополнения к ней проводится (под роспись) заведующими лабораторными подразделениями при приеме на работу и в дальнейшем не реже 1 раза в год. Проведение инструктажа должно быть зарегистрировано в специальном журнале.
Слайд 31Инструкция
по противоэпидемическому режиму
и соблюдению техники безопасности при работе
в лабораториях лечебно-профилактических
учреждений
I. Общие положения
Настоящая Инструкция предназначена для медицинского и технического персонала
подразделений лабораторной диагностики лечебно-профилактических учреждений.В каждом подразделении, связанном с лабораторной диагностикой, с учетом специфики его работы, особенностей размещения, противоэпидемического режима, наличия тех или иных факторов биологической опасности заведующими лабораториями разрабатываются необходимые дополнения к данной инструкции, согласованные с врачом-эпидемиологом ЛПУ, инженером по охране труда и технике безопасности.
Слайд 324. В соответствии с приказами МЗ РФ от 29.09.89 № 555,
от 14.03.96 № 90 и от 16.08.04 № 83 все лица,
принимаемые на работу в лаборатории и работающие в них, в обязательном порядке проходят необходимые медицинские осмотры, лабораторные и функциональные обследования.Кроме того, все медицинские работники, по роду своей деятельности имеющие контакт с кровью или ее компонентами, обследуются (при приеме на работу и в дальнейшем 1 раз в год) на маркеры вирусных гепатитов В и С (НВs-антиген и анти-НСV), а также подвергаются (в период оформления на работу) обязательной вакцинации против вирусного гепатита В.
5. Медицинский персонал лаборатории инфекционной иммунологии, проводящий исследования на ВИЧ-инфекцию, дополнительно обследуется на наличие антител к ВИЧ.
Слайд 33II. Основные правила работы в лабораториях
Медицинский персонал лабораторных подразделений в
целях профилактики внутрилабораторного заражения возбудителями внутрибольничных инфекций должен строго соблюдать
определенные правила при работе с кровью или другими биологическими жидкостями и материалами (взятии крови, аналитических манипуляциях с пробами биологического материала, обработке медицинского инструментария и лабораторной посуды, бывших в контакте с кровью и другими биологическими жидкостями). В частности, необходимо:Работать в медицинских халатах, шапочках, сменной обуви, резиновых (латексных) перчатках, а при угрозе разбрызгивания крови или других биологи- ческих жидкостей - в масках, очках, клеенчатом (полиэтиленовом) фартуке. Все повреждения кожи на руках должны быть закрыты лейкопластырем или напаль- чником. При работе следует быть предельно внимательным, аккуратным, соблю- дать меры предосторожности при выполнении манипуляций с режущими и колю- щими инструментами, избегать уколов, порезов, разрывов перчаток, боя посуды.
Разборку, мойку, предстерилизационную очистку лабораторного инстру- ментария и посуды производить только после предварительной дезинфекции.
Слайд 343. Запрещается курить, пить, принимать пищу и пользоваться косметикой на рабочем
месте.
Запрещается пипетирование крови и других биологических жидкостей ртом.
Поверхность рабочих столов
и лабораторного оборудования подвергается дезинфекции в конце рабочего дня, а в случае загрязнения биологическим материалом - немедленно.В случае аварии, связанной с проливом крови и других потенциально опасных биологических жидкостей, принимать меры, изложенные в специальном разделе.
Слайд 35III. Порядок забора крови
Забор крови для исследования следует проводить в резиновых
перчатках, соблюдая правила асептики, двукратно тщательно обрабатывая перчатки 70% спиртом
перед каждой манипуляцией. Перед проколом кожи пальца стерильным скарификатором одноразового использования место прокола обрабатывается стерильным тампоном (шариком из ваты), смоченным 70% спиртом или другим спиртовым кожным антисептиком. После забора крови к месту прокола кожи прикладывается на 1-2 мин ватный шарик с 70% спиртом.Стерильные тампоны хранятся в упаковке из крафт-бумаги в количестве 20-25 штук; стерильные инструменты - в той же упаковке, в которой проводилась их стерилизация. Многоразовый инструментарий (микропипетки, капилляры, скарификаторы и пр.) стерилизуют и хранят в бумажной упаковке в количестве 5-10 штук.
Срок использования стерильных материалов - 3 суток. На упаковках со стерильным материалом обязательно указывается дата стерилизации.
Слайд 36Алгоритм эпидемиологически безопасного забора и подготовки крови для исследования:
1. После прокола
пальца несколько капель крови спускают на индивидуальное предметное стекло, перемешивают
и используют для работы.2. Кровь набирают в индивидуальные стерильные капилляры объемом 20 мкл и капилляры Панченкова непосредственно с поверхности кожи пальца.
Кровь набирают стерильным индивидуальным капилляром Панченкова, смоченным цитратом в соотношении цитрата и крови 1: 4 по объему.
После прокола кожи пальца 6-8 капель крови спускают в пластиковую пробирку, в которую предварительно внесено небольшое (на кончике глазной лопаточки) количество препарата трилон Б. Кровь тщательно перемешивают, вращая пробирку между ладонями. Разлив крови пипетками осуществляется в лаборатории.
Слайд 37IV. Транспортировка и хранение биоматериала
1. При транспортировке материал помещают в пробирки,
закрывающиеся резиновыми пробками, сопроводительную документацию помещают в упаковку, исключающую возможность
ее загрязнения материалом. Помещать бланки направлений внутрь пробирок с кровью или обворачивать ими пробирки запрещается.2. Транспортировка материала осуществляется в закрытых контейнерах, подвергающихся дезинфекционной обработке.
3. При хранении потенциально инфицированных материалов в холодильнике необходимо поместить их в полиэтиленовый пакет. Размораживание холодильника совмещают с его дезинфекцией.
Слайд 39Дезинфекция с использованием химических средств производится способом погружения изделий в
раствор дезинфектанта в специальных маркированных емкостях из стекла, пластмасс или
покрытых эмалью без повреждений. Емкости должны быть снабжены крышками, иметь четкие надписи с указанием названия средства, его концентрации, назначения, даты приготовления.При дезинфекции изделий, имеющих внутренние каналы, растворы дезинфицирующего средства в объеме 5-10 мл пропускают через канал с помощью груши (шприца) для удаления остатков крови, сыворотки и других биологических жидкостей, после чего изделие полностью погружается в дезраствор.
Для дезинфекции используются разрешенные к применению в Российской Федерации дезинфицирующие средства отечественного и зарубежного производства.
Дезинфекцию изделий химическим методом традиционно осуществляют одним из разрешенных дезинфицирующих средств по режимам, обеспечивающим уничтожение вирусов гепатитов В, С, ВИЧ-инфекции или возбудителей других
инфекций (например, туберкулеза), если есть анамнестические данные о конкретном пациенте. Как правило, этап дезинфекции лабораторной посуды и изделий медицинского назначения совмещается с этапом предстерилизационной очистки (при необходимости), если впоследствии они подвергаются дальнейшей стерилизации.
После предстерилизационной очистки лабораторная посуда и инструментарии промываются проточной водопроводной водой, высушиваются и могут быть использованы повторно или (при необходимости) упаковываются и подвергаются стерилизации.
Слайд 40VI. Предстерилизационная очистка лабораторной посуды и изделий медицинского назначения
Предстерилизационной очистке подвергаются
изделия медицинского назначения многократного применения, подлежащие последующей стерилизации. Предстерилизационную очистку
проводят механизированным (с помощью специального оборудования) или ручным способом.При наличии у средства наряду с моющими также и антимикробных свойств предстерилизационная очистка может быть совмещена с дезинфекцией.
При применении растворов, содержащих перекись водорода с моющим средством, растворов моющих средств "Лотос", "Лотос-автомат", "Астра", "Маричка", "Прогресс", а также натрия двууглекислого неизмененный раствор можно использовать до 6 раз в течение рабочей смены с подогревом до 50 °С.
Контроль качества предстерилизационной очистки проводится в порядке самоконтроля не реже 1 раза в неделю; организует и контролирует его старший лаборант лаборатории. Контролю подвергают 1% одновременно обработанных изделий каждого наименования, но не менее 3 единиц.
Качество очистки изделий проверяется путем постановки азопирамовой пробы на наличие остаточных количеств крови и фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств. Изделия, дающие положительную пробу на кровь или щелочные компоненты моющих средств, подвергаются повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в соответствующем журнале.
Слайд 41VII. Стерилизация лабораторной посуды и изделий медицинского назначения
Стерилизацию лабораторной посуды, инструментария,
других изделий медицинского назначения, бактериологических питательных сред проводят с целью
уничтожения на них (в них) всех видов микроорганизмов, в т. ч. споровых форм.Стерилизацию осуществляют физическими (паровой, воздушный) и химическими (газовый, растворами химических средств) методами.
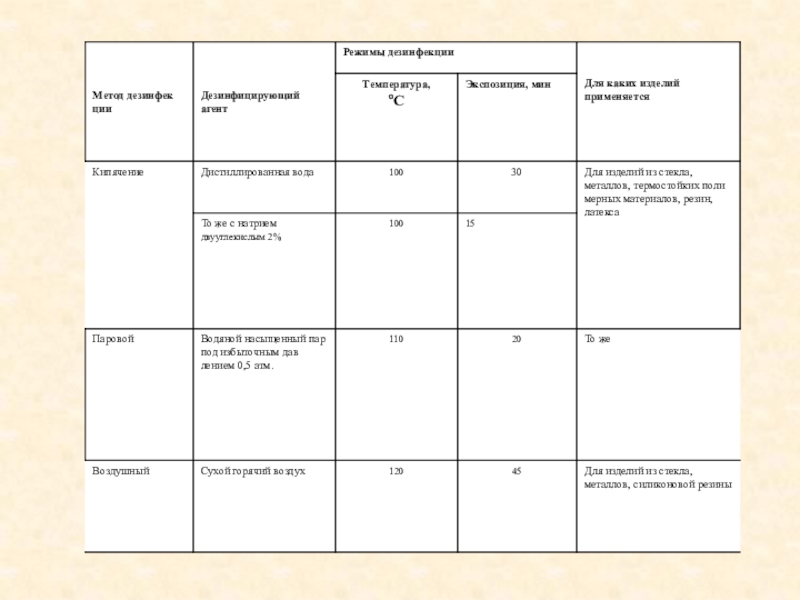
При паровом методе стерилизации используется водяной насыщенный пар под избыточным давлением от 0,5 до 2,1 атм (температура 110-135 °С); стерилизацию осуществляют в паровых стерилизаторах (автоклавах).
При воздушном методе стерилизующим средством является сухой горячий воздух с температурой 160 и 180 °С; стерилизацию осуществляют в воздушных стерилизаторах (сухожаровых шкафах).
Воздушным методом стерилизуются изделия из металлов, стекла и резин на основе силиконового каучука (инструменты, лабораторная посуда и др.). При этом объекты стерилизации могут быть завернуты в специальные упаковочные материалы или стерилизоваться без упаковки. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемым объектам. Загрузку и выгрузку изделий проводят при температуре в камере 40-50 °С.
Время стерилизации:
~ при температуре 180 °С - 60 мин; ~ при температуре 160 °С - 150 мин.
Контроль работы воздушных стерилизаторов осуществляется при каждой стерилизации с помощью специальных термовременных индикаторов.
Результаты контроля работы паровых и воздушных стерилизаторов заносятся в журнал.
Слайд 42Бактериологический контроль за качеством стерилизации с помощью биотестов (спорообразующая тест-культура
на диске из фильтровальной бумаги или в инсулиновом флаконе) проводится
в плановом порядке работниками лаборатории при помощи санитарно-бактериологических исследований 2 раза в год.Основанием для заключения об эффективной работе стерилизационной аппаратуры является отсутствие роста тест-культуры при бактериологических исследованиях всех биотестов в сочетании с удовлетворительными результатами физического и химического контроля.
Слайд 43VIII. Санитарно-противоэпидемическии режим содержания помещений лабораторий
Влажная уборка лабораторных и других
помещений должна осуществляться с применением моющих и дезинфицирующих средств не
менее 1 раза в сутки, а при необходимости чаще.Для проведения текущих и генеральных уборок помещений необходимо иметь достаточное количество маркированного по назначению уборочного инвентаря: ведер для мытья полов и стен; емкостей для обработки предметов обстановки и поверхностей; швабр для мытья полов и стен.
3. Генеральные уборки функциональных помещений лабораторий проводятся в соответствии с утвержденным заведующими подразделений графиком -один раз в месяц, в стерильных боксах - еженедельно. График составляется на квартал или полугодие.
Слайд 44Алгоритм проведения генеральной уборки лабораторных помещений:
помещение максимально освободить от мебели,
оборудования или отодвинуть их для обеспечения свободного доступа к обрабатываемым
поверхностям и объектам;уборку начинать по направлению от окна к двери;
окна мыть теплой водой с добавлением 1 столовой ложки нашатырного спирта на 1 л воды;
стены обработать дезинфицирующим раствором с помощью ветоши и оставить на 60 мин;
пространство за отопительными батареями и внутри них обрабатывать последовательно двумя ершами, смоченными в дезрастворе;
влажной ветошью, смоченной дезинфицирующим раствором, протереть лабораторные столы, другую мебель, оборудование;
провести обеззараживание полов дезинфицирующим раствором {экспозиция 60 мин) с последующим их мытьем;
надеть стерильный халат и смыть дезраствор стерильной ветошью, смоченной водопроводной водой;
для обеззараживания воздуха включить на 60 мин ультрафиолетовый облучатель (установку обеззараживания воздуха "Поток").
Генеральную уборку санузлов, других подсобных помещений проводить не реже 1 раза в 10 дней.
Слайд 45Весь уборочный инвентарь обеззаразить в дезинфицирующем растворе в течение 1 ч,
затем промыть и просушить.
Для обеззараживания поверхностей помещения использовать один из
раз
решенных в Российской Федерации дезинфицирующих препаратов в соответс-
твующих режимах.Примерный расход дезинфицирующих средств составляет: 100-150 мл ра- бочего раствора на 1 м2 площади поверхностей стен, потолка, пола, мебели.
Растворы моющих и дезинфицирующих средств необходимо менять после уборки 60-80 м2 поверхности; в помещениях с режимом асептики (стерильный бокс) - после обработки не более чем 60 м2 площади.
Промаркированный уборочный инвентарь применять для уборки различных функциональных помещений лаборатории строго по предназначению и хра- нить раздельно в установленных местах (шкафах). В каждом лабораторном под- разделении должно быть как минимум 5-7 комплектов уборочного инвентаря: 1) для лабораторных комнат; 2) помещений для дезинфекции и предстерилизаци- онной обработки (моечных); 3) стерилизационных (при наличии); 4) стерильных боксов (при наличии); 5) для рабочих кабинетов врачей, старших лаборантов и комнат персонала; 6) гардеробов и коридоров; 7) санитарных узлов.
По окончании генеральной уборки старшим лаборантом делается отметка об ее проведении в специальном журнале (графике).
Слайд 46Порядок ликвидации аварии, связанной с проливом или разбрызгиванием крови (биологических
жидкостей)
Авария - это нештатная ситуация, при которой создается реальная или
потенциальная возможность попадания патогенного агента в воздух производственной зоны, окружающую среду или заражения персонала.Для проведения дезинфекционной обработки на случай аварии при работе с потенциально заразными биоматериалами (кровью, сывороткой крови, мочой, микробными культурами и др.) на рабочих столах должны быть предусмотрены промаркированные емкости с рабочим дезинфицирующим раствором, а также запас марлевых салфеток.
В каждом лабораторном помещении (группе функционально объединенных лабораторных комнат) должны быть специальные аптечки для оказания первой медицинской помощи при аварийных ситуациях с соответствующей инструкцией.
1. При аварийных ситуациях, связанных с проливом крови и других биоматериалов, все участники немедленно прекращают работу и приступают к ликвидации аварии.
О происшествии немедленно докладывается начальнику подразделения.
Загрязненная одежда снимается и замачивается в дезинфицирующем растворе в специальной промаркированной емкости.
Для уборки надевается соответствующая защитная одежда и резиновые перчатки.
Слайд 47Все загрязненные или подозрительные на загрязнение кровью (биологичес-кими жидкостями) поверхности
пола и предметов обстановки обрабатываются раствором дезинфектанта, а разбитая стеклянная
и полимерная посуда обильно заливается дезраствором не менее чем на 1 ч, после чего последние убираются с помощью специально выделенного уборочного инвентаря, а поверхности очищаются с помощью моющих средств; использованная при этом ветошь замачивается в специально выделенной емкости с дезраствором, маркированной "Для дезинфекции использованной ветоши".Резиновые (латексные) перчатки после окончания работы обеззаражи- ваются погружением в дезинфицирующий раствор (6% раствор перекиси водо рода на 1 ч или других дезинфицирующих средств) или кипячением в течение 30 мин.
По окончании уборки для обеззараживания воздуха включается на 60 мин УФ-облучатель (облучатель-рециркулятор воздуха типа "Дезар"; установка обеззараживания воздуха "Поток").
Слайд 48При аварии в центрифуге после ее остановки, 30-40-минутной паузы (до
полного оседания частиц образовавшегося аэрозоля) и отключения от электросети необходимо:
неповрежденные
объекты (центрифужные пробирки и т. п.) изъять, обработать дезинфицирующим раствором и передать для продолжения необходимых технологических операций;гнездо ротора вместе с осколками пробирки (флакона) залить дезраствором, а после экспозиции не менее 1 ч последние удалить и поместить в емкость с дезраствором дополнительно на 1 ч;
внутреннюю поверхность центрифуги, в т. ч. крышки, и ротор тщательно обработать дезраствором (экспозиция 1 ч).
Только после этого работа на центрифуге может быть продолжена.
Слайд 49При повреждении кожных покровов необходимо немедленно обработать перчатки дезраствором и
снять их. Затем выдавить каплю крови из ранки, последнюю обработать
двукратно с интервалом 5 мин 70% спиртом (кожным антисептиком), смазать края ранки 5% спиртовой настойкой йода.При загрязнении кожи рук кровью следует немедленно обработать их в течение 1 мин тампоном, смоченным кожным антисептиком, разрешенным к применению, вымыть руки двукратно теплой проточной водой с мылом и насухо вытереть индивидуальным полотенцем (салфеткой).
10. При попадании крови или других биологических жидкостей:
на слизистые глаз - их следует сразу же промыть 0,01% раствором марганцевокислого калия, приготовленного ех tempore (навеска 0,05г растворяется в 0,5 л дистиллированной воды);
на слизистую носа - обработать 0,05% раствором марганцевокислого калия (навеска 0,25г растворяется в 0,5л дистиллированной воды);
на слизистую рта - прополоскать 70% спиртом или 0,05 % раствором марганцевокислого калия.
Слайд 50В лаборатории должен быть журнал регистрации аварий, где отмечаются: дата, время,
место, характер аварии,
фамилия, имя и отчество лиц, находившихся непосредственно
в зоне ее воздействия, а также проведенные мероприятия.О происшедшей аварии и проведенных мероприятиях заведующий лабораторией докладывает главному врачу ЛПУ и председателю комиссии по контролю за соблюдением требований биологической безопасности.
За лицами, находившимися в помещении, где произошла авария, устанавливается медицинское наблюдение на срок инкубационного периода.
Слайд 51КДЛ амбулаторно-
поликлинического звена
Состоявшееся решение - укрепить оснащенность ЛПУ оборудованием,
в т.ч. лабораторным
А) создан табель оснащения КДЛ
Б) из Федерального Фонда
выделены средства на закупку оборудованияВ) проведен тендер на закупку 4 комплектов (ЛОТов) лабораторного оборудования
Г) на основании заявок с территорий составлен реестр распределения оборудования
Слайд 52ЛОТ № 1 (поставщик Эко-Мед-С)
Автоматический биохимический анализатор
240
тестов/час
Произвольный порядок выполнения 24 тестов
Работает на любых реагентах
Моющиеся долгосрочные кюветы
Выполняет
любые турбидиметрические методикиСАПФИР – 400 (Япония)