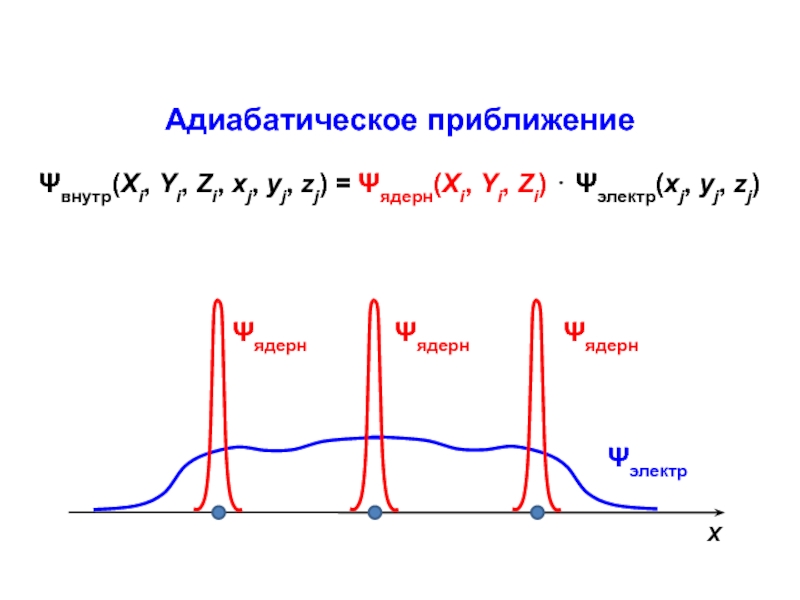
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ядерный остов молекул
Содержание
- 1. Ядерный остов молекул
- 2. Слайд 2
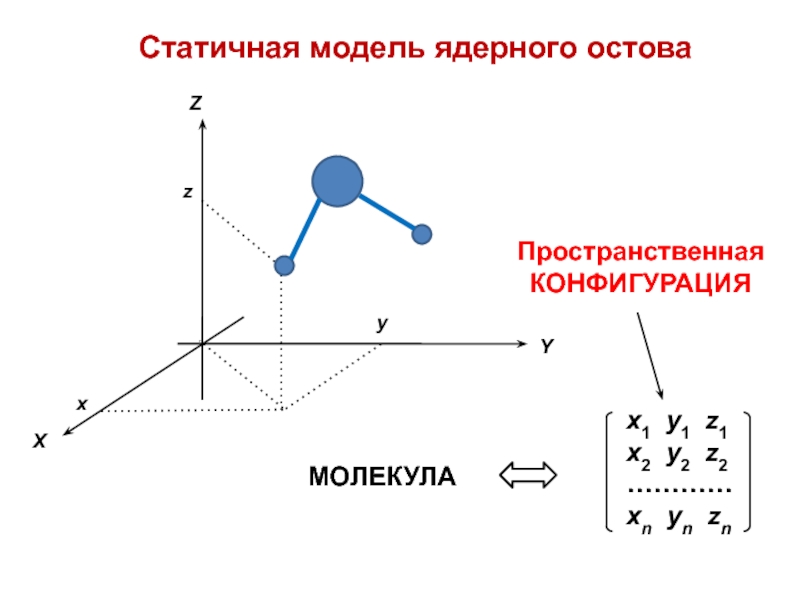
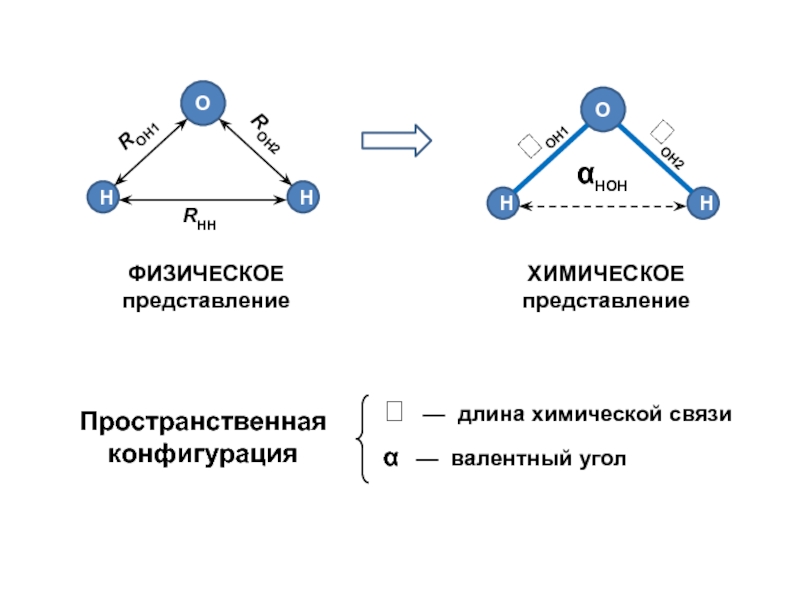
- 3. Статичная модель ядерного остова
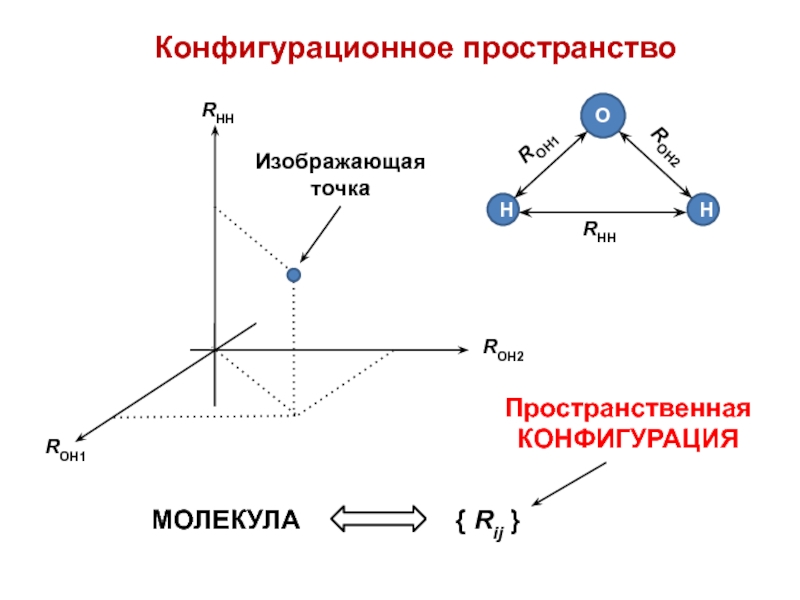
- 4. Конфигурационное пространство
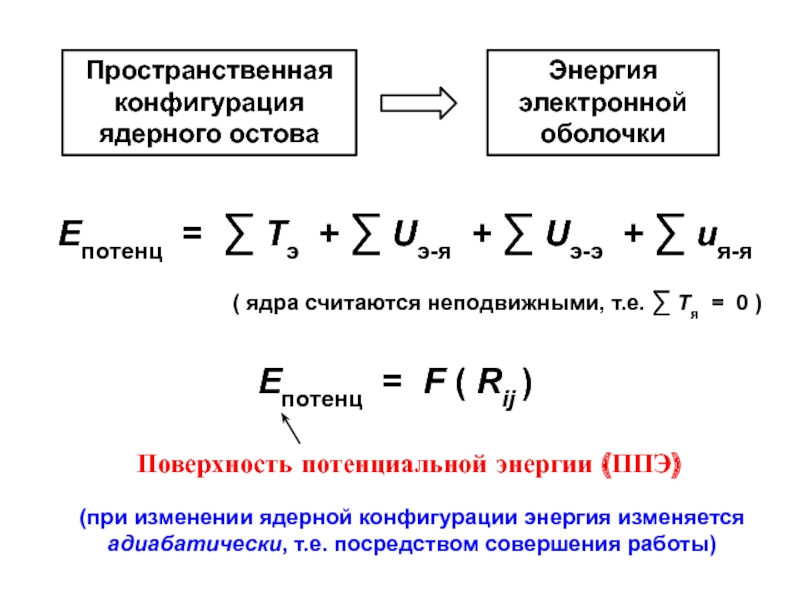
- 5. Епотенц = F ( Rij )(при изменении ядерной конфигурации энергия изменяется адиабатически, т.е. посредством совершения работы)
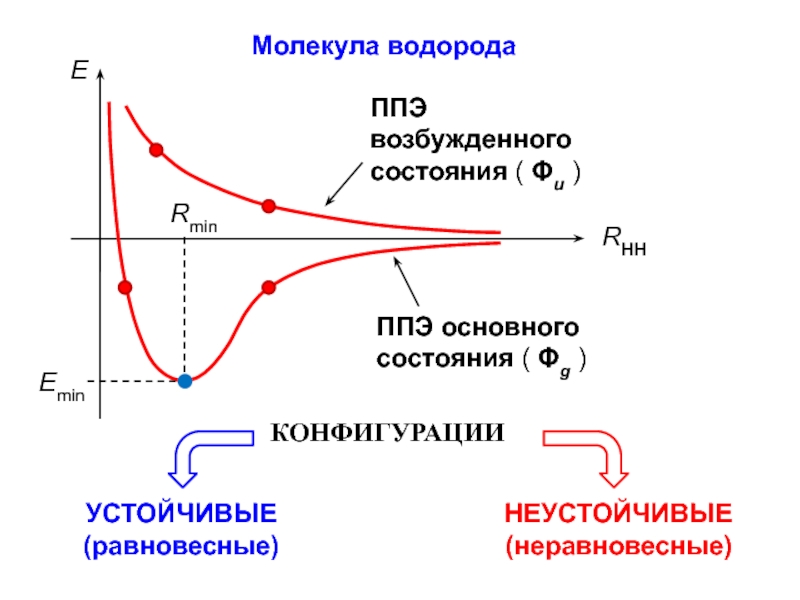
- 6. Молекула водорода
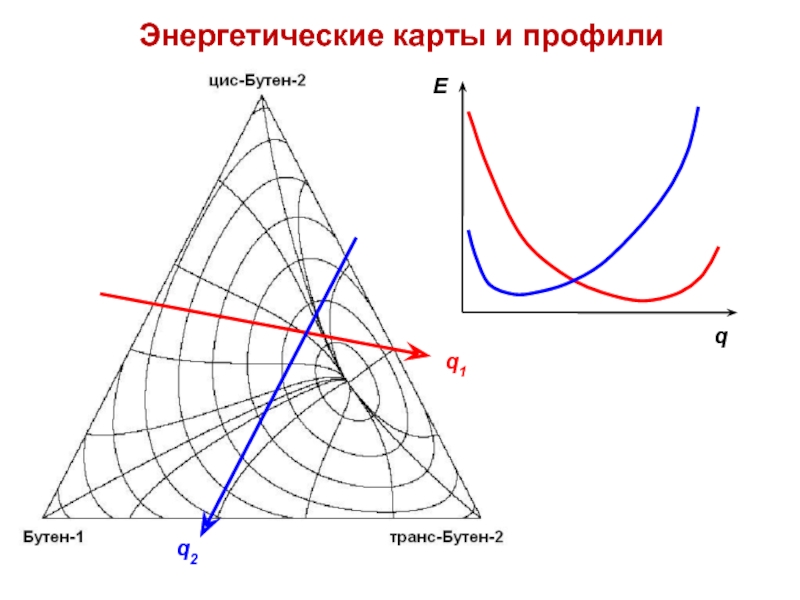
- 7. Энергетические карты и профили
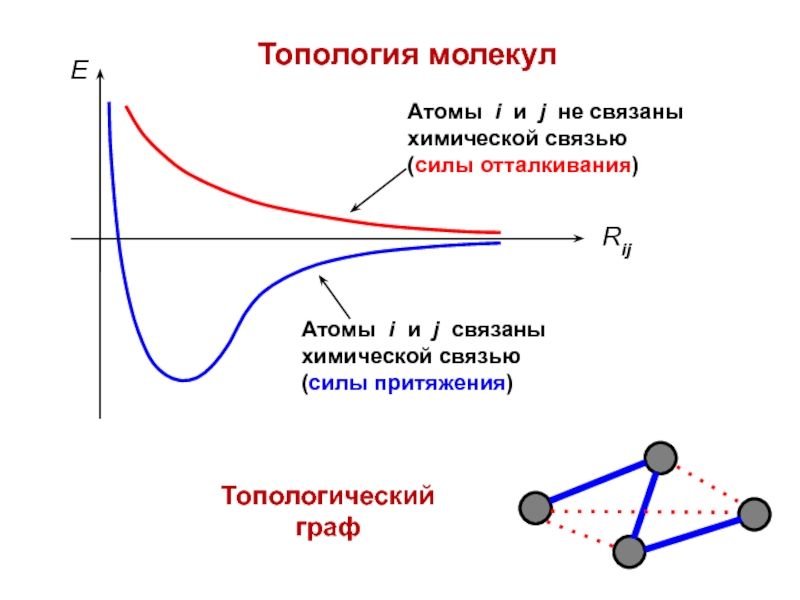
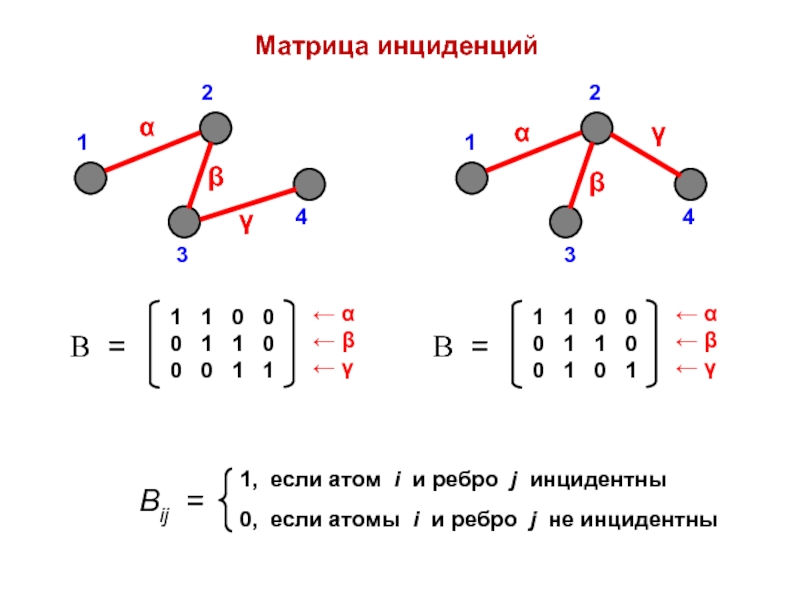
- 8. Топология молекулТопологический граф
- 9. Слайд 9
- 10. Топологические графы и матрицыТопологическая матрица (матрица смежности)
- 11. Матрица инциденций
- 12. Топологический граф фермента «алкогольдегидрогеназа»
- 13. Химические формы (указаны все химические связи)
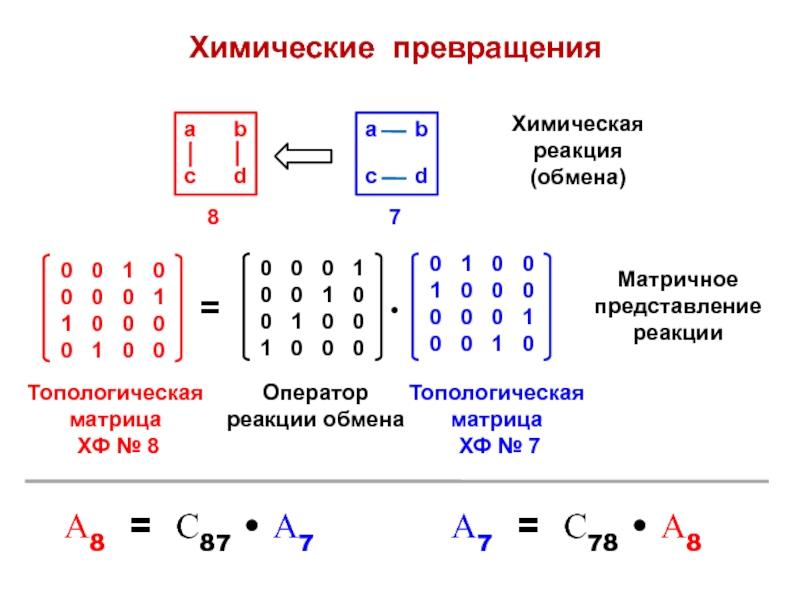
- 14. Химические превращенияХимическая реакция (обмена)Матричное представление реакцииОператор реакции обменаА7 = С78 • А8
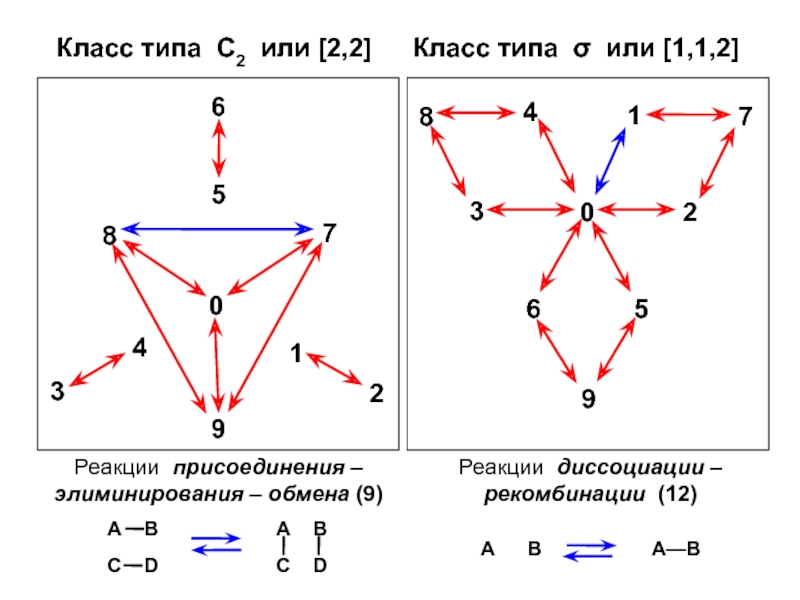
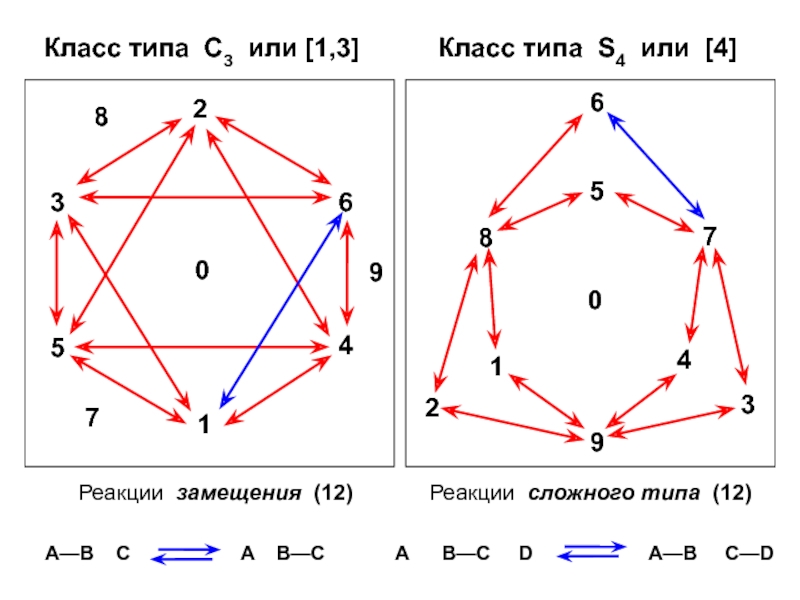
- 15. В совокупности из 10 химических форм возможно
- 16. Слайд 16
- 17. Слайд 17
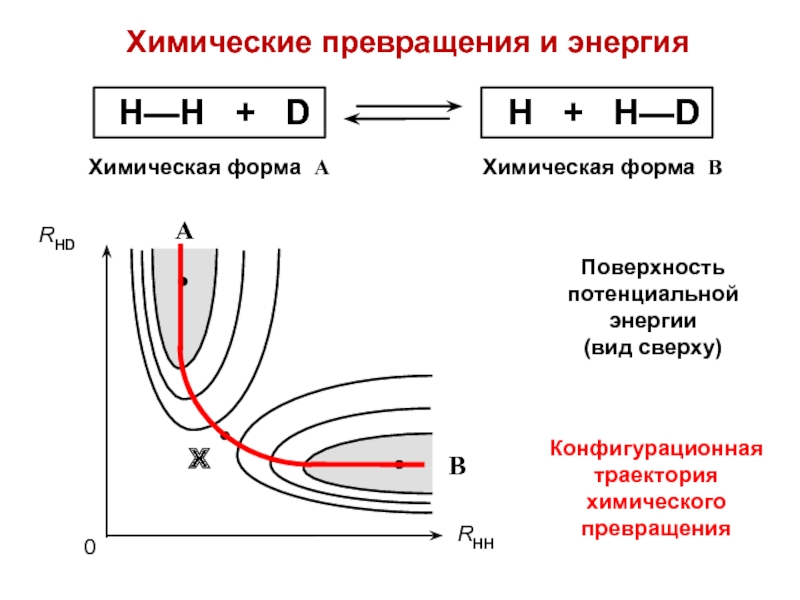
- 18. Химические превращения и энергияКонфигурационная траектория химического превращенияПоверхность потенциальной энергии (вид сверху)
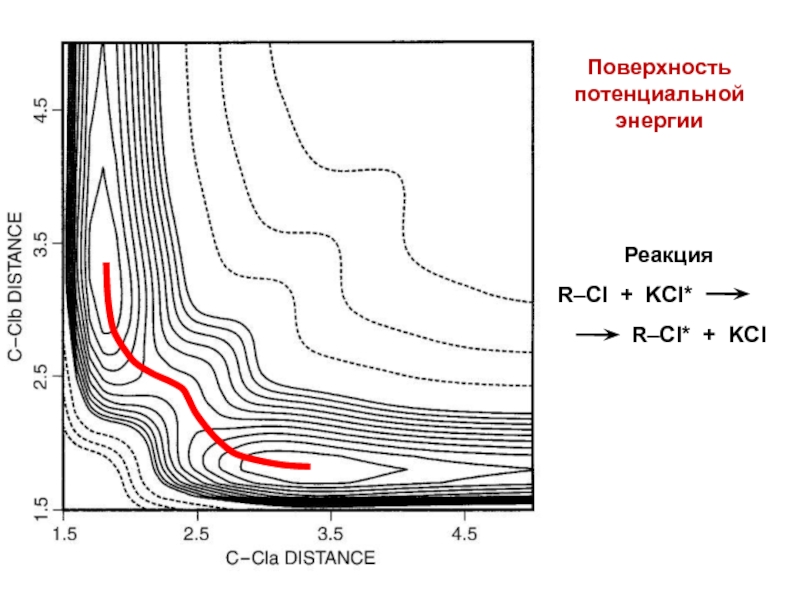
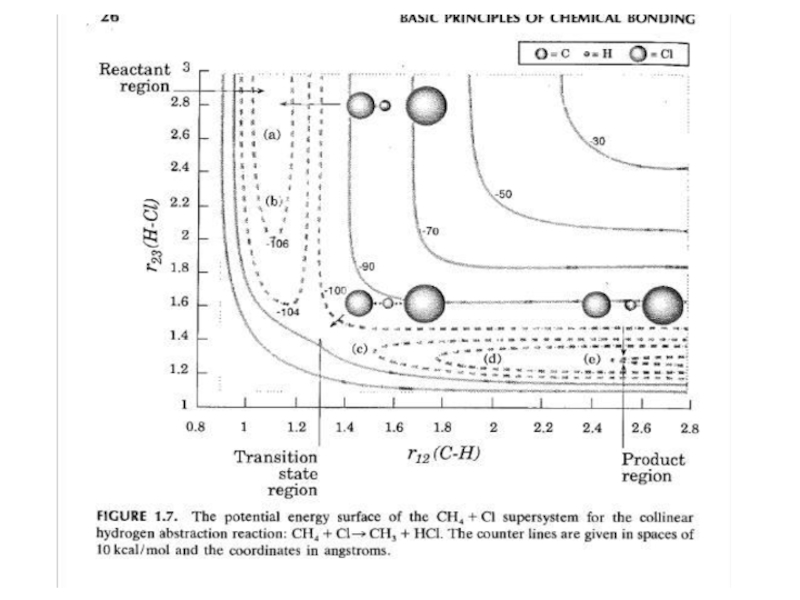
- 19. Поверхность потенциальной энергии
- 20. Слайд 20
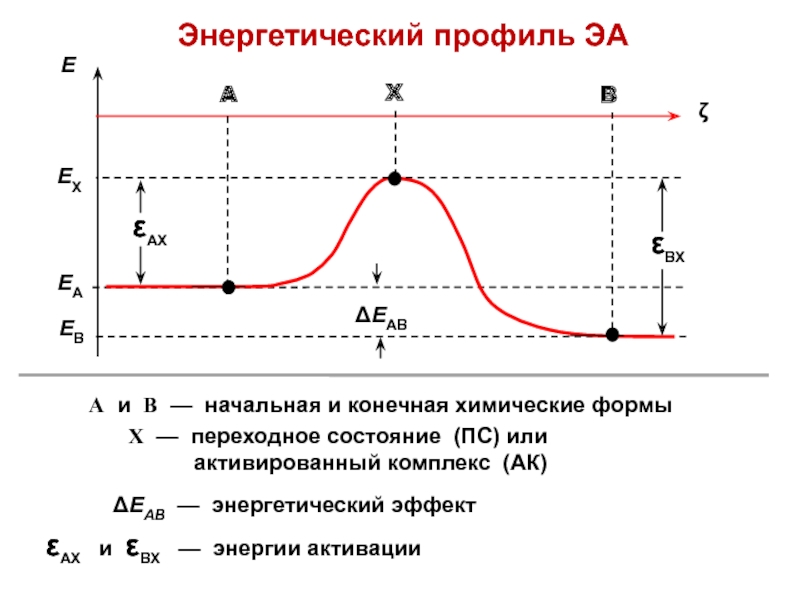
- 21. Энергетический профиль ЭАА и В — начальная
- 22. Константа равновесияКонстанты скорости
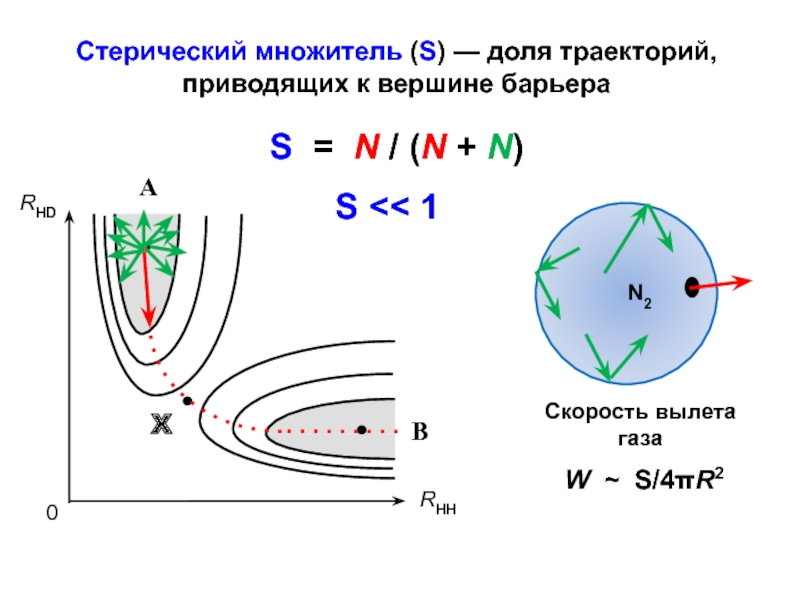
- 23. Стерический множитель (S) — доля траекторий, приводящих
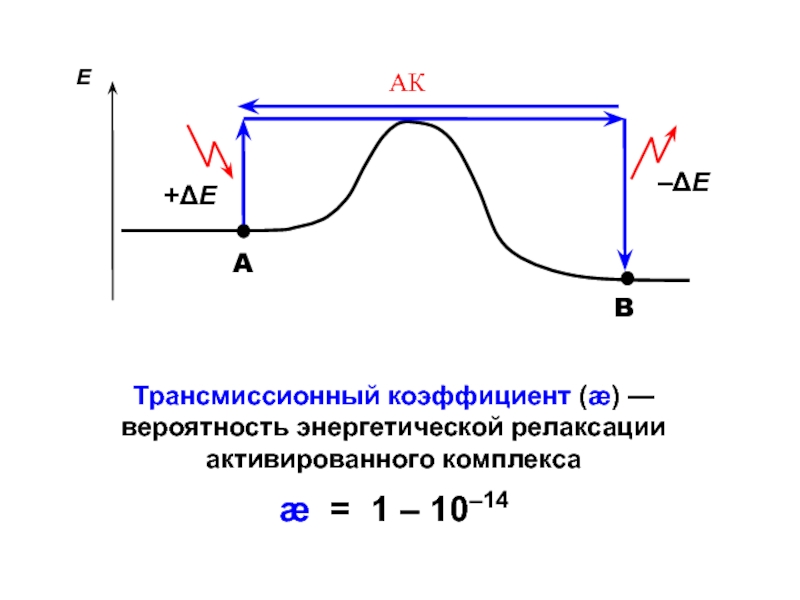
- 24. Трансмиссионный коэффициент (æ) — вероятность энергетической релаксации активированного комплексаæ = 1 – 10–14
- 25. Цель: оценка высоты потенциального барьера, разделяющего исходную
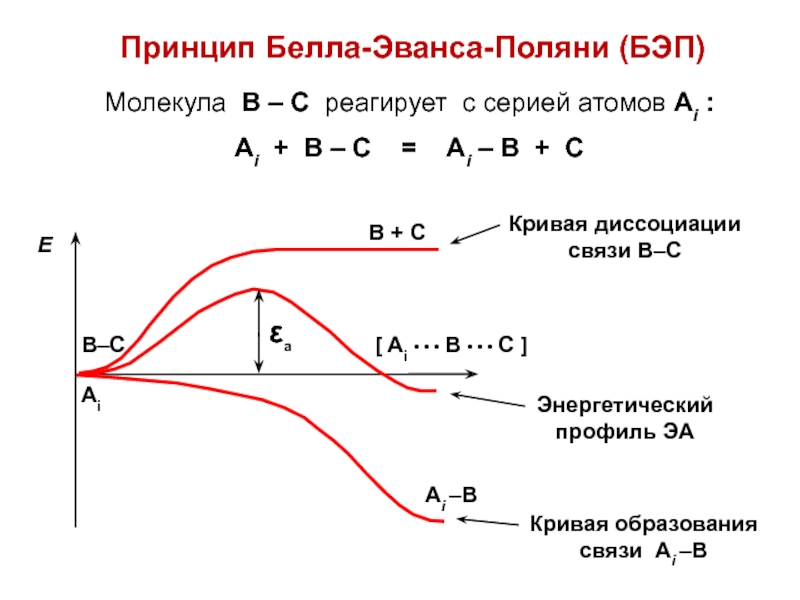
- 26. Принцип Белла-Эванса-Поляни (БЭП)Молекула В – С реагирует
- 27. При постоянной верхней кривой, описывающей разрывающуюся связь,
- 28. Для газофазных реакций присоединения-элиминирования имеют место соотношения:εа
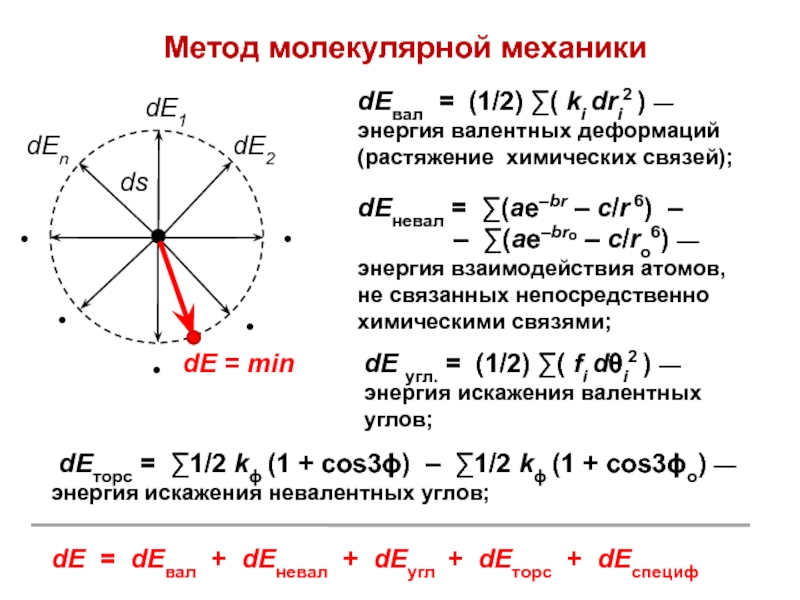
- 29. Метод молекулярной механикиdЕвал = (1/2) ∑( ki
- 30. R–Br + Br*– ⎯⎯→ RBr*
- 31. Θ
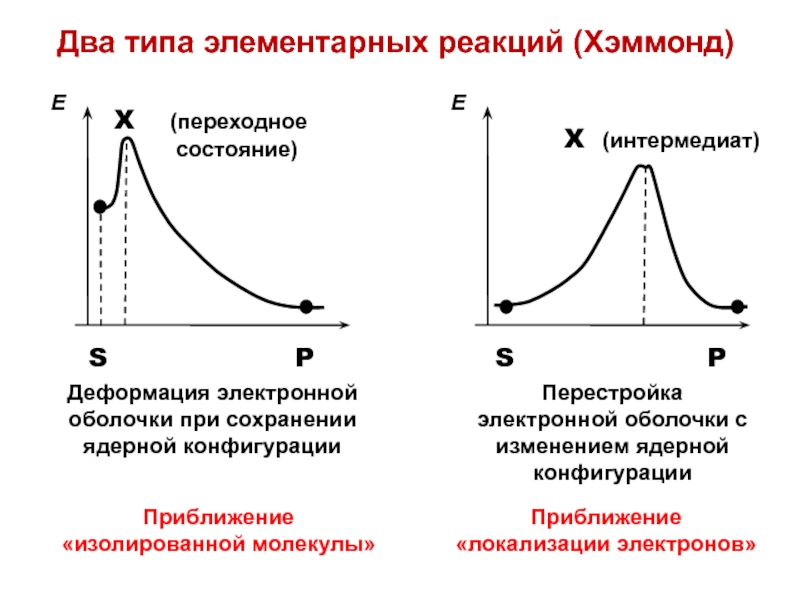
- 32. Два типа элементарных реакций (Хэммонд)
- 33. Приближение «изолированной молекулы»δEэл ~ 〈ni 〉 δαi
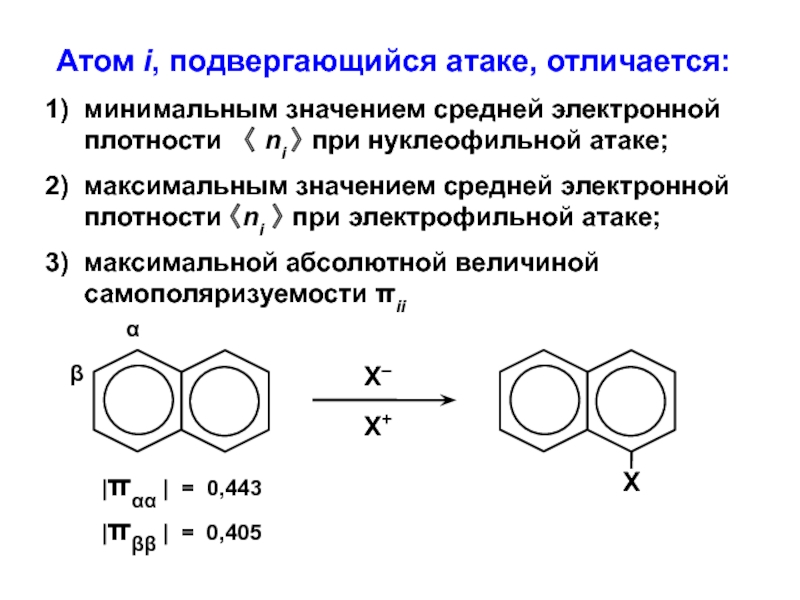
- 34. Атом i, подвергающийся атаке, отличается:1) минимальным значением
- 35. Слайд 35
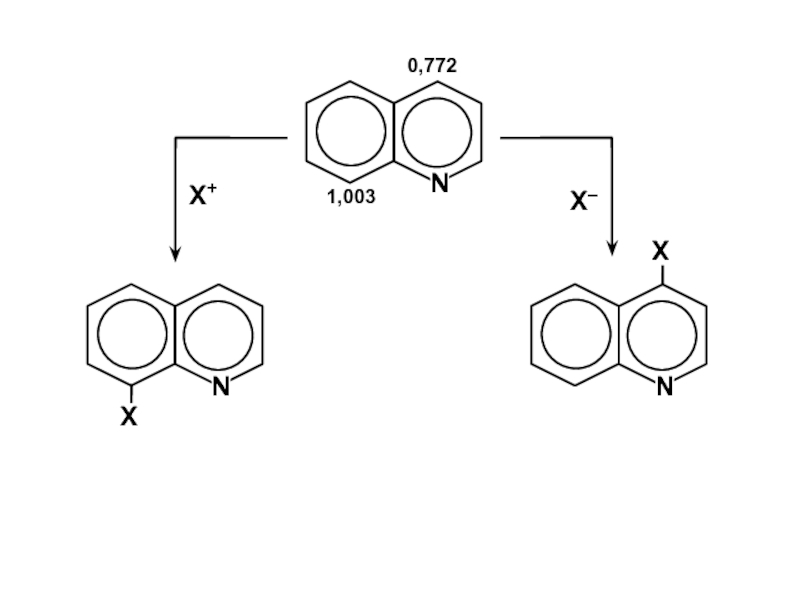
- 36. δEэл ~ 2 (1,73 –
- 37. Слайд 37
- 38. Приближение «локализации электронов»Активированный комплекс представляет собой интермедиат
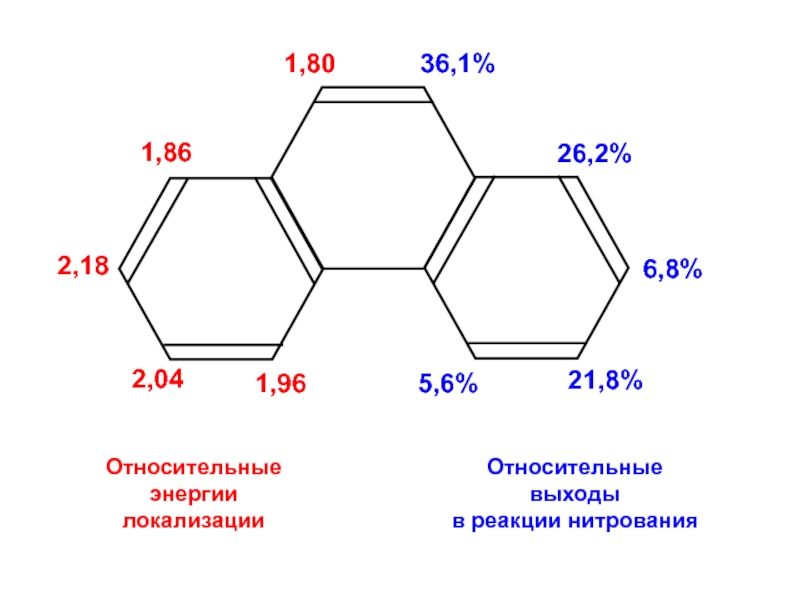
- 39. Относительные энергии локализацииОтносительные выходы в реакции нитрования
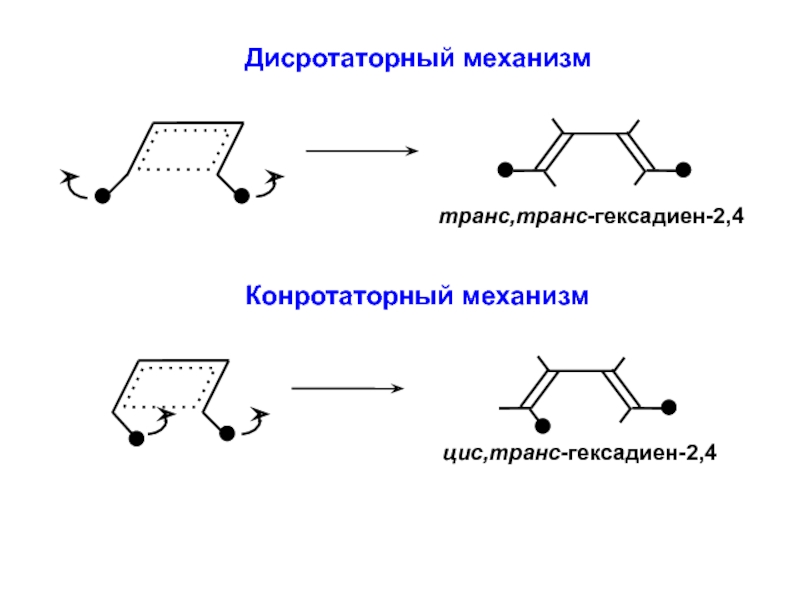
- 40. Принцип сохранения орбитальной симметрии(Р. Вудворд, Р. Хоффман)Электроциклическая
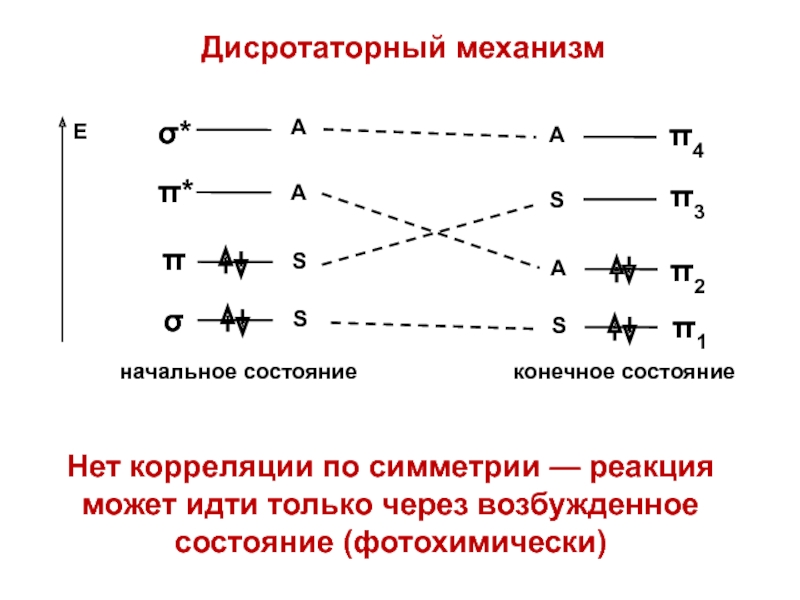
- 41. Дисротаторный механизм
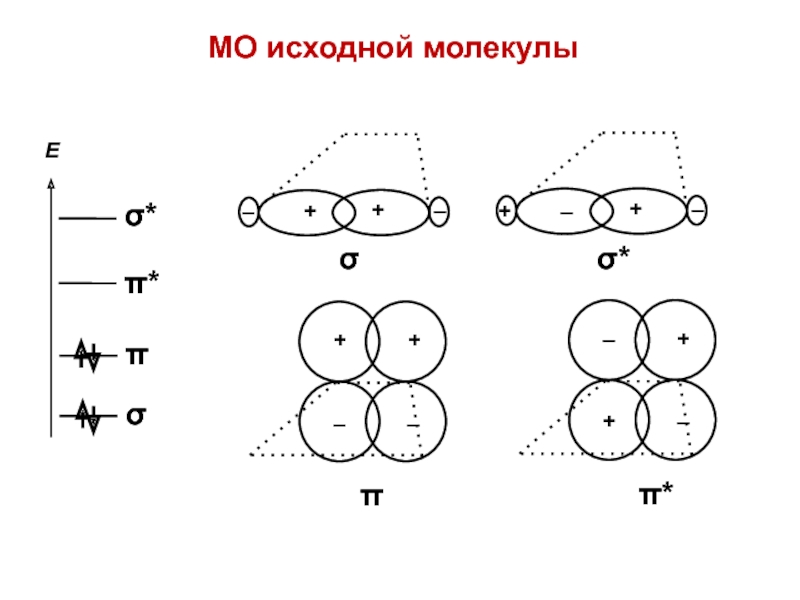
- 42. + – σМО исходной молекулы
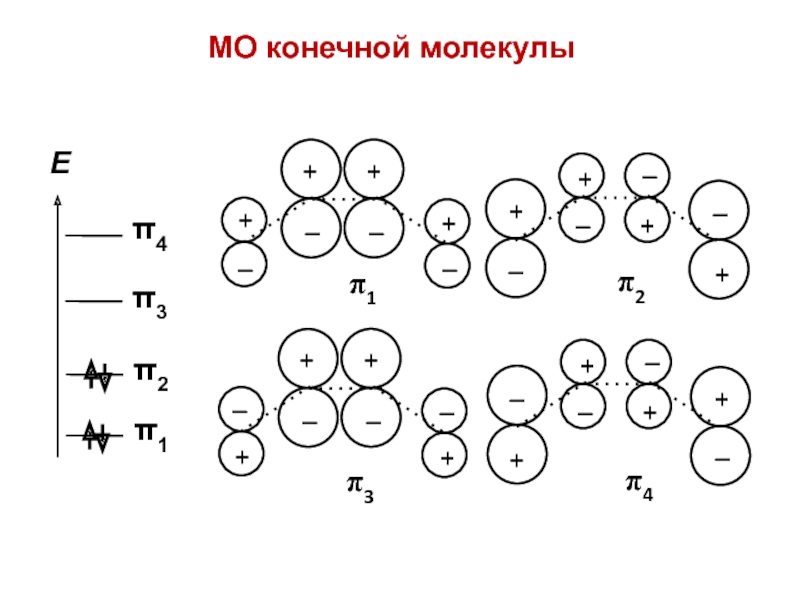
- 43. МО конечной молекулы
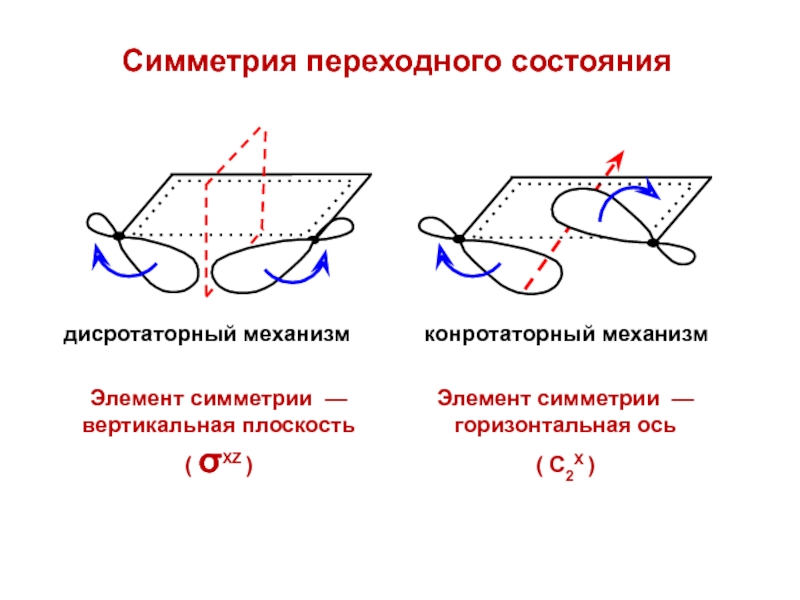
- 44. Симметрия переходного состояния
- 45. Дисротаторный механизмНет корреляции по симметрии — реакция может идти только через возбужденное состояние (фотохимически)
- 46. Дисротаторный механизмНет корреляции по симметрии — реакция может идти только через возбужденное состояние (фотохимически)
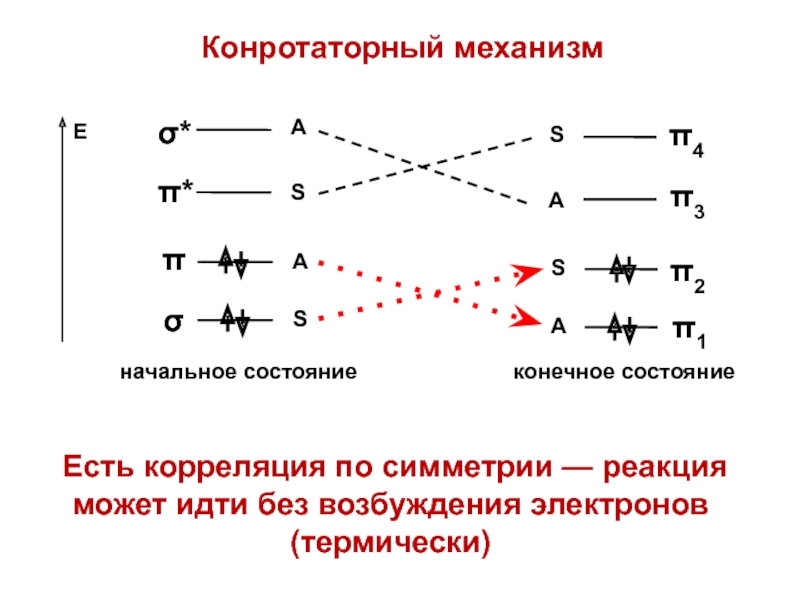
- 47. Конротаторный механизмЕсть корреляция по симметрии — реакция может идти без возбуждения электронов (термически)
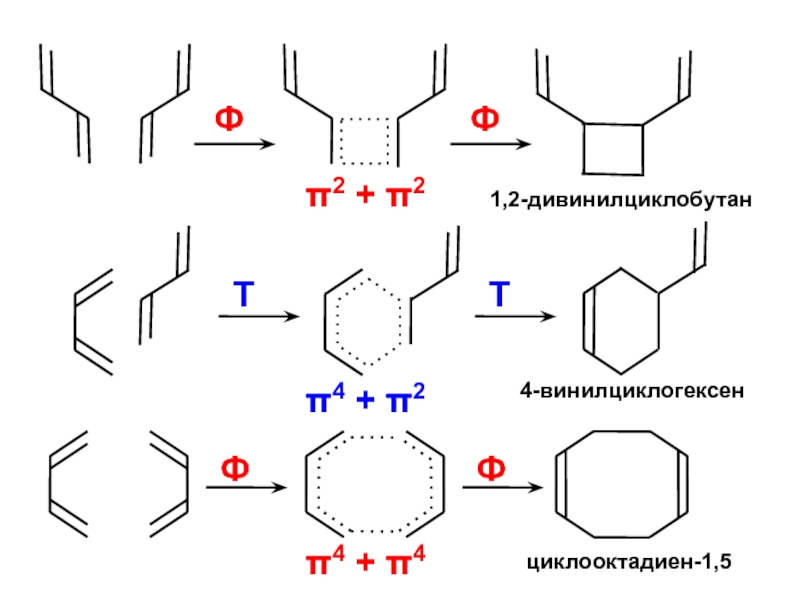
- 48. Образуется при облучении(фотохимический режим)Образуется без облучения(термохимический режим)
- 49. Слайд 49
- 50. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Епотенц = F ( Rij )
(при изменении ядерной конфигурации энергия
изменяется адиабатически, т.е. посредством совершения работы)
Слайд 14Химические превращения
Химическая реакция (обмена)
Матричное представление реакции
Оператор реакции обмена
А7 = С78
• А8
Слайд 15В совокупности из 10 химических форм возможно 90 химических реакций
(или 45 двусторонних)
Для записи этих химических реакций в матричной форме
требуется 24 оператора типа СijОни образуют ГРУППУ, изоморфную точечной группе тетраэдра Td или группе перестановок S4
Эту группу можно разделить на 5 классов эквивалентости:
Слайд 18Химические превращения и энергия
Конфигурационная траектория химического превращения
Поверхность потенциальной энергии
(вид
сверху)
Слайд 21Энергетический профиль ЭА
А и В — начальная и конечная химические
формы
ΔЕАВ — энергетический эффект
εАХ и εВХ —
энергии активации Х — переходное состояние (ПС) или активированный комплекс (АК)
Слайд 24Трансмиссионный коэффициент (æ) — вероятность энергетической релаксации активированного комплекса
æ =
1 – 10–14
Слайд 25Цель: оценка высоты потенциального барьера, разделяющего исходную и конечую химические
формы (энергии АК).
Два типа задач:
сравнение реакционной способности серии реагентов в
однотипной реакции,оценка селективностей превращения по нескольким альтернативным направлениям (каналам).
Теория абсолютных скоростей (ТАС)
Приближенные варианты
Слайд 26Принцип Белла-Эванса-Поляни (БЭП)
Молекула В – С реагирует с серией атомов
Аi :
Аi + В – С = Аi
– В + ССлайд 27При постоянной верхней кривой, описывающей разрывающуюся связь, величина энергии активации
будет тем меньше, чем ниже проходит вторая кривая, соответствующая образующейся
связи.Следовательно, чем больше суммарный выигрыш в энергии (энергетический эффект ΔH ), тем меньше энергия активации.
Уравнение Эванса-Поляни
εа = а + bΔH
(позволяет оценить энергию активации через термодинамические характеристики реагентов)
Слайд 28Для газофазных реакций присоединения-элиминирования имеют место соотношения:
εа = 48 +
0,25 ΔH (элиминирование)
εа = 48 + 0,75 ΔH
(присоединение)Уравнение Сабо
εа = ∑ Di – α ∑ Dj
где Di — энергии диссоциации разрушающихся связей,
Dj — энергии диссоциации образующихся связей.
Слайд 29Метод молекулярной механики
dЕвал = (1/2) ∑( ki dri2 ) —
энергия валентных деформаций (растяжение химических связей);
dЕневал = ∑(ae–br – c/r
6) –– ∑(ae–bro – c/ro6) — энергия взаимодействия атомов, не связанных непосредственно химическими связями;
dЕ угл. = (1/2) ∑( fi dθi2 ) — энергия искажения валентных углов;
dЕторс = ∑1/2 kϕ (1 + cos3ϕ) – ∑1/2 kϕ (1 + cos3ϕo) — энергия искажения невалентных углов;
Слайд 33Приближение «изолированной молекулы»
δEэл ~ 〈ni 〉 δαi + (1/2) πii
(δαi)2
〈ni 〉 — средняя электронная плотность i-го атома,
δαi —
изменение кулоновского интеграла i-го атома (положительно в нуклеофильных реакциях, отрицательно в электрофильных реакциях);πii — самополяризуемость i-го атома (отрицательна);
Энергия возмущения электронной оболочки в
нуклеофильной реакции S + :Nu– →
электрофильной реакции S + ⊃E+ →
Слайд 34Атом i, подвергающийся атаке, отличается:
1) минимальным значением средней электронной плотности
〈 ni 〉 при нуклеофильной атаке;
2) максимальным значением средней
электронной плотности 〈ni 〉 при электрофильной атаке;3) максимальной абсолютной величиной самополяризуемости πii
Слайд 36δEэл ~ 2 (1,73 – Fi ) δβ
δβ
— изменение резонансного интеграла для связей атакуемого атома со своими
соседями (δβ > 0),Fi — индекс свободной валентности i-го атома.
Энергия возмущения электронной оболочки в
радикальной реакции S + •R →
Атом i, подвергающийся радикальной атаке, отличается:
1) максимальным значением индекса реакционной способности Fi