Слайд 1Занятие 3.
МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ (МГК)
Слайд 2Медико-генетическое консультирование (МГК) - это специализированная помощь населению по предупреждению
появления в семье больных с наследственной патологией. Согласно современным представлениям
МГК - это коммуникативный процесс, в результате которого активно заинтересованные пациенты (либо их родственники) с наследственными заболеваниями получают сведения о характере данного заболевания, а также способах его предупреждения и лечения.
Основные задачи МГК:
1) медико-генетическое консультирование семей;
2) диагностики хромосомных и моногенных заболеваний;
3) внедрение массового забора образцов крови у новорожденных в родильных домах для выполнения скрининга по выявлению муковисцидоза, фенилкетонурии, адрено-генитального синдрома, галактоземии и гипотиреоза;
4) внедрение и проведение скрининга у беременных на сывороточные маркеры, с включением ультразвукового сканирования, в 1-м триместре и при необходимости во 2-м триместре беременности для выделения группы риска по рождению детей с хромосомными аномалиями, моногенными заболеваниями и ВПР;
5) внедрение и проведение методов селективного скрининга и диагностика моногенных заболеваний углеводного и других обменов;
6) осуществление ультразвуковой и инвазивной пренатальной диагностики хромосомных, моногенных заболеваний и ВПР у плода;
7) развитие и осуществление медико-социальной реабилитации семей, имеющих больных детей;
8) пропаганда медико-генетических знаний, как среди врачей, так и среди населения.

Слайд 3Показания для МГК:
1) установленная или подозреваемая наследственная болезнь в
семье - рождение ребенка с врожденным пороком развития; задержка физического
развития или умственная отсталость у ребенка; аномалии полового развития;
2) повторные спонтанные аборты, выкидыши, мертворождения; выявление патологии в ходе просеивающих программ;
3) кровнородственные браки;
4) воздействие известных или возможных тератогенов в первые 3 месяца беременности;
5) неблагополучное протекание беременности.
В принципе, каждая супружеская пара должна пройти медико-генетическое консультирование до планирования деторождения (проспективно) и безусловно после рождения больного ребенка (ретроспективно).
Слайд 4Условно процесс МГК можно разделить на несколько этапов:
1.Верификация клинического диагноза
наследственного (или предположительно наследственного) заболевания: на данном этапе крайне важна роль
клинициста, в том числе, врача-педиатра, и особенно в случаях, когда, в силу обстоятельств, недоступен осмотр генетика.
2.Установление характера наследования заболевания в консультируемой семье: проводится в рамках клинико-генеалогического метода. О типе наследования нельзя однозначно судить при малочисленности семьи, что актуально в наше время.
Слайд 53. Оценка генетического риска повторения заболевания (генетический прогноз):принципиально выделяют два
способа оценки генетического риска - теоретический (для моногенных заболеваний) и
эмпирический (мультифакториальные и хромосомные болезни).
4. Определение наиболее эффективных способов профилактики: зависит от конкретной ситуации. Необходимо учитывать возраст консультируемых, состав семьи (наличие либо отсутствие здоровых детей), тяжесть заболевания, возможность пренатальной диагностики, религиозные установки семьи и т.д.
5. Объяснение обратившимся смысла собранной и проанализированной медико-генетической информации: проводится в максимально доступной и недирективной форме; критерием эффективности МГК на данном этапе является понимаемость со стороны консультируемого той информации, которую дает врач.
Слайд 6МГК как форма профилактики наследственных и врожденных заболеваний связано с
другими видами медико-гентической помощи населению:
пренатальной диагностикой,
скринирующими программами,
преконцепционной профилактикой.
Слайд 7СКРИНИРУЮЩИЕ ПРОГРАММЫ
Основной целью скринирующих (просеивающих) программ является выявление того или
иного заболевания в доклинической стадии. Прежде всего это касается наследственных
болезней обмена. Они включаются в программы массового просеивания, отбираются по ряду критериев (К.Д.Краснопольская, 1986):
1. Заболевания, приводящие к выраженному снижению жизне - и трудоспособности без своевременного выявления и лечения.
2. Заболевания, достаточно распространенные в популяции (частота не менее 1:50 000 - 200 000 новорожденных).
3. Заболевания, которые поддаются лечению с достижением принципиального эффекта для пациента, для которых разработаны эффективные методы профилактики.
4. Заболевания, для которых разработан адекватный просеивающий тест.
Слайд 8Сегодня в числе скринируемых заболеваний:
- муковисцидоз (частота - 1:1,5-2
000),
- врожденный гипотиреоз (1:4,7-5 000),
- недостаточность альфа-1-антитрипсина (1:5
000),
- фенилкетонурия (1:10 000), гистидинемия (1:23 000),
- галактоземия (1:35-50 000),
- лейциноз (1:90-120 000),
- аргинин-янтарнаая ацидурия (1:300 000),
- тирозинемия (1:900 000),
- недостаточность аденозиндезаминазы (1:1 500 000),
- болезнь Тея-Сакса (частота в популяции евреев-ашкенази - 1:3 700) и т.д.
Следует подчеркнуть, что процедура скрининга не обеспечивает окончательного диагноза, а выявляет предположительных “больных”, которым на втором этапе требуется специализированное углубленное обследование с использованием биохимических, молекулярно-генетических и клинических методов диагностики.
Слайд 9 В настоящее время медико-генетическая служба страны разделена на 4
уровня. Каждый уровень соответствует своим задачам и клинико-лабораторным возможностям.
Первый
уровень – лечебно-профилактические учреждения всех профилей. Основная задача специалистов на этом уровне заключается в выявлении наследственных и врожденных заболеваний с выраженным фенотипом. К таковым относятся хромосомные синдромы (синдромы Дауна, Шерешевского - Тернера, Клайфелтера), состояния, при которых показано проведение дифференциального диагноза с моногенными заболеваниями (муковисцидоз, фенилкетонурия, адрено-генитальный синдром, гепатолентикулярная дегенерация и многие другие), ВПР – расщелина губы и неба, врожденные дефекты опорно-двигательной системы, детский церебральный паралич, сложные симптомокомплексы с включением врожденного порока сердца и многие др.
Слайд 10В предыдущих слайдах нами рассмотрены показания для направления пациента к
врачу-генетику. Ответственная роль в отборе женщин высокого риска по рождению
больных детей с наследственной и врожденной патологией принадлежит врачам женских консультаций, своевременно направляющих беременных на консультацию к врачу-генетику для решения вопроса о проведении пренатальной диагностики.
Второй уровень – областные и республиканские лечебно-профилактические учреждения, в задачу которых входит все сказанное выше. Однако на этом уровне имеются больше возможностей проведения широкого спектра лабораторно-биохимических и функциональных методов исследования.
Третий уровень – областные (республиканские, краевые) медико-генетические консультации (МГК). Задачи МГК рассмотрены ранее.
Слайд 11Четвертый уровень – федеральный. К этому уровню относятся специализированные медико-генетические
центры (МГЦ), в штат которых входят высоко профессиональные, эрудированные, опытные
специалисты. МГЦ располагает высокопрецизионным дорогостоящим оборудованием, как для проведения лабораторно-биохимических, цито- и молекулярно-генетических исследований, так и инструментальных исследований. Функциональная задача МГЦ соответствует выполнению всех перечисленных ниже программ, но с более широкими возможностями как со стороны врачебного персонала, так и с технической стороны. МГК и особенно МГЦ тесно взаимодействуют с научными клиническими и медико-генетическими подразделениями (медицинские и биологические институты, кафедры, специализированные центры) как в городе, где находится МГК и МГЦ, так и с научно-исследовательскими центрами федерального значения.
Слайд 12Скрининрующие программы как профилактика врожденной и наследственной патологии
Целью программ
скрининга является отбор лиц, обладающих повышенным риском развития определенной патологии,
из общей популяции или какой-то ограниченной группы населения. Важно подчеркнуть, что положительный тест при скрининге не является диагнозом заболевания, а служит лишь указанием на необходимость более тщательного обследования пациента. Скрининг может быть массовым, когда анализу подвергается не менее 80% из обследуемой группы населения, или селективным, если выборочно анализируется лишь часть этой группы. Любой скрининг проводится только с добровольного согласия обследуемого, его результаты строго конфиденциальны, и их интерпретация проводится только врачом. Хорошо известными примерами является инструментальные массовые скрининги, например, рентгенологический или ультразвуковой.
Слайд 13 В качестве тестов для проведения генетического скрининга могут быть
выбраны любые маркеры: биохимические, иммунологические, цитогенетические, молекулярные. Однако необходимыми требованиями
для тестов являются быстрота и экономичность исследования. Поэтому для проведения массовых скринингов, наряду с инструментальными, чаще всего используют биохимические или иммунологические тесты, в то время как цитогенетические или молекулярные скрининги всегда носят селективный характер. Примером цитогенетического скрининга является определение кариотипа плода беременных женщин, достигших определенного возрастного рубежа. В некоторых странах это 35 лет, в других 38 или даже 40 лет. Как мы уже неоднократно отмечали, необходимость такого скрининга объясняется резким увеличением с возрастом матери вероятности возникновения хромосомной патологии у плода, в первую очередь, синдрома Дауна.
Слайд 14Молекулярные скрининги на гетерозиготное носительство мажорных мутаций проводятся среди тех
этнических групп или в тех географических регионах, где эти мутации
имеют наибольшее распространение. Так, например, в Израиле проводится тотальный скрининг среди женщин и лиц репродуктивного возраста на носительство мажорных мутаций соответственно в генах BRCA1 и BRCA2, ассоциированных с раком молочной железы, и в генах некоторых лизосомных ферментов, ассоциированных с наследственными болезнями обмена, особенно часто встречающимися среди евреев-ашкенази.
Остановимся более подробно на биохимических скринингах, которые проводятся среди беременных и новорожденных.
Слайд 15Биохимический скрининг маркерных белков при беременности
Основной целью биохимического скрининга
беременных является отбор женщин, имеющих повышенную вероятность хромосомных заболеваний у
плода и некоторых ВПР, таких как дефекты заращения нервной трубки (ДЗНТ) и дефект передней брюшной стенки (гастрошизис). В начале 70-х годов в работах D. Y. J. Brock с соавторами впервые было показано, что при наличии ДЗНТ у плода в крови беременных женщин резко возрастает содержание α-фетопротеина (АФП) – основного белка сыворотки крови плода, синтезируемого печенью. На определенных сроках беременности (16–18 недель) это повышение имеет диагностическое значение. Тест на АФП не является специфичным для ДЗНТ, и многие другие причины могут привести к его повышению. В первую очередь, это угроза прерывания беременности, многоплодная беременность, небольшой вес матери в сочетании с крупными размерами плода и др. Однако, при исключении этих причин стойкое повышение уровня АФП в крови беременной женщины является показанием для проведения более тщательного УЗИ, а затем и инвазивной пренатальной диагностики, в том случае, если при УЗИ ВПР не удается обнаружить.

Слайд 16При синдроме Дауна и некоторых других хромосомных аномалиях содержание АФП
в крови беременной женщины на более ранних сроках (14-16 недель)
снижено. В дальнейшем были найдены и другие эмбриональные маркеры, такие как хорионический гонадотропин человека (ХГЧ) и неконъюгированный эстриол (НЭ).
Чувствительность биохимического скрининга беременных для анэнцефалии достигает 98%, для открытой спинно-мозговой грыжи – 90%. Для синдрома Дауна чувствительность биохимического скрининга составляет 67-72%, при 5-6% ложноположительных результатов. Чувствительность скрининга повышается, а число ложноположительных результатов снижается при комбинированном подходе с учетом УЗИ -маркеров и некоторых других показателей. Значительные отклонения маркерных белков от нормы в сочетании с нормальным кариотипом плода указывают на возможность развития плацентарной недостаточности и гипотрофии плода. Такие женщины нуждаются в дополнительном обследовании и проведении профилактики акушерской патологии.
Слайд 17Неонатальный биохимический скрининг
Биохимический скрининг новорожденных направлен на раннее выявление
лиц с патологическими изменениями генотипа и предотвращение развития тяжелых клинических
проявлений заболевания. Это основной метод вторичной профилактики наследственной патологии. Подобные скрининги целесообразно разрабатывать для распространенных болезней с тяжелым прогредиентным течением, приводящим к инвалидизации. Главным условием при этом является существование эффективных методов своевременно начатого лечения. Чувствительность самого скрининга определяется наличием достаточно простых надежных и экономичных специфических диагностических тестов.
Из нескольких тысяч наследственных заболеваний фенилкетонурия, муковисцидоз, галактоземия, адреногенитальный синдром и врожденный гипотиреоз относятся к таким патологиям, при которых своевременно начатое лечение способно предотвратить развитие тяжелых проявлений заболевания и глубокую инвалидизацию.
Слайд 18Причем, чем раньше начато лечение, тем благоприятнее прогноз для течения
болезни и для жизни больного ребенка. Частоты этих заболеваний в
различных популяциях колеблятся в пределах от 1:2000 до 1:20000, то есть это достаточно распространенные заболевания.
Скрининг на фенилкетонуриию является частью общего скрининга на гиперфенилаланинемию. Он проводится в несколько этапов
В ходе первого диагностического этапа, возможно использование качественных тестов на повышение концентрации фенилаланина в моче (проба Феллинга или флюориметрический метод, позволяющий быстро и точно определить повышение концентрации фенилаланина в образце крови обследуемого ребенка.
Слайд 19На уточняющем этапе проводится повторное обследование всех детей из группы
риска, и далее повторяется исследование на содержание фенилалалнина в крови
с использованием аминокислотного анализатора. При концентрации фенилалалнина в сыворотке крови > 15мг%, предполагается диагноз фенилкетонурии, а при концентрации 6-15мг% – гиперфенилаланинемии. При положительных тестах ребенку сразу назначается безфенилаланиновая диета, на основании эффективности которой планируются мероприятия по уточнению диагноза и выбору дальнейшей тактики необходимого лечения.
На заключительном этапе проводится дифференциальная диагностика наследственных гиперфенилаланинемий, и в первую очередь фенилкетонурии, с помощью молекулярно-генетических методов.
Слайд 20Если при этом не удается выявить мутаций в гене фенилаланингидроксилазы,
проводится измерение активности этого и других ферментов, участвующих в метаболизме
фенилалалнина. Исследование проводится в лейкоцитах, фибробластах, а затем и в гепатоцитах, полученных путем биопсии, на фоне пероральной нагрузки фенилалалнином. Определяется содержание птеринов в моче.
При скрининге новорожденных на муковисцидоз в качестве теста используют уровень неонатального иммунореактивного трипсина (ИРТ) в сыворотке крови, концентрация которого при муковисцидозе выше нормы, то есть составляет более 70 нг/мл. У детей группы риска повторно исследуют уровень ИРТ и проводят определение содержания хлоридов в поте (специфический тест на муковисцидоз). Если эти тесты оказываются положительными, назначается ДНК-диагностика. Диагноз муковисцидоза считается доказанным, если удается идентифицировать мутации в гене CFTR. Отметим, что в тех случаях, когда мутации не удается обнаружить, диагноз муковисцидоза не может быть исключен только на этом основании, так как у больного может быть редкая мутация, которую невозможно идентифицировать в условиях той лаборатории, в которой проводилась ДНК-диагностика.

Слайд 21Группа риска детей с адреногенитальным синдромом выявляется по исследованию в
образце крови 17-гидрооксипрогестерона (17-ОНР). Пороговая цифра концентрации этого белка составляет
30 нмоль/л. При таком показателе и выше исследование повторяется, а также выполняется ДНК-диагностика.
Для выявления галактоземии в предоставленном в лабораторию образце крови новорожденного исследуют содержание общей галактозы (галактозы и галактоза-1-фосфата). Результат скрининга можно считать отрицательным при уровне галактозы ниже 400 мкмоль/л (7,2 мг/дл). Окончательный диагноз галактоземии устанавливается только после детального исследования активности ряда ферментов, обусловливающих нормальный обмен галактозы, и проведения молекулярно-генетического исследования.
Слайд 22Врожденный гипотиреоз это гетерогенная группа моногенных и мультифакториальных заболеваний. Болезнь
дебютирует еще в периоде внутриутробного развития ребенка из-за поражения щитовидной
железы, в частности, недостаточности тиреотропных гормонов, прежде всего, циркулирующего тироксина. Ведущими причинами нарушения функции щитовидной железы могут быть метаболические дефекты, обусловленные генетическими нарушениями, воспалительные процессы в самой щитовидной железе, применение беременной повышенных доз тиреостатических препаратов. При дефиците продуктов щитовидной железы замедляются окислительные процессы, основной обмен и теплообмен. В частности, нарушается обмен мукополисахаридов, в результате чего в тканях накапливается большое количество креатинина и муцинозного вещества, приводящих к слизистому отеку – микседеме.
Слайд 23Наиболее яркая картина врожденного гипотиреоза проявляется к 4-6-му месяцу жизни,
особенно при естественном вскармливании. До этого времени тиреотропные гормоны ребенок
получает с молоком матери. Со временем их недостает организму, и у больного регистрируются тяжелые соматические и неврологические нарушения, при этом эффективность лечения снижается. Дети начинают резко отставать в росте, весе, психическом развитии, вяло реагируют на окружающее, перестают узнавать родителей. Все это обусловливает необходимость ранней диагностики заболевания путем биохимического неонатального скрининга.
В качестве основного скринирующего теста используют содержание в образец крови, взятый из пятки ребенка, тиреотропных гормонов гипофиза и гормонов щитовидной железы (тироксина и трийодтрионина). Концентрацию этих гормонов на первом этапе скрининга определяют иммуноферментным методом. Пороговой цифрой уровня тиреотропных гормонов для обследуемых в возрасте от 1 до 7 дней является 20 мкЕд/мл.
Слайд 24Уточняющее исследование проводят в 2-недельном возрасте, на этом сроке пороговым
значением тиреотропных гормонов является 5 мкЕд/мл и выше. К этому
сроку нормализуется большинство временных нарушений функции щитовидной железы, связанных с фетоплацентарной недостаточностью, родовой травмой, функциональной незрелостью, внутриутробной инфекцией и другими экзогенными причинами. Всем детям с повышенными значениями тиреотропных гормонов и низкими значениями гормонов щитовидной железы назначается курс L-тироксина. Они должны находиться на диспансерном наблюдении эндокринолога, как минимум, до 3-летнего возраста, когда может быть поставлен окончательный диагноз врожденного гипотиреоза.
Эффективность лечения больных фенилкетонурией, муковисцидозом, адреногенитальным синдромом, галактоземией и врожденным гипотиреозом во многом зависят от профессионализма и ответственного отношения к работе как со стороны врачебного и сестринского персонала родильных домов, так и специалистов медико-генетических центров (отделений).
Слайд 25Пренатальная диагностика наследственных заболеваний
В настоящее время одним из самых
приоритетных направлений в медицинской генетике является пренатальная диагностика (ПД) наследственных
и врожденных заболеваний. Каждый врач должен иметь представление об этом направлении. В задачи ПД входят:
1) выявление у плода тяжелой наследственной или врожденной патологии;
2) выработка рекомендаций по тактике ведения беременности;
3) медико-генетическое прогнозирование будущего потомства;
4) помощь в проведении новорожденным своевременных профилактических и лечебных мероприятий.
Слайд 26Методы пренатальной диагностики можно разделить на три группы:
Просеивающие (медико-генетическое консультирование,
определение уровня -фетопротеина (АФП) в сыворотке крови беременной, хорионического гонадотропина
(ХГЧ), неконъюгированного эстриола, ацетилхолинэстеразы и др.) - необходимые к применению у максимального количества беременных в определенные сроки беременности.
Неинвазивные (просеивающее и уточняющее УЗИ, магнитно-резонансная томография). Просеивающие УЗИ, согласно приказу Минздрава России, должны проводиться всем беременным женщинам 3-х кратно: в 10-14 , 19-22, 30-34 недели беременности. Возможно использование УЗИ начиная с 6-8 недели.
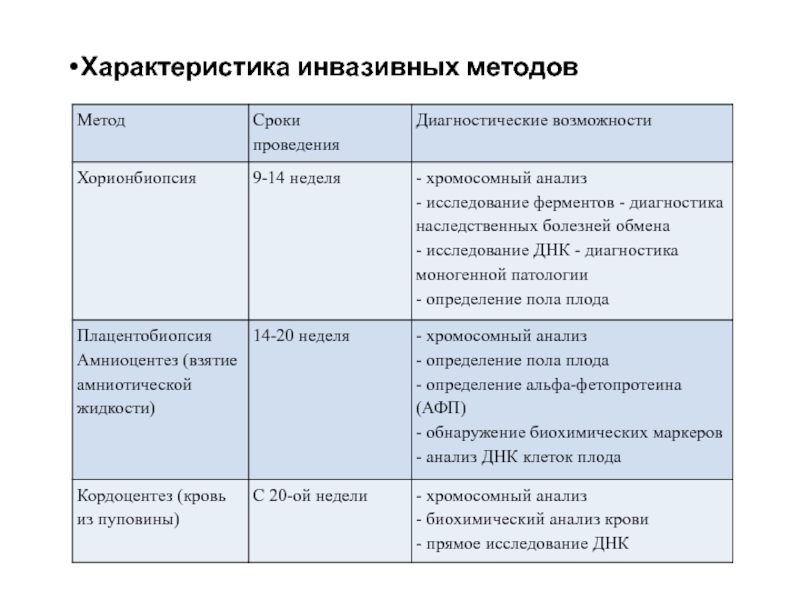
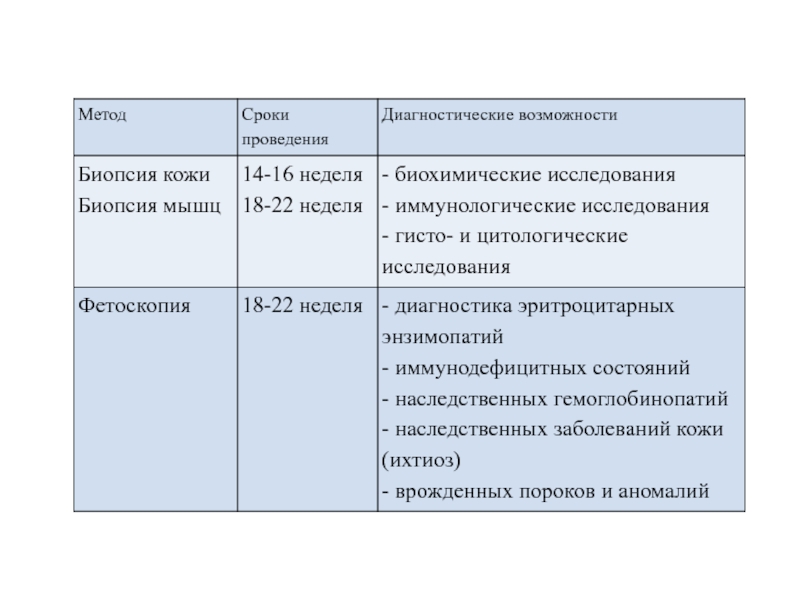
Инвазивные (хорионбиопсия, плацентобиопсия, амниоцентез, кордоцентез, биопсия кожи или мышц плода, фетоскопия, фетоамниография и др.) - проводятся по строгим показаниям, после проведения просеивающего УЗИ.
Слайд 27Для непосредственной оценки состояния плода наиболее эффективным и общедоступным методом
является ультразвуковое исследование (УЗИ), позволяющее оценивать анатомическое развитие плода.
При
первом УЗИ определяется точный срок беременности, размеры плода, наличие грубых пороков развития. На этом сроке можно выявить анэнцефалию, отсутствие конечностей и другие грубые аномалии развития.
Считается, что почти все анатомические дефекты плода формируются уже к 18-22 неделям. Обследование на этом сроке в высшей степени ответственно. При обнаружении ВПР у плода беременная должна быть направлена в медико-генетический центр.
Данные УЗИ в 32-34 недели беременности имеют значение для тактики ведения родов, указывая положение плода и т.д.
Слайд 28Несмотря на высокую разрешающую способность УЗИ, для большинства наследственных болезней
этот метод диагностики оказывается неэффективен и используется инвазивная ПД. Инвазивная
ПД основана на получении и анализе биологического материала плода ( сроки проведения смотри ниже). Получение плодного материала проводится под контролем ультразвукового сканирования специальной иглой, закрепленной в датчике-фиксаторе, через брюшную стенку проникая в хорион, плаценту, амниотическую полость или в пупочную вену. Характер процедуры зависит от срока беременности. При хорион- или плацентобиопсии оператор аспирирует в иглу 15-20 мг ворсинок плодного места или хориона, амниотической жидкости получают не более 10 мл и крови – 1-1,5 мл.
Слайд 29Самой распространенной причиной рождения детей с ВПР или с поражением
легочной, сосудисто-сердечной и других систем является наличие у беременной внутриутробных
инфекций бактериального, а чаще вирусного происхождения. По данным ИАГ им. Д. О. Отта РАМН частота генитального хламидиоза у беременных женщин составляет 25%. Риск передачи инфекции ребенку равен 40-70%. Примерно 6-7% новорожденных оказывается инфицированными хламидиями. Это ведет за собой поражение легких (воспаление легких), сердца (воспаление сердечной мышцы, так называемый миокардит), головного и спинного мозга (менингоэнцефалит) и т.д. Очень серьезным осложнением менингоэнцефалита может быть детский церебральный паралич и/или эпилептическая болезнь. Хотя и редко, но влекут за собой рождение ребенка с серьезными поражениями нервной системы цитомегаловирусная и токсоплазменная инфекции. Поэтому женщина, предполагающая стать матерью, непременно должна обследоваться на наличие генитальных инфекций и при их обнаружении проходить соответствующее лечение.
Слайд 30Большую угрозу для здоровья будущего ребенка представляет краснуха. Если женщина
перенесла это вирусное заболевание в первом триместре беременности, то риск
рождения у нее ребенка с поражением слуха (глухотой), зрения (катарактой) и сердца (врожденным пороком) – так называемой триадой Грэгга – составляет 50%. Этот риск хотя и уменьшается, но остается достаточно высоким в случае заболевания женщины на более поздних сроках беременности (25% – во втором и 7-10% – в третьем триместре беременности). Практически всегда при этом наблюдается поражение головного мозга и отставание психического развития ребенка.
Известно, что все люди делятся на две группы в отношении резус-принадлежности. Будущие родители должны знать свою группу крови по Rh и АВ0 системам. Женщина с Rh(-) непременно должна обсудить с врачом-генетиком проблемы профилактики рождения ребенка с ВПР.
Слайд 31В настоящее время во всем мире и у нас в
стране проводится ПД хромосомных и некоторых моногенных заболеваний, причем только
в тех семьях, в которых риск рождения больных детей заведомо повышен. Чаще всего, это те семьи, в которых уже имеется ребенок с тяжелым наследственным заболеванием. В этом случае целью ПД является предотвращение повторного рождения больного ребенка.
Пренатальная диагностика хромосомных болезней
ПД хромосомных болезней может проводиться на любом сроке беременности по анализу кариотипа плода. С возрастом беременной резко увеличивается риск рождения ребенка с хромосомной патологией. Повышен этот риск и у юных физиологически незрелых беременных. Если у женщин в возрасте до 30 лет вероятность рождения ребенка с хромосомной болезнью составляет, в среднем, 1 на 1000, то среди 40-летних женщин этот риск возрастает почти в 8 раз. Поэтому возраст беременной женщины является показанием для проведения ПД хромосомных болезней у плода.
Слайд 32В развитых странах такая диагностика проводится всем женщинам старше 35-38
лет. Иногда причина рождения ребенка с хромосомной болезнью связана с
присутствием сбалансированной хромосомной перестройки (транслокации) у одного из родителей больного. В этом случае при каждой беременности сохраняется высокий риск рождения больного ребенка, достигающий 10%, если сбалансированная транслокация присутствует у матери, и около 3% - при наличии хромосомной перестройки у отца. В подобных семьях обязательно рекомендуется проводить ПД хромосомных болезней плода и, в первую очередь, синдрома Дауна.
Мы уже упоминали, что частота синдрома Дауна составляет 1 на 700 новорожденных. При нормальном кариотипе родителей повторный риск иметь ребенка с синдромом Дауна у женщин, находящихся в возрасте от 20 до 30 лет невелик и, обычно, не превышает 1%, к 35 годам он увеличивается в два раза, а затем и в большее количество раз.
Слайд 33Несмотря на это, наибольшее количество больных с синдромом Дауна рождается
у женщин, находящихся в оптимальном детородном возрасте. Поэтому усилия многих
специалистов были направлены на разработку простых и безопасных диагностических тестов, позволяющих отбирать для проведения ПД те семьи, в которых риск рождения детей с хромосомной патологией повышен. И такие тесты были найдены, хотя все они не доказывают наличие хромосомной патологии у плода, а лишь могут служить показаниями для проведения инвазивной ПД. Оказалось, что плоды с синдромом Дауна характеризуются некоторыми морфологическими особенностями (такими как отсутствие назальной косточки и утолщение воротникового пространства), которые могут быть выявлены при проведении УЗИ на сроке 10-13 недель беременности. Кроме того, при подобной патологии плода в крови беременной женщины могут наблюдаться количественные изменения некоторых белков. Добавим только, что в первом триместре информативным является ассоциированный с беременностью белок-А, а на сроке 15-18 недель упоминавшийся выше АФП и хорионический гонадотропин человека (ХГЧ).

Слайд 34Таким образом, при проведении массовых УЗИ и биохимических скринингов беременных
женщин можно выявить до 90% плодов с болезнью Дауна. При
риске хромосомной патологии 0,5% и выше рекомендуется применение инвазивной ПД с целью кариотипирования плода. Таким образом, показаниями для проведения инвазивной ПД хромосомных болезней являются следующие:
возраст беременной 35 лет и старше;
2) наличие при предыдущей беременности ребенка (или плода) с хромосомной болезнью;
3) наличие у кого-либо из супругов или их родственников сбалансированных хромосомных перестроек;
4) наличие в предыдущей беременности ребенка (или плода) с множественными ВПР, у таких плодов более чем в 13% случаев встречаются хромосомные аномалии;
5) наличие ультразвуковых маркеров хромосомных болезней у плода;
6) риск у плода хромосомной патологии, в первую очередь болезни Дауна 0,5% и выше по результатам исследования маркерных сывороточных белков в крови матери;
7) применение женщиной или ее супругом фармакологических препаратов цитостатического действия или курсов рентгенотерапии незадолго до наступления беременности.

Слайд 35Характеристика инвазивных методов
Слайд 37Пренатальная диагностика моногенных болезней
Многие моногенные заболевания относятся к классу
тяжелых неизлечимых болезней, и потому предотвращение рождения больных детей с
использованием ПД является единственным методом их профилактики.
Основным универсальным методом ПД моногенных заболеваний является молекулярно-генетическое тестирование или ДНК-диагностика мутаций у плода. Подобный анализ лучше всего проводить до наступления беременности с тем, чтобы оптимизировать конкретную тактику инвазивной ПД. После этого семья может планировать свою беременность. Заметим, что при некоторых наследственных заболеваниях, таких, в первую очередь, как муковисцидоз и фенилкетонурия, в качестве материала для молекулярной идентификации мутаций у больного и его родителей могут быть использованы высушенные на фильтровальной бумаге пятна крови. В настоящее время у нас в стране проводится ПД более 60 наследственных заболеваний.
Слайд 38Для проведения детального повторного УЗИ как уточняющей диагностической процедуры можно
выделить следующие показания:
1. Выявление отклонений (маркеров патологии) или пороков развития
плода в ходе просеивающего УЗИ:
- ЦНС - анэнцефалия, spina bifida, голопрозэнцефалия, энцефалоцеле;
- Конечности - редукционные пороки (амниоперетяжки), фоко- и брахимелия, олиго- и полидактилия, тяжелый несовершенный остеогенез;
- ССС - пороки сердца и крупных сосудов;
- МВС - агенезия почек, поликистоз почек, удвоение почки, выраженный гидронефроз, опухоли яичников;
- ЖКТ - атрезия 12-перстной кишки, дефекты передней брюшной стенки, -диафрагмальная грыжа;
Легкие - кистозно-аденоматозная мальформация легких;
Слайд 392. Несоответствие размеров плода сроку беременности.
3. Рождение предыдущего ребенка с
врожденными пороками развития.
4. Наличие у женщины болезней (сахарный диабет, алкоголизм,
эпилепсия и др.), повышающих риск рождения ребенка с врожденными пороками.
5. Воздействие тератогенного фактора (радиация, химические вещества, инфекции) в первые 10 недель беременности.
6. Наличие врожденных пороков развития у кого-нибудь из супругов (или родственников I-III степени родства по линиям обоих супругов).