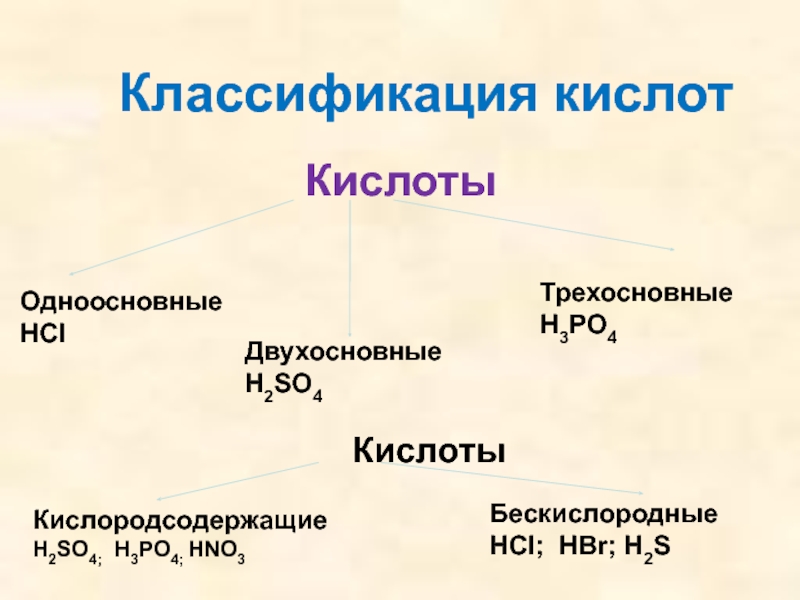
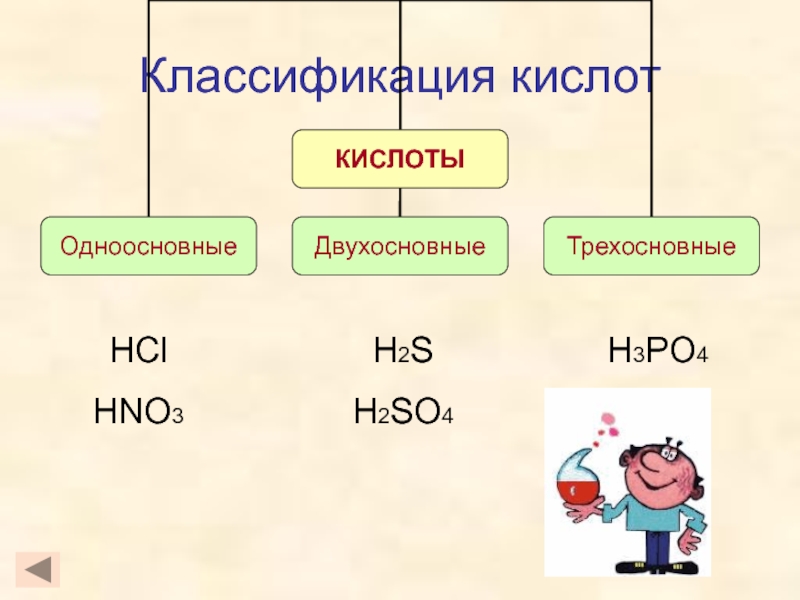
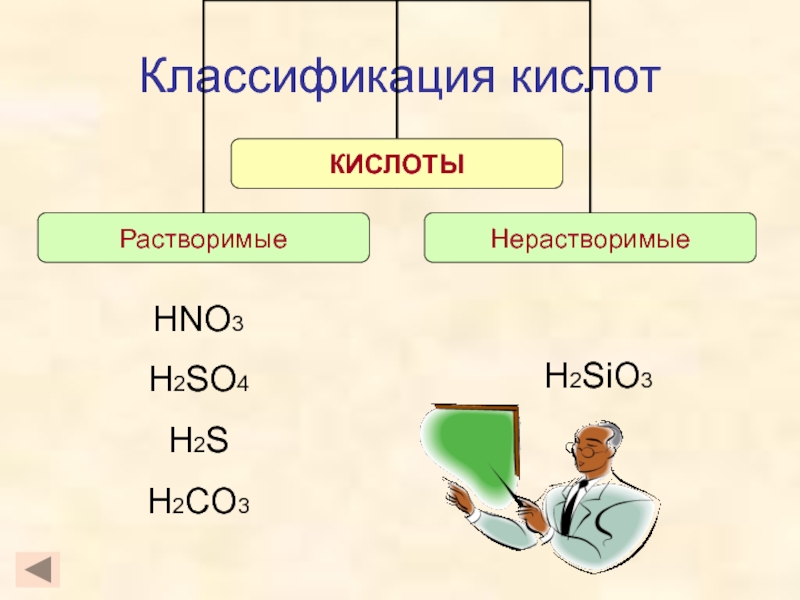
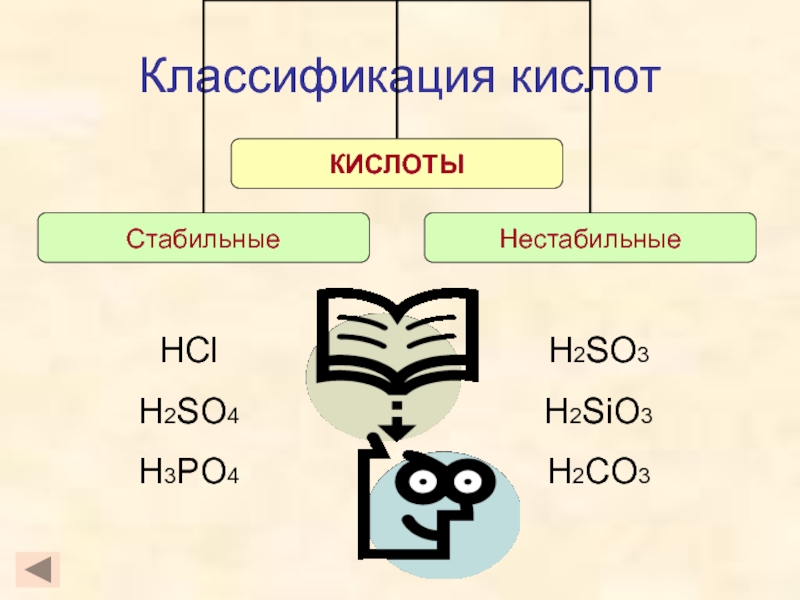
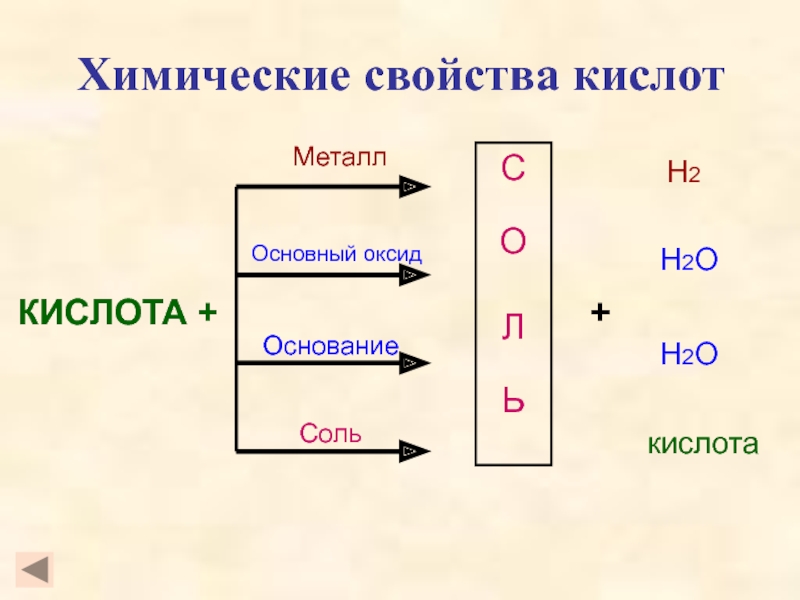
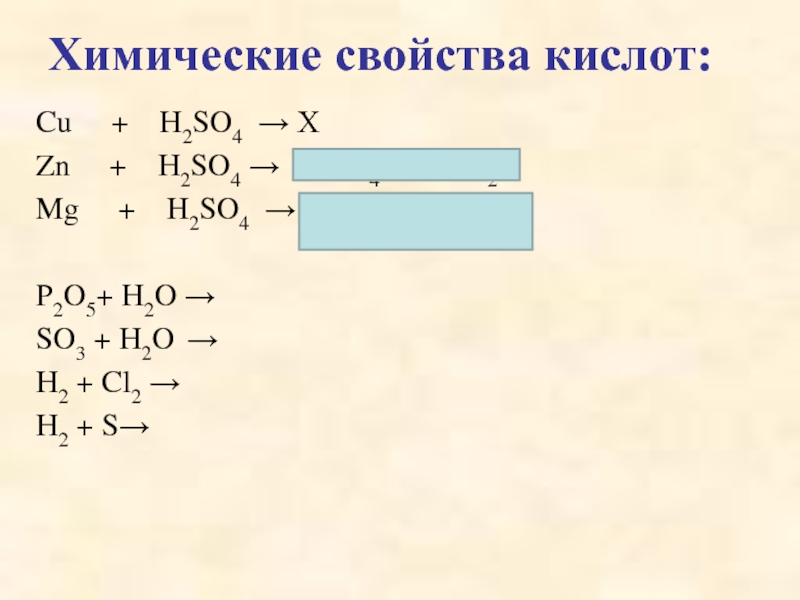
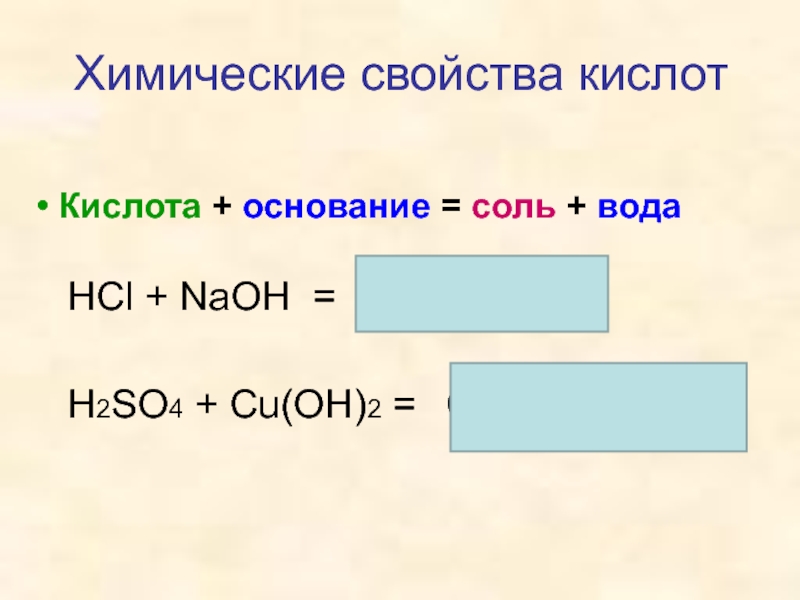
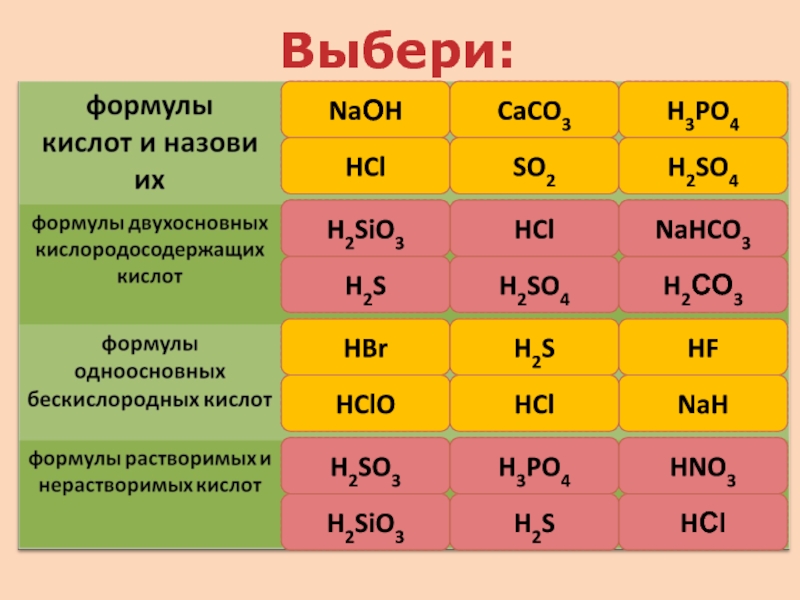
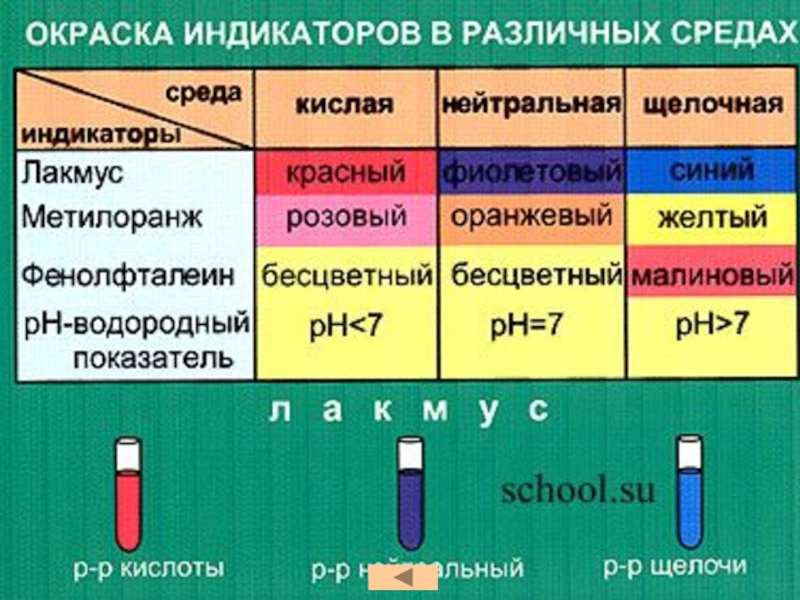
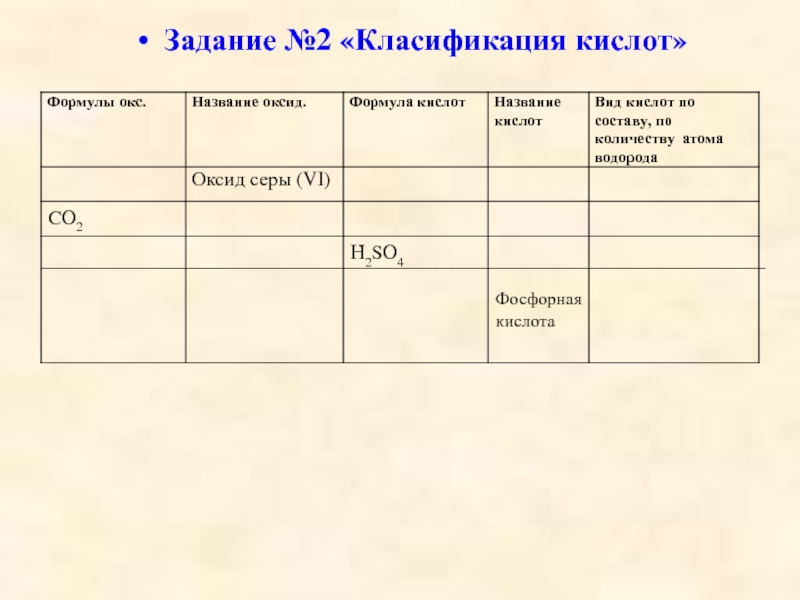
кислот, раскрыть основные физические и химические свойства кислот;
Развивающая: продолжить
развитие у учащихся умение анализировать, выделять главное и используя яркие примеры познавательный интерес к предмету;Воспитательная: продолжить воспитание трудолюбия, уважения к сверстникам, учителям.