Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции ионного обмена 9 класс
Содержание
- 1. Реакции ионного обмена 9 класс
- 2. Получение гидроксида меди (II)I группа:CuCl2 +
- 3. ТЕМА УРОКА: «РЕАКЦИИ ИОННОГО ОБМЕНА»
- 4. ВЗАИМОДЕЙСТВИЕ РАСТВОРА ХЛОРИДА ЖЕЛЕЗА (III) С ГИДРОКСИДОМ НАТРИЯ
- 5. 1) ЗАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИИ В МОЛЕКУЛЯРНОЙ ФОРМЕFeCI3
- 6. Слайд 6
- 7. ГРУППА №2«ПОПАДИ В ЦЕЛЬ» С КАКИМИ ИОНАМИ БУДЕТ
- 8. ГРУППА №3«ХИМИЧЕСКИЙ АКВАРИУМ» ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ?
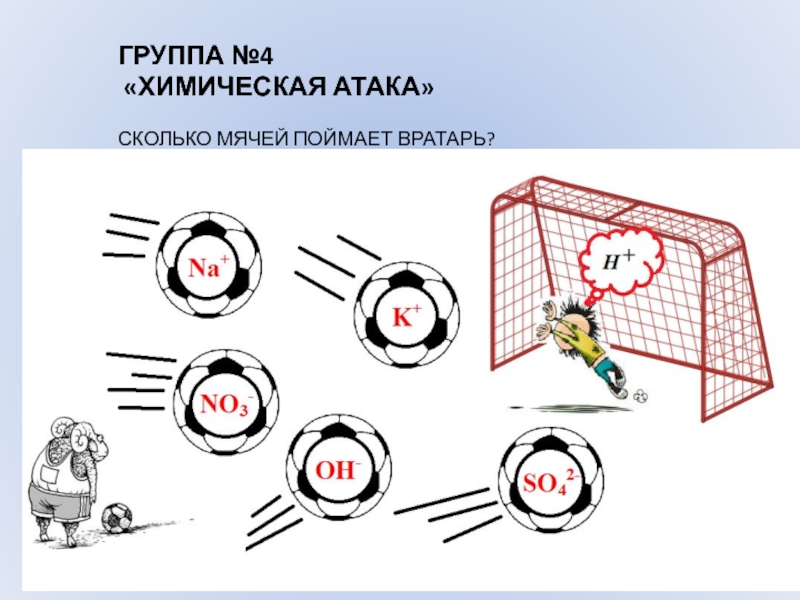
- 9. ГРУППА №4 «ХИМИЧЕСКАЯ АТАКА» СКОЛЬКО МЯЧЕЙ ПОЙМАЕТ ВРАТАРЬ?
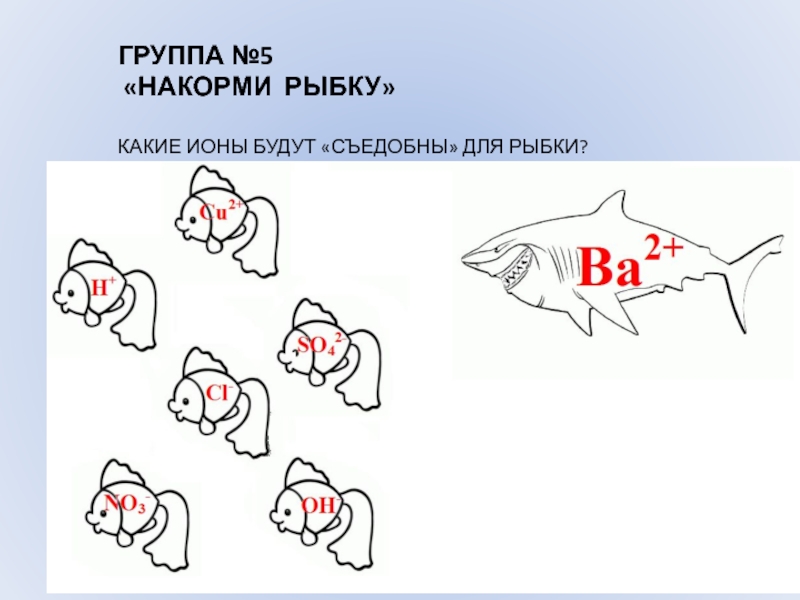
- 10. ГРУППА №5 «НАКОРМИ РЫБКУ» КАКИЕ ИОНЫ БУДУТ «СЪЕДОБНЫ» ДЛЯ РЫБКИ?
- 11. ПРИЗНАКИ НЕОБРАТИМОСТИ РЕАКЦИЙ ИОННОГО ОБМЕНАОБРАЗОВАНИЕ ОСАДКАCu 2++
- 12. Получение гидроксида меди (II)I группа:CuCl2 +
- 13. Краткое ионное уравнение получения гидроксида меди (II)
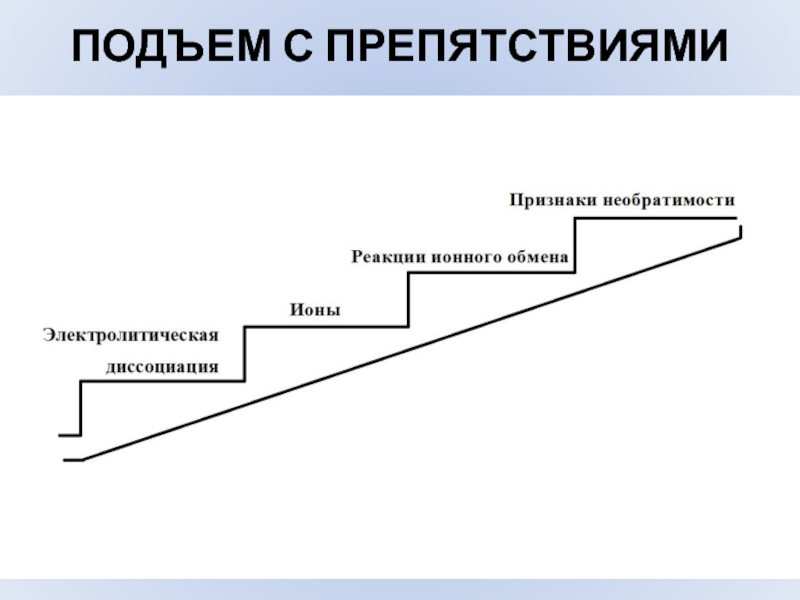
- 14. ПОДЪЕМ С ПРЕПЯТСТВИЯМИ
- 15. Самостоятельная работа
- 16. Домашнее заданиеЗадачник по химии 9 класс
- 17. Используемые ссылки ресурсов интернет 1.
- 18. Скачать презентанцию
Получение гидроксида меди (II)I группа:CuCl2 + 2KOH = Cu(OH)2 + 2KCl2 группа:CuBr2 + Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа:Cu(NO3)2 +
Слайды и текст этой презентации
Слайд 1МБОУ «ИВАНЧИКОВСКАЯ СОШ» ЛЬГОВСКОГО РАЙОНА КУРСКОЙ ОБЛАСТИ конспект урока химии «Реакции ионного обмена» (
2-я образовательная ступень)
9 класс
Составила учитель химии
Митина Валентина Тихоновна.
2015-2016 учебный год
Слайд 2Получение гидроксида меди (II)
I группа:
CuCl2 + 2KOH =
Cu(OH)2 + 2KCl
2 группа:
CuBr2 + Ba(OH)2
= Cu(OH)2 + BaBr2 3 группа:
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
4 группа:
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
5 группа:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Слайд 51) ЗАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИИ В МОЛЕКУЛЯРНОЙ ФОРМЕ
FeCI3 + 3NaOH =
Fe(OH)3 + 3 NaCI
2) СОСТАВИТЬ ПОЛНОЕ ИОННОЕ УРАВНЕНИЕ
Диссоциированные
вещества записываются в виде ионов, а уходящие из среды реакции либо малодиссоциированные – в молекулярной форме
Fe3+ + 3 CI- + 3Na+ + 3OH- = Fe(OH)3 + 3Na+ + 3CI-3) ОПРЕДЕЛИТЬ ИОНЫ, НЕ ПРИНИМАЮЩИЕ УЧАСТИЕ В РЕАКЦИИ, ВЫЧЕРКНУТЬ ИХ Fe3+ + 3 CI- + 3Na+ + OH- = Fe(OH)3 + 3Na+ + 3CI-
4) СОСТАВИТЬ СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ, ВЫРАЖАЮЩЕГО СУЩНОСТЬ РЕАКЦИИ Fe3+ + 3OH- = Fe(OH)3
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННЫХ УРАВНЕНИЙ
Слайд 6
Cl-
F-
NO3-Na+ K+
Ag+ Li+
1.
ГРУППА №1
«ХИМИЧЕСКИЙ ДОЖДЬ»
МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ ВЗАИМОДЕЙСТВИЕ?
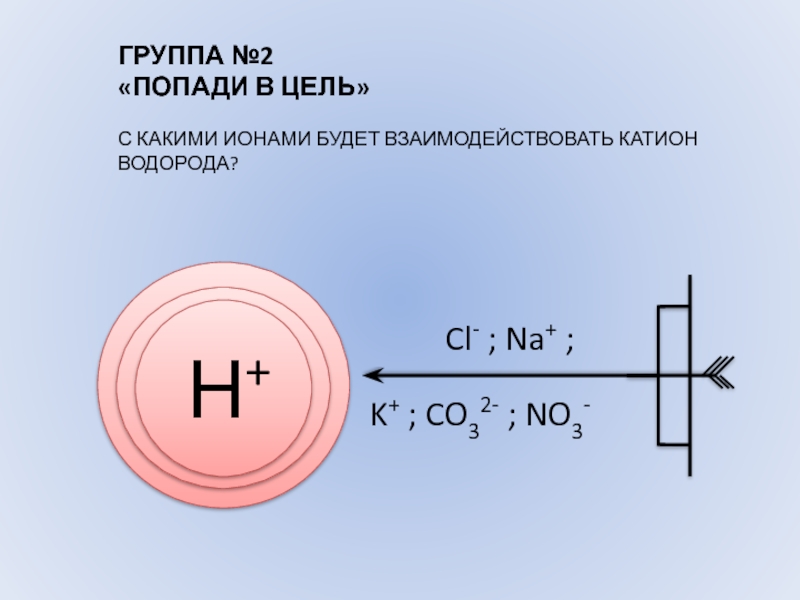
Слайд 7ГРУППА №2
«ПОПАДИ В ЦЕЛЬ»
С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН ВОДОРОДА?
Н+
Cl-
; Na+ ;
K+ ; CO32- ; NO3-
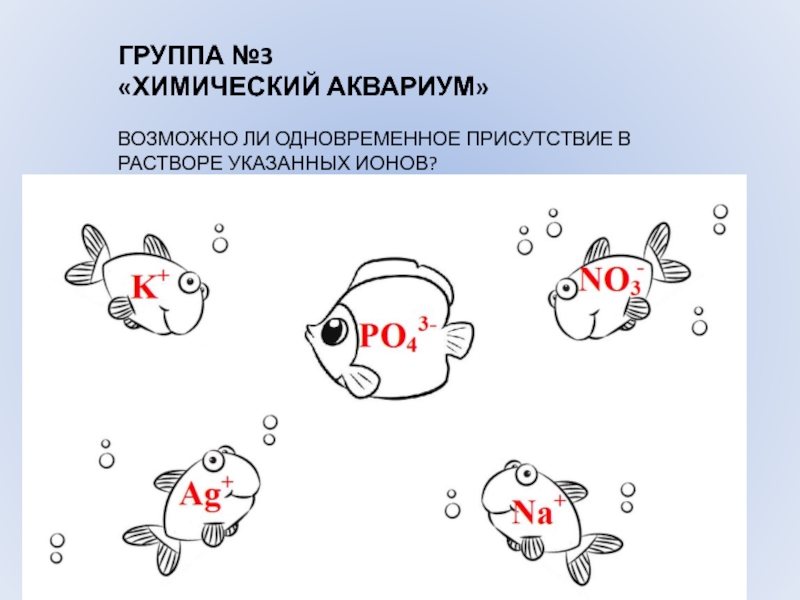
Слайд 8ГРУППА №3
«ХИМИЧЕСКИЙ АКВАРИУМ»
ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ?
Слайд 11ПРИЗНАКИ НЕОБРАТИМОСТИ РЕАКЦИЙ ИОННОГО ОБМЕНА
ОБРАЗОВАНИЕ ОСАДКА
Cu 2++ 2OH- =
Cu(OH)2
ОБРАЗОВАНИЕ ГАЗООБРАЗНОГО ВЕЩЕСТВА
CO32- +
2H+ = CO2 + H2OОБРАЗОВАНИЕ МАЛОДИССОЦИИРОВАННОГО ВЕЩЕСТВА
H+ + OH- = H2O
Слайд 12Получение гидроксида меди (II)
I группа:
CuCl2 + 2KOH =
Cu(OH)2 + 2KCl
2 группа:
CuBr2 + Ba(OH)2
= Cu(OH)2 + BaBr2 3 группа:
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
4 группа:
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
5 группа:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4