Слайд 1СПИРТЫ:
строение,
свойства
классификация, изомерия,
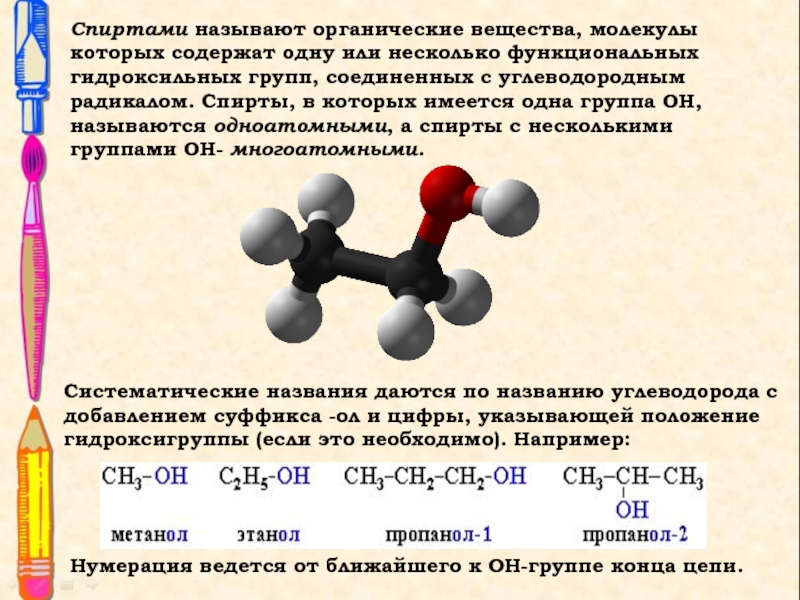
Слайд 2Спиртами называют органические вещества, молекулы которых содержат одну или несколько
функциональных гидроксильных групп, соединенных с углеводородным радикалом. Спирты, в которых
имеется одна группа ОН, называются одноатомными, а спирты с несколькими группами ОН- многоатомными.
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Слайд 3Классификация спиртов по числу гидроксильных групп
Слайд 4Классификация спиртов по характеру углеводородного радикала
Слайд 5Классификация спиртов по характеру атома углерода с которым связана гидроксильная
группа.
Слайд 6Физические свойства и строение спиртов
Молекулы спиртов, подобно молекуле воды, имеют
угловое строение. Угол R−O−H в молекуле метанола равен 108,5°. Атом
кислорода гидроксильной группы находится в состоянии sp³-гибридизации. Спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу. Высокие температуры кипения спиртов объясняются наличием межмолекулярных водородных связей. Энергия водородной связи значительно ниже, чем энергия ковалентной химической связи. Так, например, для метанола энергия водородной связи составляет 16,7 кДж/моль , тогда как связи C–H, C–O и O–H имеют энергию 391,7, 383,5 и 428,8 кДж/моль соответственно. Тем не менее, влияние водородных связей на физические свойства спиртов весьма значительное. Молекулы спирта, имея две полярных связи C−O и O−H, обладают дипольным моментом (~5,3—6,0·10−30 Кл·м). Электростатические заряды в молекуле метанола составляют: на атоме углерода 0,297 e; на атоме гидроксильного водорода 0,431 e; на атоме кислорода −0,728 e. Вместе с тем, энергия ионизации спиртов ниже, чем у воды (10,88 эВ для метанола против 12,61 эВ для воды), что объясняется электронодонорным эффектом алкильной группы.
Следует отметить, что влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов.

Слайд 7Химические свойства спиртов
Химические свойства спиртов определяются наличием в них гидроксильной
группы. Поскольку гидроксильная группа является полярной, она может гетеролитически диссоциировать,
особенно, под действием сильных оснований. Таким образом, спирты проявляют свойства слабых кислот. Кроме того, высокая электроотрицательность кислорода обуславливает наличие электрофильного атома углерода и, соответственно, способность спиртов подвергаться реакциям нуклеофильного замещения под действием ряда нуклеофилов. Наконец, атом кислорода гидроксильной группы имеет нуклеофильный характер, поэтому спирты могут выступать нуклеофилами в реакциях замещения и присоединения. Также для спиртов характерны реакции окисления.
Диссоциация и кислотно-основные свойства спиртов
Кислотные свойства спиртов
Спирты способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты диссоциируют по связи O–H с образованием алкоксид-иона. Кислотные характеристики спиртов оценивают по константе кислотности Ka.
В водном растворе кислотность спиртов снижается с увеличением молекулярной массы и разветвлённости углеводородной цепи. Это связывают с увеличением положительного индуктивного эффекта алкильных заместителей в данном ряду и уменьшением устойчивости образующегося алкоксид-иона за счёт локализации отрицательного заряда на атоме кислорода.

Слайд 8Осно́вные свойства спиртов
Спирты могут также вести себя как слабые основания
Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также
давая донорно-акцепторные комплексы с кислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
Нуклеофильное замещение;
Дегидратация;
Окисление;
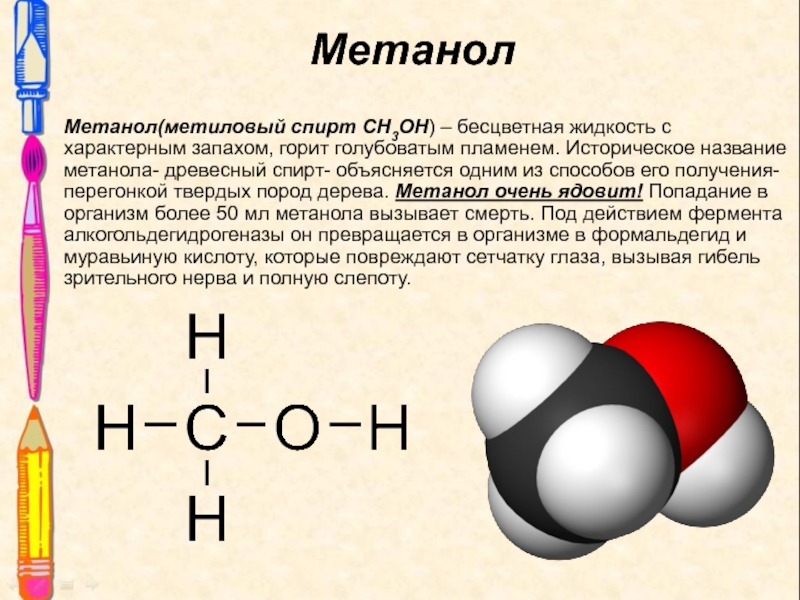
Слайд 9Метанол
Метанол(метиловый спирт СН3ОН) – бесцветная жидкость с характерным запахом, горит
голубоватым пламенем. Историческое название метанола- древесный спирт- объясняется одним из
способов его получения- перегонкой твердых пород дерева. Метанол очень ядовит! Попадание в организм более 50 мл метанола вызывает смерть. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывая гибель зрительного нерва и полную слепоту.
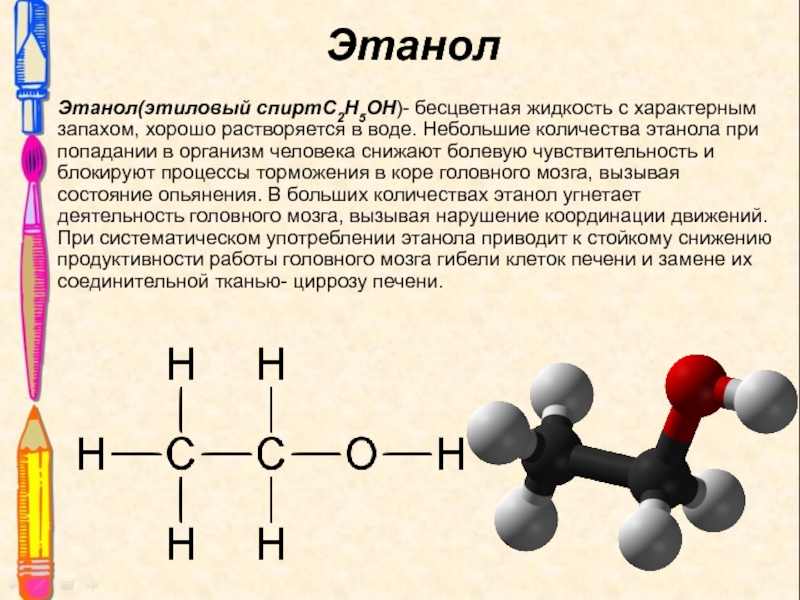
Слайд 10Этанол(этиловый спиртС2Н5ОН)- бесцветная жидкость с характерным запахом, хорошо растворяется в
воде. Небольшие количества этанола при попадании в организм человека снижают
болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. В больших количествах этанол угнетает деятельность головного мозга, вызывая нарушение координации движений. При систематическом употреблении этанола приводит к стойкому снижению продуктивности работы головного мозга гибели клеток печени и замене их соединительной тканью- циррозу печени.
Этанол
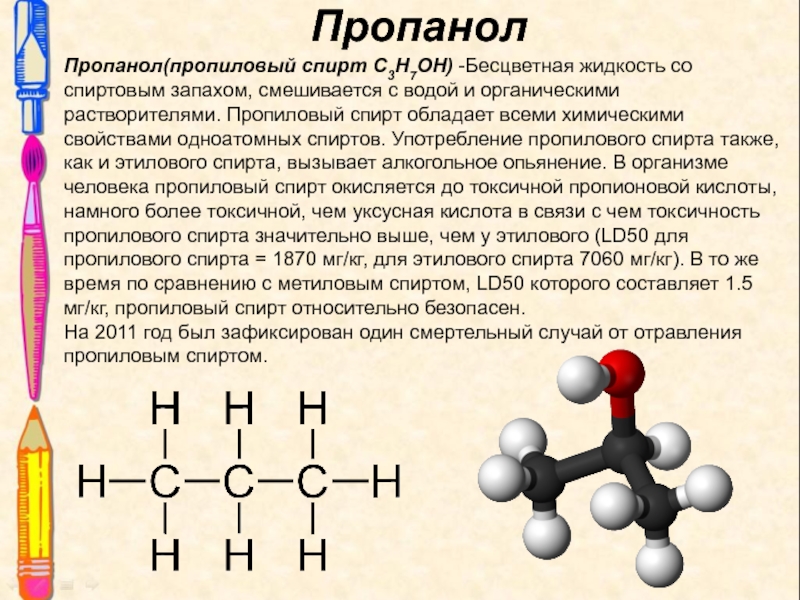
Слайд 11Пропанол
Пропанол(пропиловый спирт C3H7OH) -Бесцветная жидкость со спиртовым запахом, смешивается с
водой и органическими растворителями. Пропиловый спирт обладает всеми химическими свойствами
одноатомных спиртов. Употребление пропилового спирта также, как и этилового спирта, вызывает алкогольное опьянение. В организме человека пропиловый спирт окисляется до токсичной пропионовой кислоты, намного более токсичной, чем уксусная кислота в связи с чем токсичность пропилового спирта значительно выше, чем у этилового (LD50 для пропилового спирта = 1870 мг/кг, для этилового спирта 7060 мг/кг). В то же время по сравнению с метиловым спиртом, LD50 которого составляет 1.5 мг/кг, пропиловый спирт относительно безопасен.
На 2011 год был зафиксирован один смертельный случай от отравления пропиловым спиртом.
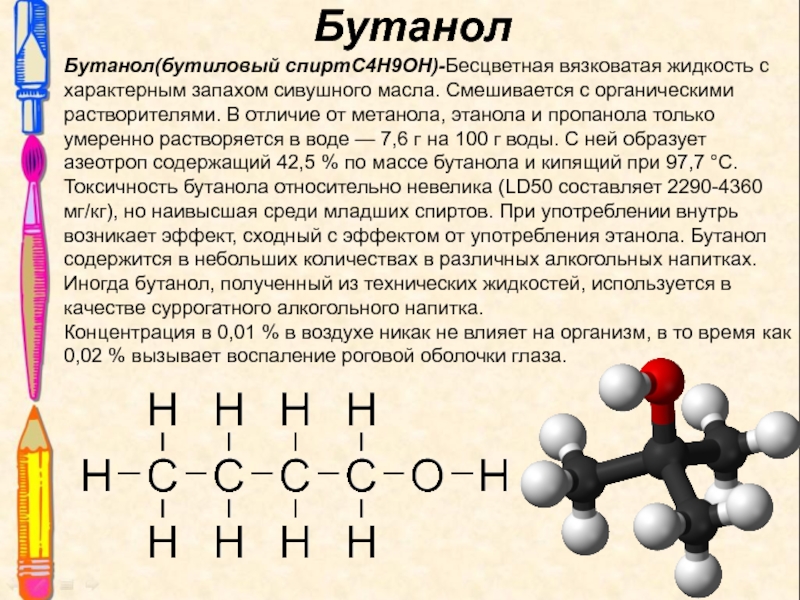
Слайд 12Бутанол
Бутанол(бутиловый спиртC4H9OH)-Бесцветная вязковатая жидкость с характерным запахом сивушного масла. Смешивается
с органическими растворителями. В отличие от метанола, этанола и пропанола
только умеренно растворяется в воде — 7,6 г на 100 г воды. С ней образует азеотроп содержащий 42,5 % по массе бутанола и кипящий при 97,7 °C.Токсичность бутанола относительно невелика (LD50 составляет 2290-4360 мг/кг), но наивысшая среди младших спиртов. При употреблении внутрь возникает эффект, сходный с эффектом от употребления этанола. Бутанол содержится в небольших количествах в различных алкогольных напитках. Иногда бутанол, полученный из технических жидкостей, используется в качестве суррогатного алкогольного напитка.
Концентрация в 0,01 % в воздухе никак не влияет на организм, в то время как 0,02 % вызывает воспаление роговой оболочки глаза.
Слайд 13ГОМОЛОГИЧЕСКИЙ РЯД ПРЕДЕЛЬНЫХ ОДНОАТОМНЫХ СПИРТОВ
Слайд 14Изомерия
Структурная (изомерия углеродного скелета);
Изомерия положения функциональной группы;
Межклассовая изомерия
Характерны три
вида изомерии:
Слайд 16Пивной алкоголизм
Пиво по-разному влияет на мужской и женский организмы:
Выделяется метилтестостерона,
Расширяется
таз,
Разрастаются грудные железы,
У женщин возрастает вероятность заболевания раком грудной железы.
Слайд 17Изменение клеток мозга
Алкоголь действует на нейроны, вызывая эйфорию, является наркотиком.
Мозг сопротивляется действию депрессантов, изменяя клеточную оболочку.
После того как
мозг освободился от алкоголя, приспособившееся клетки некоторое время не могут нормально функционировать. Вот почему наутро после выпивки свет кажется невыносимо ярким, а звук громким.
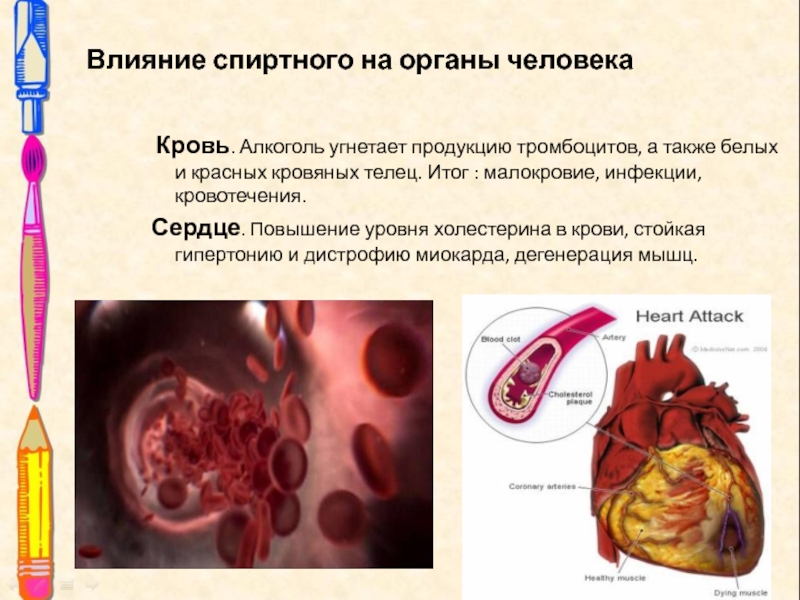
Слайд 18Влияние спиртного на органы человека
Кровь. Алкоголь угнетает продукцию тромбоцитов,
а также белых и красных кровяных телец. Итог : малокровие,
инфекции, кровотечения.
Сердце. Повышение уровня холестерина в крови, стойкая гипертонию и дистрофию миокарда, дегенерация мышц.
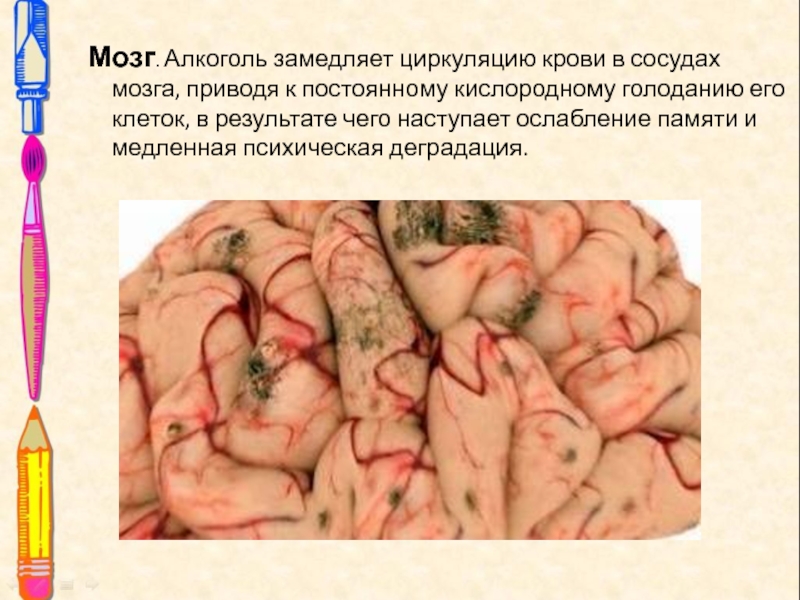
Слайд 19Мозг. Алкоголь замедляет циркуляцию крови в сосудах мозга, приводя к
постоянному кислородному голоданию его клеток, в результате чего наступает ослабление
памяти и медленная психическая деградация.
Слайд 20Кишечник. Постоянное воздействие алкоголя на стенку тонкого кишечника приводит к
изменению структуры клеток, и они теряют способность полноценно всасывать питательные
вещества и минеральные компоненты, что заканчивается истощением организма алкоголика.
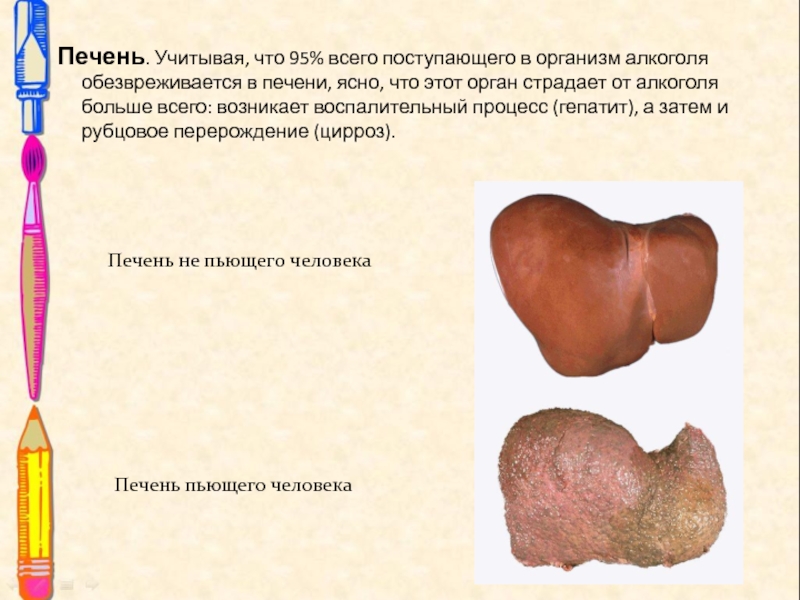
Слайд 21Печень. Учитывая, что 95% всего поступающего в организм алкоголя обезвреживается
в печени, ясно, что этот орган страдает от алкоголя больше
всего: возникает воспалительный процесс (гепатит), а затем и рубцовое перерождение (цирроз).
Печень не пьющего человека
Печень пьющего человека
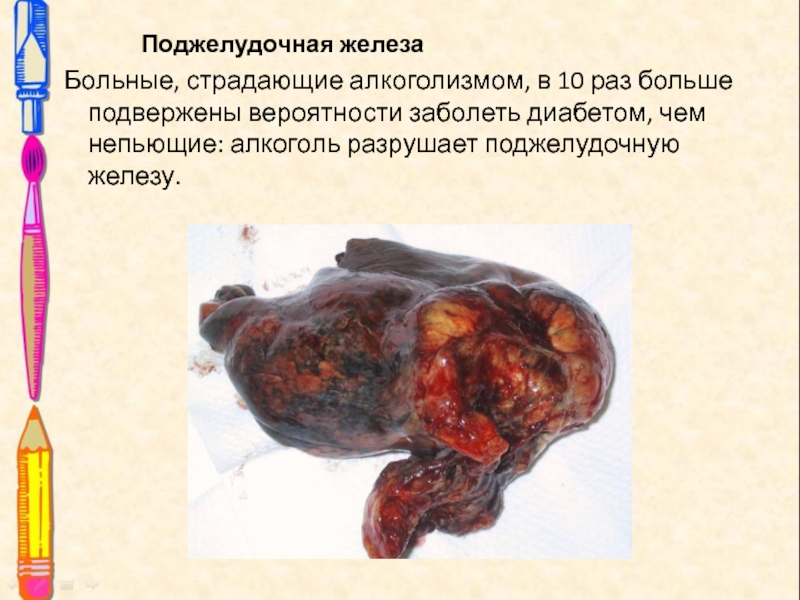
Слайд 22 Поджелудочная железа
Больные, страдающие
алкоголизмом, в 10 раз больше подвержены вероятности заболеть диабетом, чем
непьющие: алкоголь разрушает поджелудочную железу.
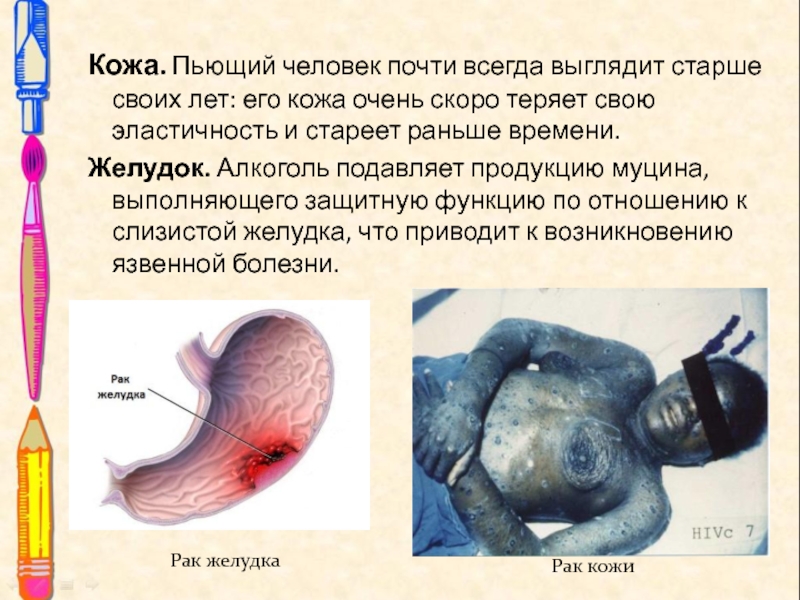
Слайд 23Кожа. Пьющий человек почти всегда выглядит старше своих лет: его
кожа очень скоро теряет свою эластичность и стареет раньше времени.
Желудок. Алкоголь подавляет продукцию муцина, выполняющего защитную функцию по отношению к слизистой желудка, что приводит к возникновению язвенной болезни.
Рак желудка
Рак кожи
Слайд 24Работу выполнила
Ученица 11 класса
Прощенко Дарья