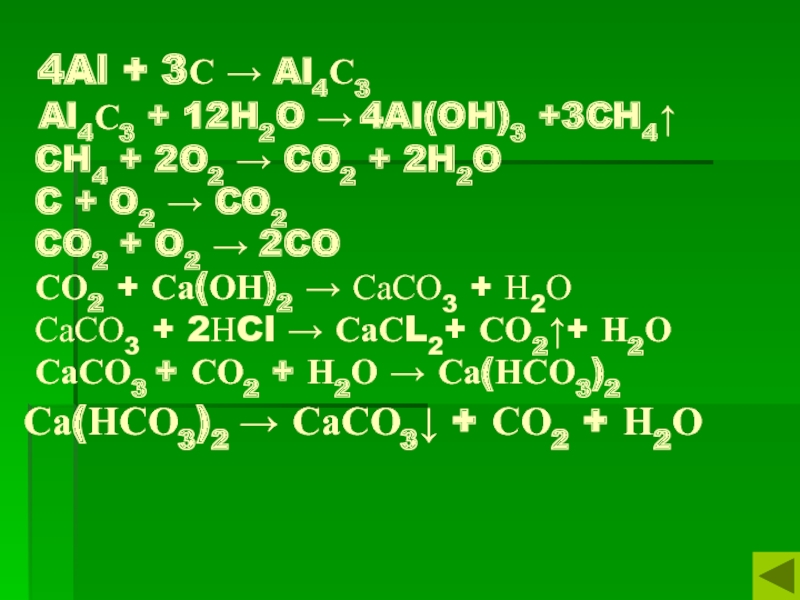Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод и его соединения
Содержание
- 1. Углерод и его соединения
- 2. Необходимо вспомнить.Положение химического элемента в таблице Д.И.Менделеева.Электронная
- 3. Нам известно, чтоУглерод – химический элемент с
- 4. Составить конспект-ответ, придерживаясь следующих вопросов.Какова форма существования
- 5. Соединения углерода.
- 6. Генетическая взаимосвязь соединений углерода.
- 7. 4Al + 3С → Al4С3
- 8. 1.Качественная реакция на СО32- = получение СО2
- 9. Переход карбонаты в гидрокарбонаты и обратно. СаСО3
- 10. Домашнее задание.Урок 1: §29, ?1,2,6,8.Урок 2: §30, ?1,3,6,7.
- 11. Скачать презентанцию
Необходимо вспомнить.Положение химического элемента в таблице Д.И.Менделеева.Электронная формула атома углерода.Какие высшую и низшую степени окисления проявляет углерод в соединениях?Составьте формулы высшего оксида, соответствующего гидроксида, водородного соединения углерода. Расставьте в них степень
Слайды и текст этой презентации
Слайд 2Необходимо вспомнить.
Положение химического элемента в таблице Д.И.Менделеева.
Электронная формула атома углерода.
Какие
высшую и низшую степени окисления проявляет углерод в соединениях?
Составьте формулы
высшего оксида, соответствующего гидроксида, водородного соединения углерода. Расставьте в них степень окисления и определите заряды ионов в кислоте.Что такое аллотропия? С какими аллотропными модификациями мы встречались в курсе химии?
Слайд 3Нам известно, что
Углерод – химический элемент с порядковым номером 6,
расположен во 2 периоде, ΙVгруппе главной подгруппы.
Электронная формула атома –
1s22s22p2.Высшая степень окисления - +4, низшая - -4.
+4 -2 + +4 -2 -4 +
СO2 , H2 + С O3 2-,, С H4 .
Аллотропия – существование химического элемента в виде нескольких простых веществ. Кислород (О2) и озон (О3) являются аллотропными модификациями химического элемента кислорода, х.э. сера образует кристаллическую и пластическую серу, фосфор – белый и красный фосфор.
Слайд 4Составить конспект-ответ,
придерживаясь следующих вопросов.
Какова форма существования химического элемента углерода?
Какого строение
атома углерода?
Какие аллотропные модификации образует углерод? Каковы их строение и
свойства?(ответ оформите в виде таблицы).Какие химические свойства характерны для углерода?
Какие физические и химические свойства проявляют соединения углерода:
а) оксид углерода(II) и (V),
б) угольная кислота,
в)как их получают, (ответ оформите в виде таблицы).
г)качественная реакция н а углекислый газ и карбонат-анион – СO32-?
Каковы условия перехода карбонаты в гидрокарбонаты?
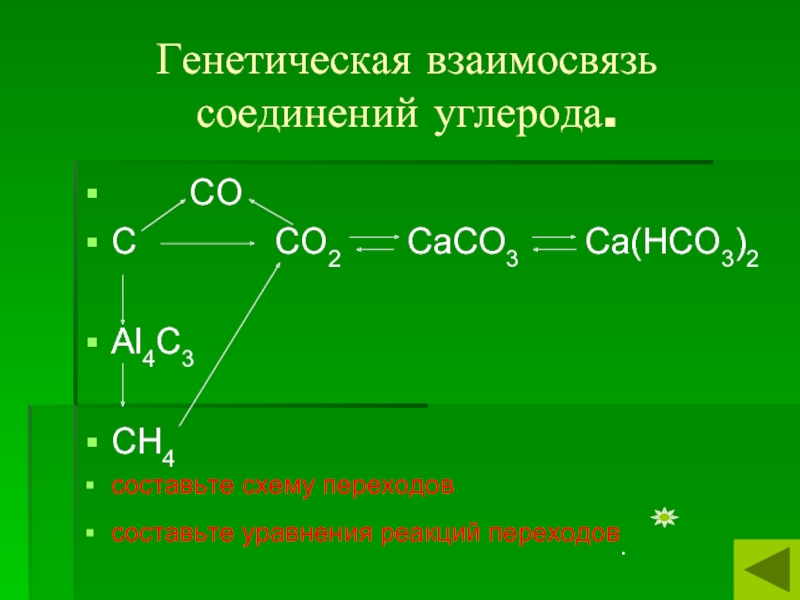
Слайд 6Генетическая взаимосвязь соединений углерода.
СО
С
СО2 СаСО3
Са(НСО3)2Аl4С3
СН4
составьте схему переходов
составьте уравнения реакций переходов.
Слайд 7 4Al + 3С → Al4С3 Al4С3 + 12H2O →
4Al(OH)3 +3CH4↑ CH4 + 2O2 → CO2 + 2H2O C
+ O2 → CO2 CO2 + O2 → 2CO СО2 + Са(ОН)2 → СаСО3 + Н2О СаСО3 + 2НCl → СаСL2+ СО2↑+ Н2О СаСО3 + СО2 + Н2О → Са(НСО3)2 Са(НСО3)2 → СаСО3↓ + СО2 + Н2О
Слайд 81.Качественная реакция на СО32- = получение СО2 в лаборатории. 2.Качественная
реакция на СО2.
1) СаСО3 + 2НCl → СаСL2 +
СО2↑ + Н2ОСоставьте уравнение реакции получения углекислого газа в лаборатории, она же – качественная реакция на карбонат-анион.
Как доказать, что выделяющийся газ – СО2? Составьте уравнение соответствующей реакции.
2) СО2 + Са(ОН)2 → СаСО3 + Н2О
Слайд 9Переход карбонаты в гидрокарбонаты и обратно.
СаСО3 + СО2 +
Н2О → Са(НСО3)2
t исчезновение помутненияСа(НСО3)2 → СаСО3↓ + СО2 + Н2О
Составьте уравнения реакций перехода карбонатов в гидрокарбонаты и обратно.
Теги