Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
16 Таблица Менделеева.ppt
Содержание
- 1. 16 Таблица Менделеева.ppt
- 2. Слайд 2
- 3. В 1869г. Д. И. Менделеевым был открыт
- 4. 2) Принцип Паули: В атоме может существо-вать
- 5. Совокупность электронов, обладающих одина-ковым главным квантовым числом
- 6. Принцип Паули ограничивает число электронов на той
- 7. Установим теперь, сколько электронов может находится на
- 8. При заданном n квантовое число l может
- 9. Конфигурация электронных оболочек атомов за-писывается с помощью
- 10. Итак, принцип Паули дает следующую картину построения
- 11. Например, 19-ый электрон калия должен (соглас-но идеальной
- 12. По этой же причине 20-ый электрон кальция
- 13. Таким образом, атомная физика полностью объяс-нила периодическую
- 14. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физика атома, атомного ядра и элементарных частиц
16 (0). Строение электронных
оболочек. Объяснение периодической системы Д.И.Менделеева.
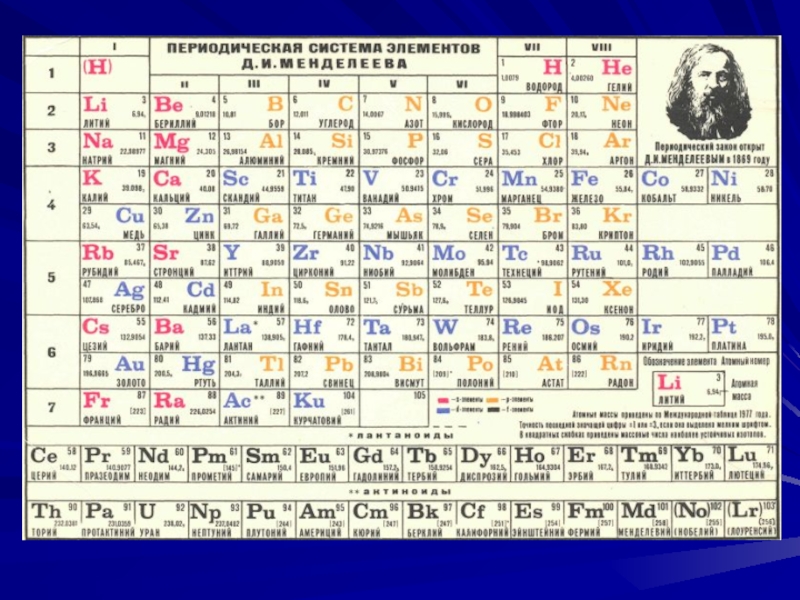
Слайд 3В 1869г. Д. И. Менделеевым был открыт периодический закон и
построена периодическая система элементов, объяснение которой – одна из важнейших
задач атомной физики.Сформулируем прежде всего те принципы, на которых основано это объяснение:
1). Состояние электрона в атоме полностью определяется четырьмя квантовыми числами:
главным квантовым числом n = 1, 2, 3, …;
орбитальным квантовым числом l = 0, 1, …, n-1;
магнитным квантовым числом m = 0, ±1, ±2, …, ±l;
магнитным спиновым
квантовым числом ms = +1/2, -1/2.
Слайд 42) Принцип Паули: В атоме может существо-вать только один электрон
в состоянии, характеризуемом данными значениями четырех квантовых чисел; т.е. два
электрона в одном и том же атоме должны различаться значениями по крайней мере одного квантового числа.3) Атом (как и любая система) устойчив тогда, когда находится в состоянии с наименьшей возможной энергией.
Слайд 5Совокупность электронов, обладающих одина-ковым главным квантовым числом образует слой. Слои
имеют названия :
Совокупность электронов, имеющих одинаковые n и l, образует
оболочку. Названия оболочек :Слайд 6Принцип Паули ограничивает число электронов на той или иной электронной
оболочке. Дейст-вительно, электроны в невозбужденном атоме стремятся перейти в состояние
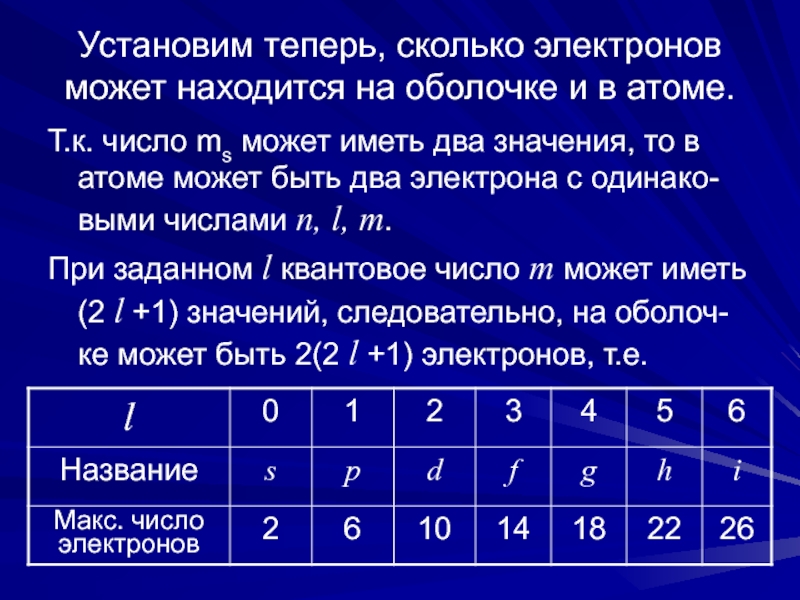
с наименьшей энергией (в устойчивое состояние), которое со-ответствует минимальным значениям главного и орбитального чисел. Однако возможность та-кого перехода ограничена принципом Паули. Поэтому электроны в невозбужденном атоме находятся в таких состояниях, при которых энергия атома является наименьшей, но распределение по состояниям удовлетворяет принципу Паули.Слайд 7Установим теперь, сколько электронов может находится на оболочке и в
атоме.
Т.к. число ms может иметь два значения, то в атоме
может быть два электрона с одинако-выми числами n, l, m.При заданном l квантовое число m может иметь (2 l +1) значений, следовательно, на оболоч-ке может быть 2(2 l +1) электронов, т.е.
Слайд 8При заданном n квантовое число l может прини-мать n значений:
0, 1, 2, …, n -1. Поэтому мак-симальное число электронов
в слое можно вы-разить суммой арифметической прогрессии:(16.1)
Слайд 9Конфигурация электронных оболочек атомов за-писывается с помощью следующих обозначе-ний. Каждая
оболочка обозначается соответст-вующим n и буквой, обозначающей l, а индек-сом
справа вверху обозначается число элект-ронов. Например:Водород 1s1
Гелий 1s2
Литий 1s22s1
Углерод 1s22s22p2
Кислород 1s22s22p4
Аргон 1s22s22p63s23p6
Слайд 10Итак, принцип Паули дает следующую картину построения электронной оболочки атомов.
Каж-дый вновь присоединяемый электрон связыва-ется в состоянии с наименьшими возможными
квантовыми числами. Эти электроны постепен-но заполняют слой с одним и тем же главным квантовым число n. Когда построение слоя за-канчивается, получается устойчивая структура (инертный газ). Следующий электрон начинает заполнение уже нового слоя и т.д. Эта идеаль-ная схема соблюдается до 18 элемента табли-цы Менделеева (до аргона).Начиная с 19-го элемента (калия) наблюдаются отступления от идеальной схемы. Причина этих отступлений заключается в том, что идеальная схема не учитывает взаимодействия электро-нов между собой.
Слайд 11Например, 19-ый электрон калия должен (соглас-но идеальной схеме) находиться в
3d-оболоч-ке. Однако химические и спектроскопические данные указывают на то, что
этот электрон на-ходится в 4s-оболочке. Детальный расчет с учетом взаимодействия электронов показыва-ет, что состояние 3d действительно отвечает большей энергии, чем 4s.Слайд 12По этой же причине 20-ый электрон кальция тоже
присоединяется в 4s-состояние,
а нормальное за-
полнение 3d-оболочки начинается у скандия.
Аналогичное нарушение нормального порядка
наблюдаетс
у рубидия, цезия, франция.Другое отступление от нормального порядка за-
полнения слоев имеет место у редких земель (Z =
58 - 71): идет заполнение 4f-оболочки после того,
как заполнены оболочки 5s, 5p и 6s.
Слайд 13Таким образом, атомная физика полностью объяс-
нила периодическую таблицу элементов. Причем
теория
не только объяснила, но и уточнила табли-
цу. До 1922г. элемент
Z=72 не был известен. Онбыл предсказан Менделеевым, и ему было остав-
лено место в группе редких земель. Однако по те-
оретическим соображениям, группа редких земель
должна содержать 14 элементов (т.к. на 4f оболоч-
ке может находиться 14 элементов), т.е. должна
заканчиваться 71-м элементом, а элемент Z=72
должен быть аналогом циркония и титана. На это
впервые указал Н. Бор, и вскоре элемент 72 (гаф-
ний) был открыт в циркониевых рудах и по своим
химическим и оптическим свойствам оказался ана-
логом титана и циркония, а не элементов группы
редких земель.