школа . 2003. С. 107-113.
Цели лекции:
1. Рассмотреть строение комплексных соединений
2.
Рассмотреть классификацию и номенклатуру комплексных соединенийУчебные вопросы:
1. Строение комплексных соединений.
2. Классификация и номенклатура
комплексных соединений.

![Комплексные соединения Строение комплексных соединенийКалий гексацианоферрат (III)Fe3+CN-CN-CN-CN-CN-CN-K+K+K+ Ион комплексообразователялигандыВнутренняя сфераВнешняя сфера[ (CN)6]К3Fe→3K+→ [Fe (CN)6]3- Строение комплексных соединенийКалий гексацианоферрат (III)Fe3+CN-CN-CN-CN-CN-CN-K+K+K+ Ион комплексообразователялигандыВнутренняя сфераВнешняя](/img/thumbs/57b093bad84c66463d6430150e4d0f81-800x.jpg)
![Комплексные соединения Координационная теория комплексных соединений(А. Вернер, 1898 г.)Соединения первого порядка (валентно-ненасыщенные)Соединения высшего Координационная теория комплексных соединений(А. Вернер, 1898 г.)Соединения первого порядка (валентно-ненасыщенные)Соединения высшего порядка (валентно-насыщенные)Fe (CN)3+3KCNK3[Fe(CN)6]CoCl6+3NH3[Co(NH3)6]Cl3BF3+HFNi+4COH[BF4][Ni(CO)4]3K+ [Fe(CN)6]3-3Cl-](/img/thumbs/3d37499a9df3a6e801d9bb03a839af6c-800x.jpg)

![Комплексные соединения Номенклатура комплексных соединенийК[Co(CN)(CO)2(NO)] -калийдикарбонилнитрозилцианокобальт (0)1) NH4SCN+Cr(SCN)3+2NH3NH4[Cr(SCN)4(NH3)2] аммоний диаммин тетратиоцианатохромат(III) 2) CoCl3+ 5NH3 [CoCl(NH3)5]Cl2пентаамминкобальт(III)хлорохлорид3) Номенклатура комплексных соединенийК[Co(CN)(CO)2(NO)] -калийдикарбонилнитрозилцианокобальт (0)1) NH4SCN+Cr(SCN)3+2NH3NH4[Cr(SCN)4(NH3)2] аммоний диаммин тетратиоцианатохромат(III) 2) CoCl3+ 5NH3 [CoCl(NH3)5]Cl2пентаамминкобальт(III)хлорохлорид3) CrCl3+ 6H2O[Cr(H2O)6]Cl3гексааква[CrCl(H2O)5]Cl2 ⋅ H2Oхром(III)](/img/thumbs/ba78c67ab587cf91d6b406a4d97e19a0-800x.jpg)
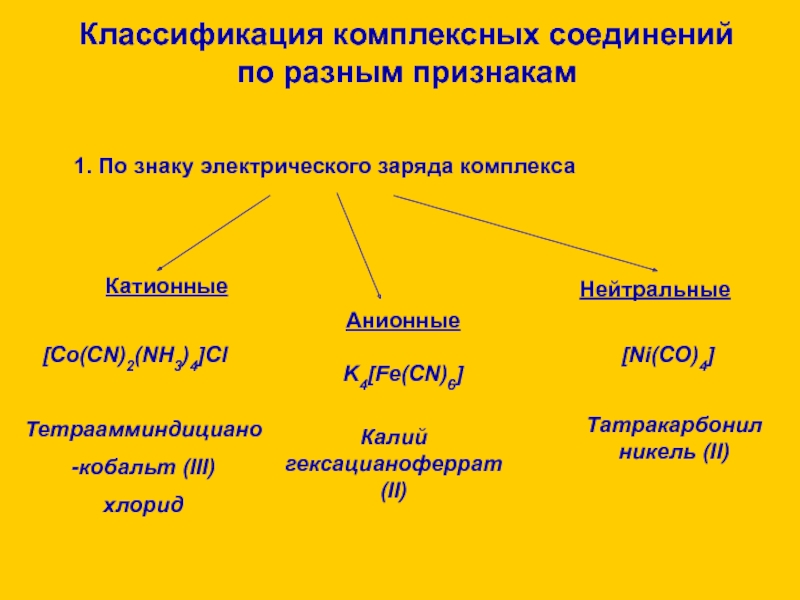
![Комплексные соединения 2. По принадлежности к определённому классу соединенийкомплексныедиамминсеребро(I) гидрооксидкислотыоснования солиH[AuCl4][Ag(NH3)2]OHK2[HgI4] водород тетрахлороаурат(III) калий 2. По принадлежности к определённому классу соединенийкомплексныедиамминсеребро(I) гидрооксидкислотыоснования солиH[AuCl4][Ag(NH3)2]OHK2[HgI4] водород тетрахлороаурат(III) калий тетраиодомеркурат(II)Классификация комплексных соединений по разным признакам](/img/thumbs/44f24edcf017c90b13f9cc4abee09464-800x.jpg)
![Комплексные соединения 3. По природе лигандовАммиакаты[Ni(NH3)6]Cl2 Аквакомплексы[Co(H2O)6]SO4 АцидокомплексыK[Cu(CN)2]Карбонилы [Fe(CO)5]Гидроксокомплексы K3[Al(OH)6 ]ЦианидныеK4[Со(CN)6]Карбонатные[Fe(CO3)(NH3)]ClРазнолигандные[CoI(NH3)5]Cl2NH4[Cr(SCN)4(NH3)2]Классификация комплексных соединений по разным признакам 3. По природе лигандовАммиакаты[Ni(NH3)6]Cl2 Аквакомплексы[Co(H2O)6]SO4 АцидокомплексыK[Cu(CN)2]Карбонилы [Fe(CO)5]Гидроксокомплексы K3[Al(OH)6 ]ЦианидныеK4[Со(CN)6]Карбонатные[Fe(CO3)(NH3)]ClРазнолигандные[CoI(NH3)5]Cl2NH4[Cr(SCN)4(NH3)2]Классификация комплексных соединений по разным признакам](/img/thumbs/02832d6fbdad4d9c1eb0809a9ba00a9d-800x.jpg)

![Комплексные соединения Классификация комплексных соединений по разным признакам4.2. По наличию или отсутствию цикловПростыеFe4[Fe(CN)6]3берлинская Классификация комплексных соединений по разным признакам4.2. По наличию или отсутствию цикловПростыеFe4[Fe(CN)6]3берлинская лазурьFe3[Fe(CN)6]2турнбулева синьОбнаружение ОВ общетоксического действияЦиклическиеХелаты2+Хлорид [(бис-этилендиамин)медь](/img/thumbs/08e7ddda267b284a93899dfd6a93287a-800x.jpg)