Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теории кислот и оснований
Содержание
- 1. Теории кислот и оснований
- 2. В истории развитии любой науки
- 3. Результат органических реакций часто объясняют с позиции
- 4. Теория электролитической диссоциации Аррениуса (1890г.) Сванте-Август Аррениус
- 5. Протонная теория, или теория кислот и оснований
- 6. Протонная теория, или теория кислот и оснований
- 7. Протонная теория, или теория кислот и оснований
- 8. Протонная теория, или теория кислот и оснований
- 9. Протонная теория, или теория кислот и оснований
- 10. Протонная теория, или теория кислот и оснований
- 11. Протонная теория, или теория кислот и оснований
- 12. Протонная теория, или теория кислот и оснований
- 13. Электронная теория кислот и оснований, или Теория
- 14. Теория кислот и основанийТаким образом, теория кислот
- 15. В настоящее время кислоты Льюиса называют электрофилами,а
- 16. Классификация органических реакцийВсе многообразие органических реакций можно
- 17. Классификация органических реакций1. Реакции замещенияа) Нуклеофильное замещение
- 18. Классификация органических реакций2. Реакции присоединенияОбозначаются символом A
- 19. Классификация органических реакций3. Реакции элиминированияОбозначают символом E
- 20. 4. Перегруппировки или изомеризации Классификация органических реакцийЧрезвычайно
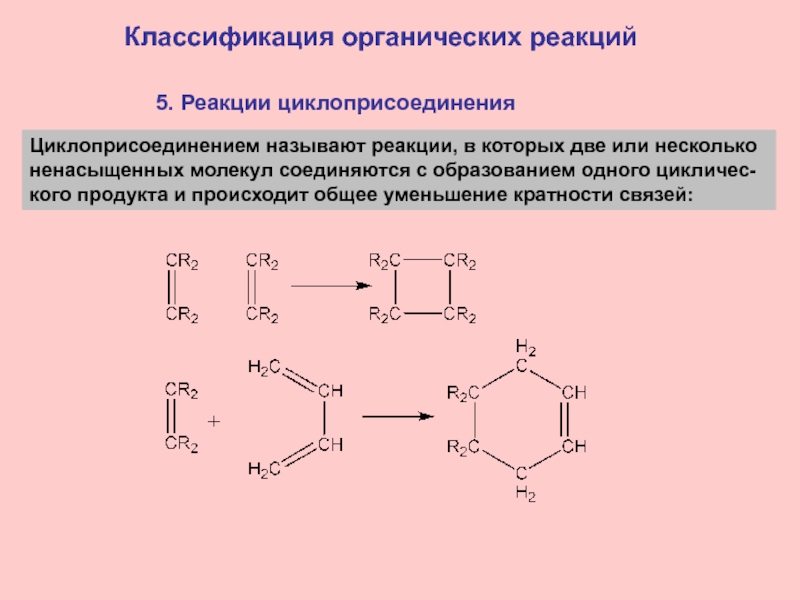
- 21. 5. Реакции циклоприсоединенияКлассификация органических реакцийЦиклоприсоединением называют реакции,
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Результат органических реакций часто объясняют с позиции кислотно-основных свойств органических
соединений
Теория кислот и оснований имеет свою историю
Теория электролитической
диссоциации Аррениуса
Теория
кислот и оснований БренстедаТеория кислот и оснований Льюиса
Слайд 4Теория электролитической диссоциации Аррениуса (1890г.)
Сванте-Август Аррениус
За разработку теории
электролитической диссоциации Аррениусу
была присуждена Нобелевская премия 1903 года
Согласно
Аррениусу кислотами являются электролиты, при диссоциации которых в
водных растворах образуются ионы
водорода (протоны):
Основаниями Аррениуса являются электролиты,
при диссоциации которых в водных растворах
образуются гидроксид-ионы
19.02.1859 - 1927
Слайд 5Протонная теория, или теория кислот и
оснований Бренстеда (1923)
Йоханнес-Николаус
Брёнстед
Согласно теории Бренстеда кислота является донором,
а основание - акцептором
протонов; кислоты и основания существуют только как
сопряженные пары;
протон не существует в растворе в свободном виде,
в воде он образует катион оксония.
Он установил и количественное соотношение между силой кислот
и оснований и их каталитической активностью.
22.02.1879 - 17.12.1947
Слайд 6Протонная теория, или теория кислот и оснований Бренстеда
Поскольку взаимодействие
между
кислотой и основанием является
очень быстрым и равновесным
процессом, то
кислотно-основные свойства необходимо рассматри-
вать только с позиций термодина-
мики. Исключениями выступают,
так называемые, СН кислоты.
Количественно кислотность и основность
оценивают, как правило, по отношению
к воде
Мерой кислотности является константа равновесия,
называемая константой кислотности (Ka)
Ka=[A-] [H3O+]/[AH]
Для оценки величин Ka удобно использовать
показатель кислотности
pKa=-lgKa
Условно кислоты делят на "сильные" pKa < 0 и "слабые" pKa ≈ 2-15.7
Слайд 7Протонная теория, или теория кислот и оснований Бренстеда
В ряде
случаев удается предсказывать силу кислот на основании
положения атомов в
таблице Менделеева:в периодах таблицы кислотность
возрастает по мере роста
электроотрицательности элемента,
с которым связан протон
H-CH3 < H-NH2 < H-OH < H-F
Электроотрицательность
возрастает
в группах кислотность взрастает
с увеличением размера этих атомов
H-F
<
H-Cl
<
H-Br
<
H-I
H-OH
<
H-SH
<
H-SeH
Сложнее предугадать и объяснить кислотность соединений, у которых
протон связан с одинаковыми атомами. Например, какая кислота сильнее
уксусная (СН3СООН или хлоруксусная ClCH2COOH?
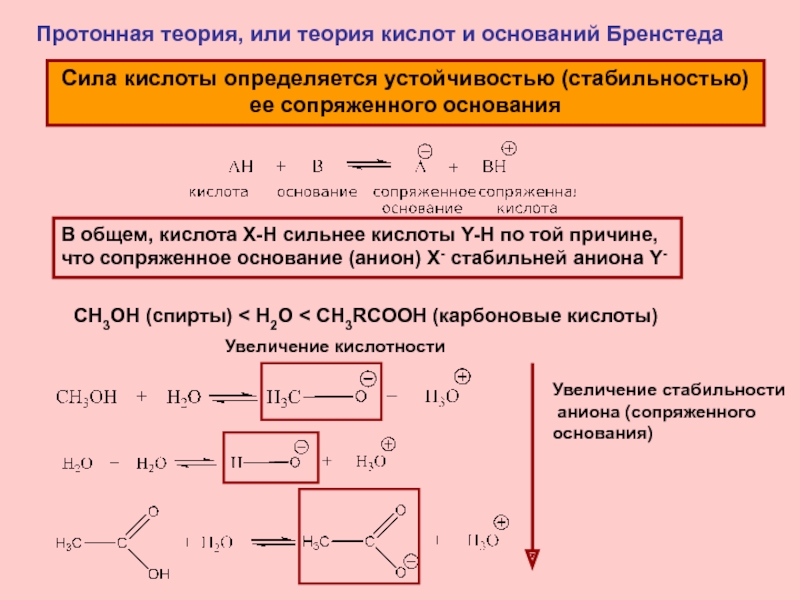
Слайд 8Протонная теория, или теория кислот и оснований Бренстеда
Сила кислоты
определяется устойчивостью (стабильностью)
ее сопряженного основания
В общем, кислота X-H
сильнее кислоты Y-H по той причине, что сопряженное основание (анион) X- стабильней аниона Y-
СН3OH (спирты) < H2O < СН3RCOOH (карбоновые кислоты)
Увеличение кислотности
Увеличение стабильности
аниона (сопряженного
основания)
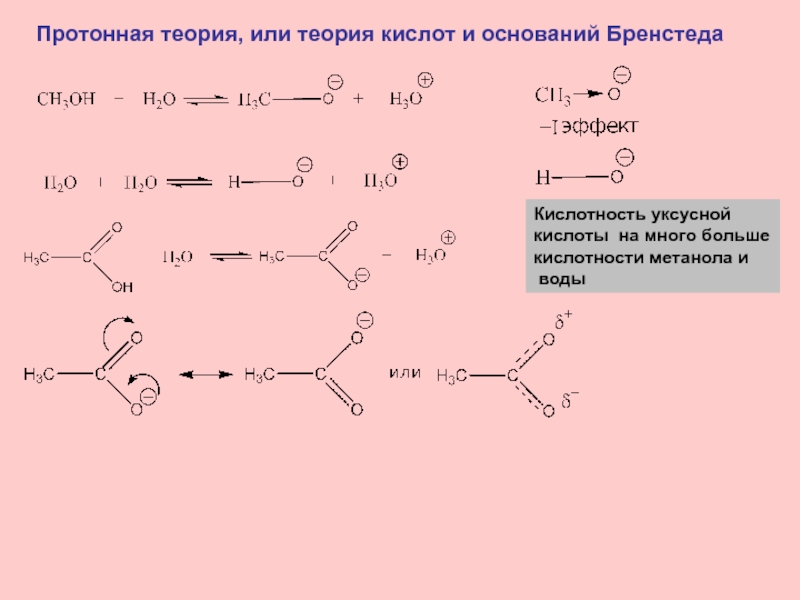
Слайд 9Протонная теория, или теория кислот и оснований Бренстеда
Кислотность уксусной
кислоты на много больше
кислотности метанола и
воды
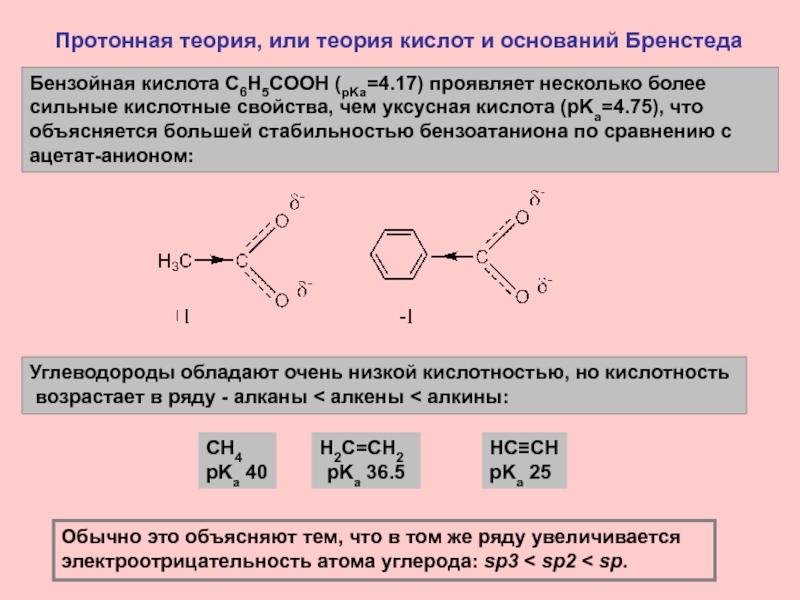
Слайд 10Протонная теория, или теория кислот и оснований Бренстеда
Углеводороды обладают
очень низкой кислотностью, но кислотность
возрастает в ряду - алканы
< алкены < алкины:Обычно это объясняют тем, что в том же ряду увеличивается электроотрицательность атома углерода: sp3 < sp2 < sp.
CH4
pKa 40
H2C=CH2
pKa 36.5
HC≡CH
pKa 25
Бензойная кислота C6H5COOH (pKa=4.17) проявляет несколько более сильные кислотные свойства, чем уксусная кислота (pKa=4.75), что объясняется большей стабильностью бензоатаниона по сравнению с ацетат-анионом:
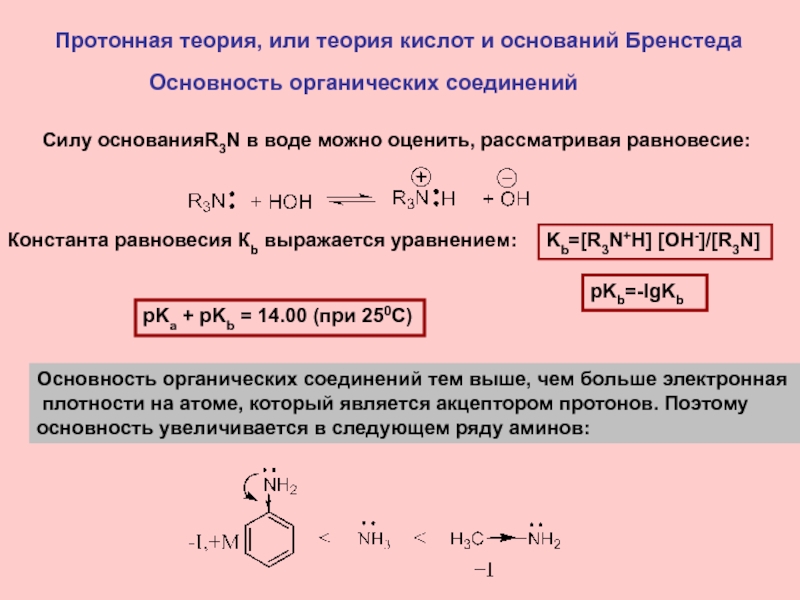
Слайд 11Протонная теория, или теория кислот и оснований Бренстеда
Основность органических
соединений
Основность органических соединений тем выше, чем больше электронная
плотности
на атоме, который является акцептором протонов. Поэтому основность увеличивается в следующем ряду аминов:
Силу основанияR3N в воде можно оценить, рассматривая равновесие:
Kb=[R3N+H] [OH-]/[R3N]
Константа равновесия Кb выражается уравнением:
pKb=-lgKb
pKa + pKb = 14.00 (при 250С)
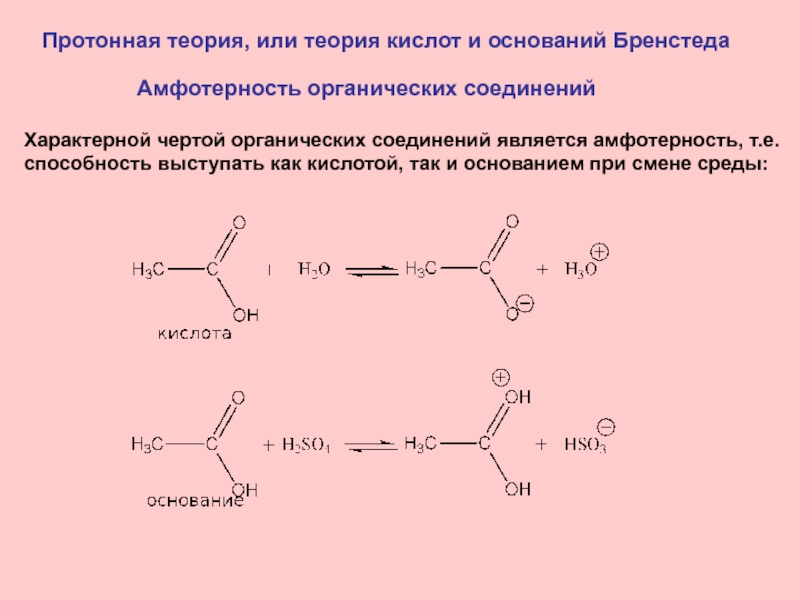
Слайд 12Протонная теория, или теория кислот и оснований Бренстеда
Амфотерность органических
соединений
Характерной чертой органических соединений является амфотерность, т.е.
способность выступать как
кислотой, так и основанием при смене среды:Слайд 13Электронная теория кислот и оснований,
или Теория Льиса (1926)
Джилберт Ньютон
Льюис
23 октября 1875 г. – 23 марта 1946 г.
Электронная теория кислот и оснований является
наиболее общей теорией кислот и оснований
кислоты - это вещества, способные принимать
электронную пару (акцетор электронной пары),
а основания - вещества, способные давать
электронную пару (доноры электронной пары)
По Льюису
К кислотам Льюиса относятся не только протон H+, но и все катионы,
а также галогениды металлов 2 и 3 групп таблицы Менделеева: AlX3, FeX3,
BX3, SbX5, SnX4, ZnX2 (X=F, Cl, Br, I).
К основаниям Льюиса - все анионы OH-, OR-, CH3COO-, NH2- и т.д. и
нейтральные соединения, имеющие неподеленные электронные пары
или π- связи - H2O, ROH, ROR, RCH=O, RSH, NH3, R3N, RCH=CH2, R-C6H5 и др.
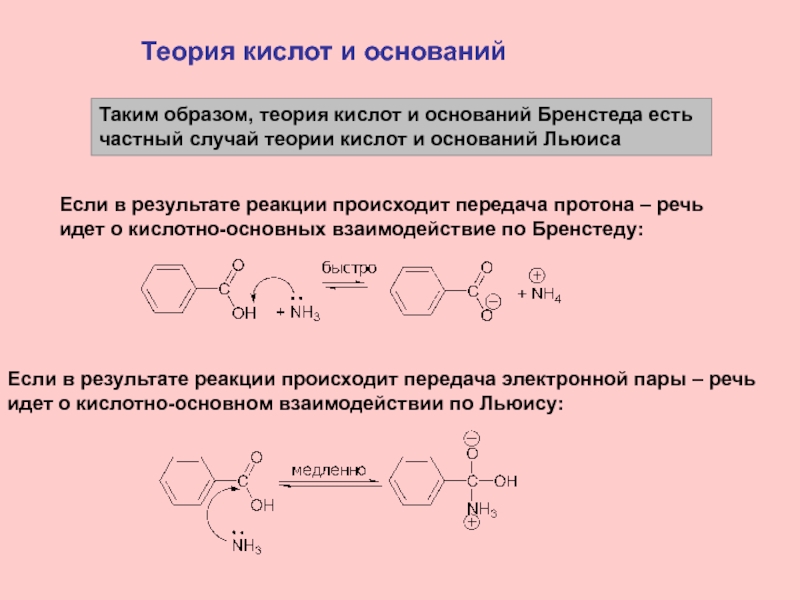
Слайд 14Теория кислот и оснований
Таким образом, теория кислот и оснований Бренстеда
есть
частный случай теории кислот и оснований Льюиса
Если в результате
реакции происходит передача протона – речьидет о кислотно-основных взаимодействие по Бренстеду:
Если в результате реакции происходит передача электронной пары – речь
идет о кислотно-основном взаимодействии по Льюису:
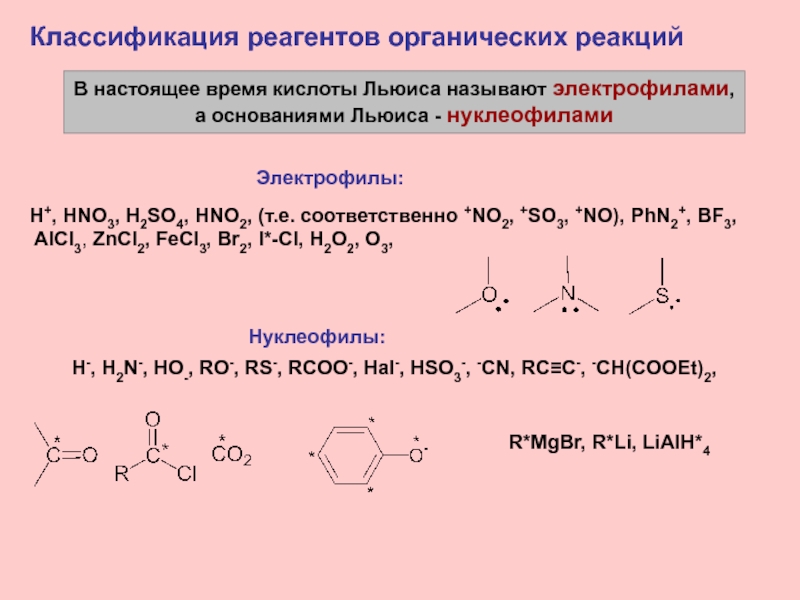
Слайд 15В настоящее время кислоты Льюиса называют электрофилами,
а основаниями Льюиса -
нуклеофилами
Классификация реагентов органических реакций
Электрофилы:
H+, HNO3, H2SO4, HNO2, (т.е. соответственно +NO2,
+SO3, +NO), PhN2+, BF3,AlCl3, ZnCl2, FeCl3, Br2, I*-Cl, H2O2, O3,
Нуклеофилы:
H-, H2N-, HO-, RO-, RS-, RCOO-, Hal-, HSO3-, -CN, RC≡C-, -CH(COOEt)2,
R*MgBr, R*Li, LiAlH*4
Слайд 16Классификация органических реакций
Все многообразие органических реакций можно разделить всего на
пять
классов по типу превращений субстрата и несколько подклассов по
типу реагента
Субстрат – молекула, на которую воздействуют во время реакции
Реагент – молекула, или интермедиат, которая / ый воздействует во время
реакции на субстрат
1. Реакции замещения
Данный тип реакций обозначают буквой S (от английского слова
"замещение" - substitution)
По типу реагента эти реакции разделяют на следующие подклассы:
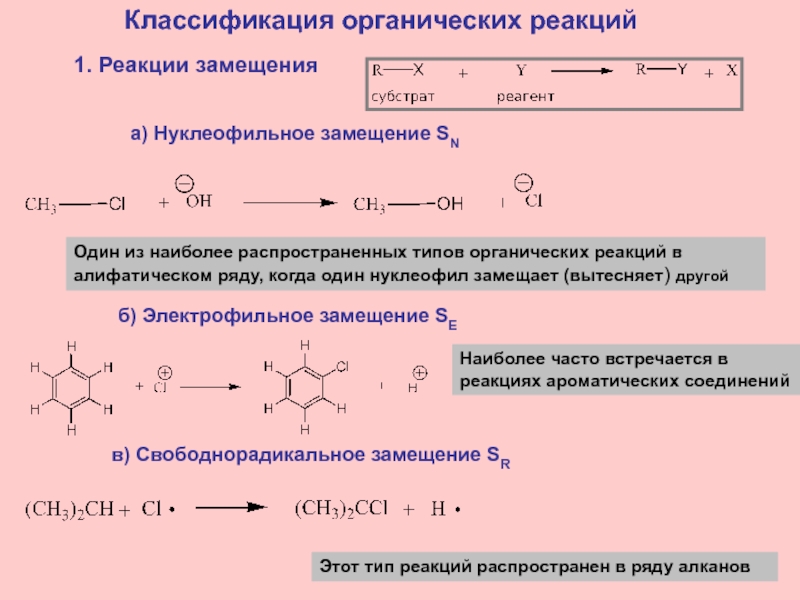
Слайд 17Классификация органических реакций
1. Реакции замещения
а) Нуклеофильное замещение SN
Один из наиболее
распространенных типов органических реакций в алифатическом ряду, когда один нуклеофил
замещает (вытесняет) другойб) Электрофильное замещение SE
Наиболее часто встречается в
реакциях ароматических соединений
в) Свободнорадикальное замещение SR
Этот тип реакций распространен в ряду алканов
Слайд 18Классификация органических реакций
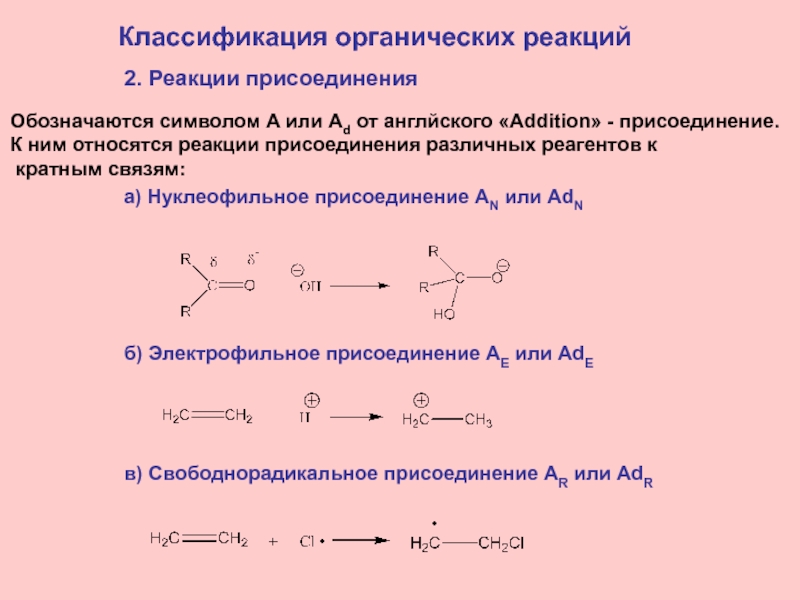
2. Реакции присоединения
Обозначаются символом A или Ad от
англйского «Addition» - присоединение.
К ним относятся реакции присоединения различных
реагентов к кратным связям:
а) Нуклеофильное присоединение AN или AdN
б) Электрофильное присоединение AE или AdE
в) Свободнорадикальное присоединение AR или AdR
Слайд 19Классификация органических реакций
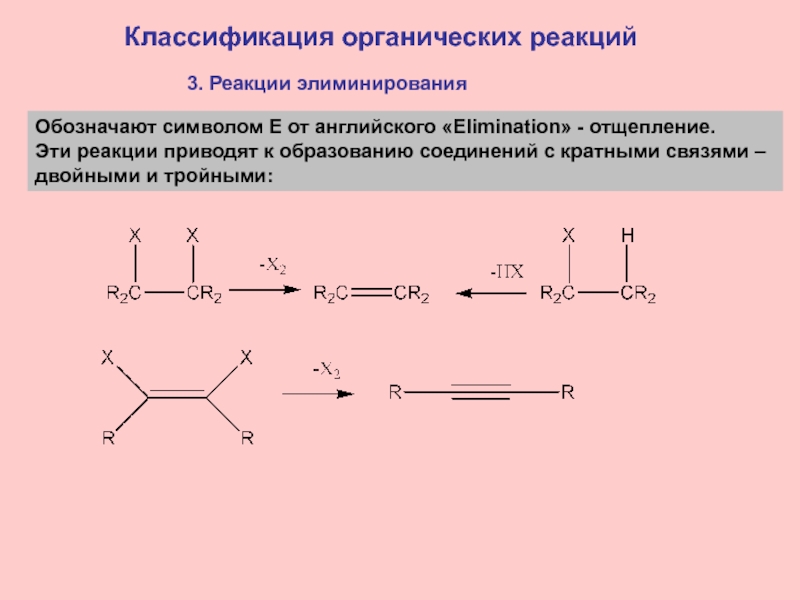
3. Реакции элиминирования
Обозначают символом E от английского «Elimination»
- отщепление.
Эти реакции приводят к образованию соединений с кратными
связями – двойными и тройными:
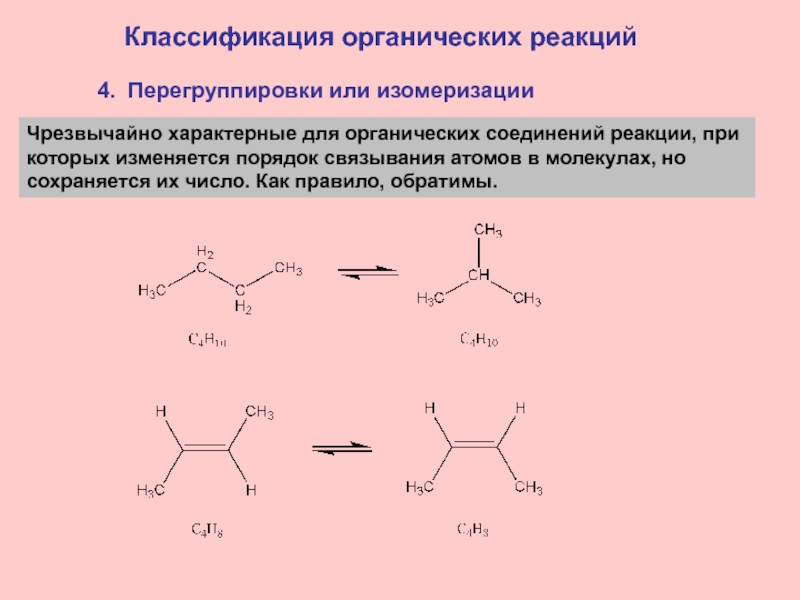
Слайд 204. Перегруппировки или изомеризации
Классификация органических реакций
Чрезвычайно характерные для органических
соединений реакции, при
которых изменяется порядок связывания атомов в молекулах,
но сохраняется их число. Как правило, обратимы.