Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Содержание
- 1. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- 2. ГЕТЕОИКЛИЧСКИЕ СОЕДИНЕНИЯГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯГетероциклические органические соединения содержат циклы,
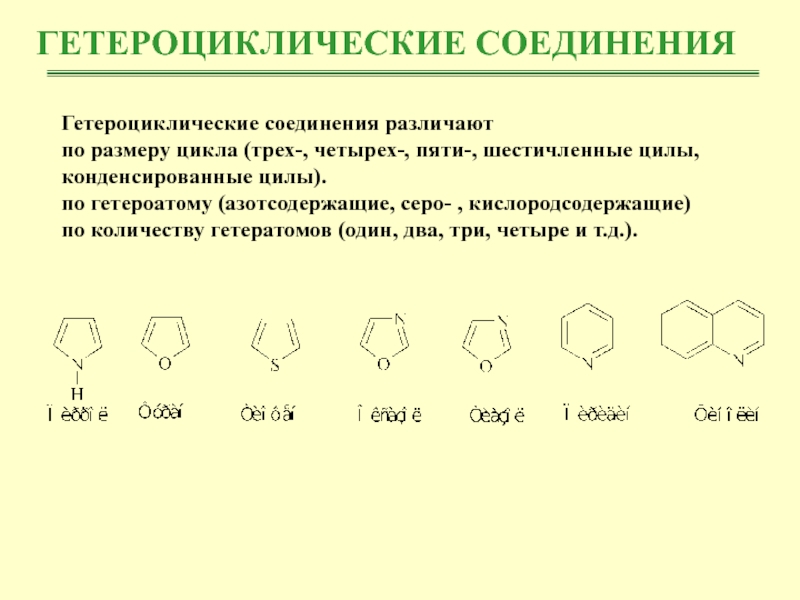
- 3. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯГетероциклические соединения различаютпо размеру цикла (трех-,
- 4. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫПростейшие пятичленные гетероциклы: пиррол, фуран, тиофен
- 5. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫВеличины теплот сгорания указывают на наличие
- 6. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРассмотрим строение пятичленных гетероциклов на примере
- 7. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСледствием делокализации четырех π-электронов атомов углерода
- 8. В отличие от вторичных аминов, для которых
- 9. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСтруктура фурана и тиофена аналогичны структуре
- 10. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫЭлектроотрицательность элементов увеличивается S < N
- 11. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫХимические свойства Пиррол обладает свойствами слабой
- 12. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫВзаимодействие с сильными кислотами, ацидофобность Пиррол,
- 13. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения Пиррол, фуран и
- 14. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения В реакции электрофильного
- 15. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения Нитрование и сульфирование
- 16. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения
- 17. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения Фуран в реакциях
- 18. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения Тиофен менее реакционноспособен
- 19. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакция обмена гетероатомов Реакция обмена гетероатомов
- 20. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции присоединения Фуран, пиррол сравнительно легко
- 21. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции присоединения В пятичленных гетероциклах ароматический
- 22. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСпособы получения Тиофен получают в результате
- 23. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСпособы получения Фуран получают, обрабатывая мякину овса или риса, початков кукурузы горячей соляной кислотой
- 24. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСпособы получения Общим методом синтеза пятичленных
- 25. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
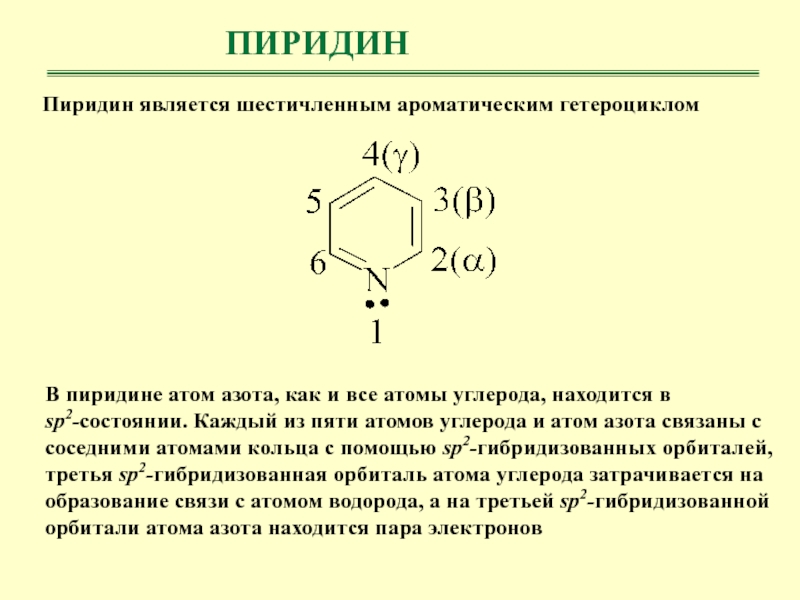
- 26. ПИРИДИНПиридин является шестичленным ароматическим гетероциклом В пиридине
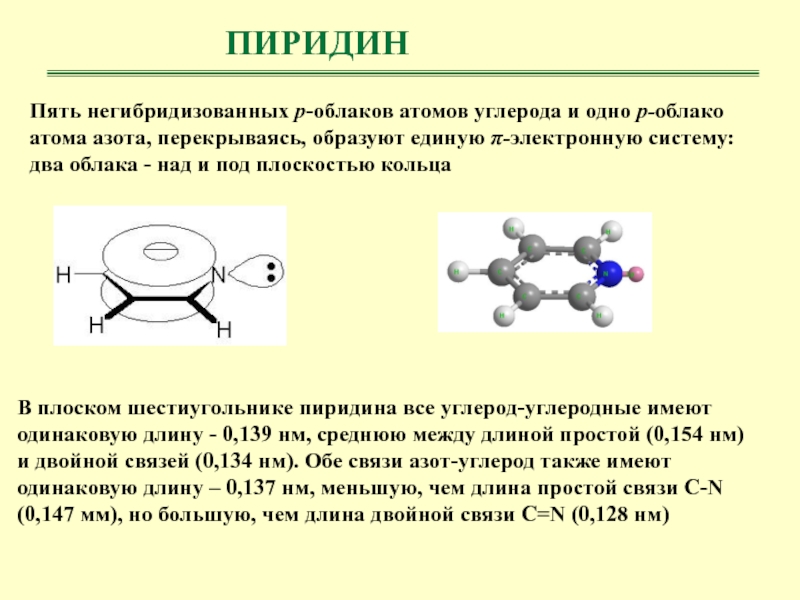
- 27. ПИРИДИНПять негибридизованных р-облаков атомов углерода и одно
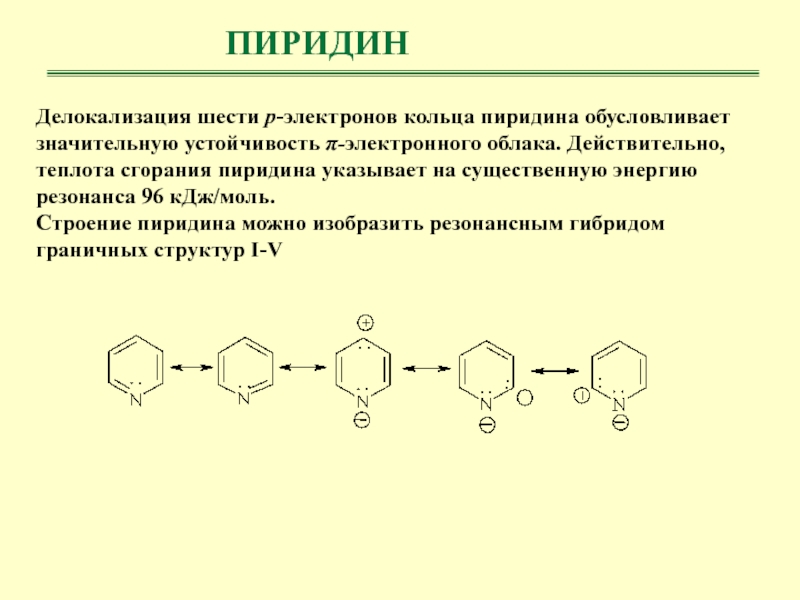
- 28. ПИРИДИНДелокализация шести р-электронов кольца пиридина обусловливает значительную
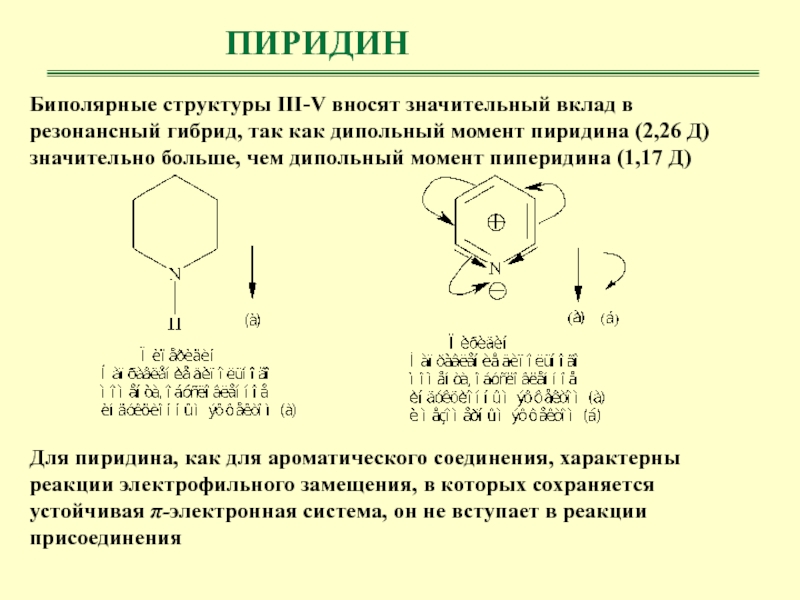
- 29. ПИРИДИНБиполярные структуры III-V вносят значительный вклад в
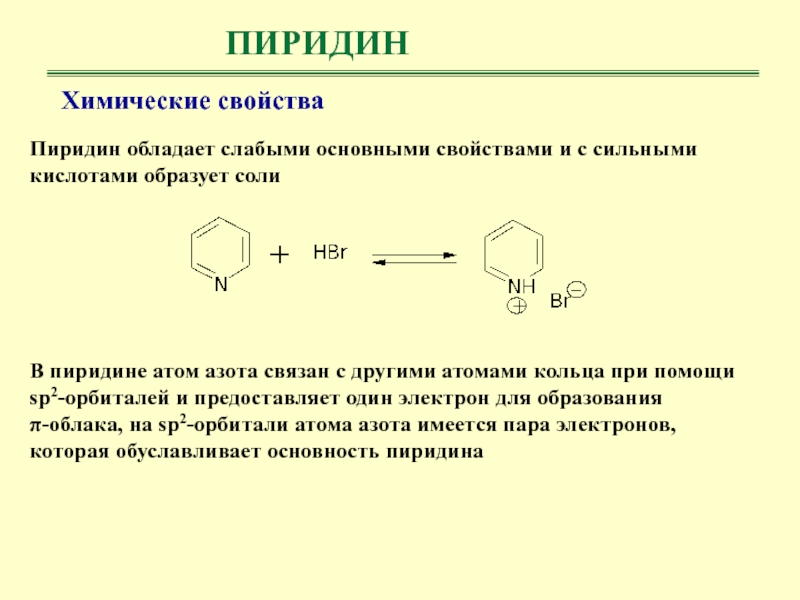
- 30. ПИРИДИНХимические свойства Пиридин обладает слабыми основными свойствами
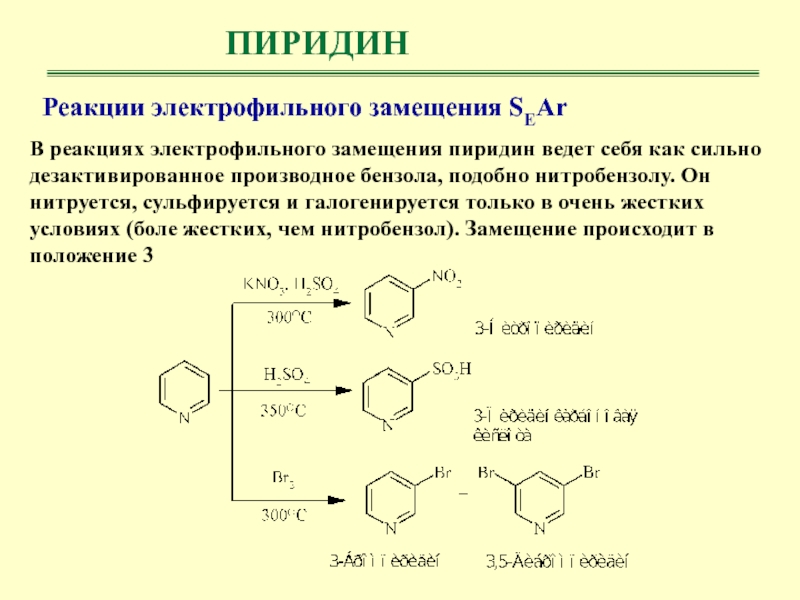
- 31. ПИРИДИНРеакции электрофильного замещения SEArВ реакциях электрофильного замещения
- 32. ПИРИДИНРеакции электрофильного замещения SEArНизкая реакционная способность пиридина,
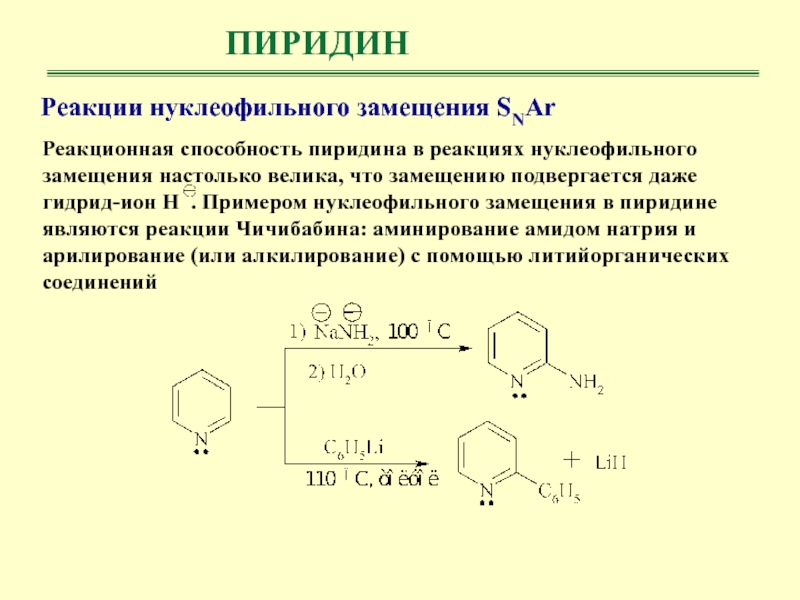
- 33. ПИРИДИНРеакции нуклеофильного замещения SNAr Реакционная способность пиридина
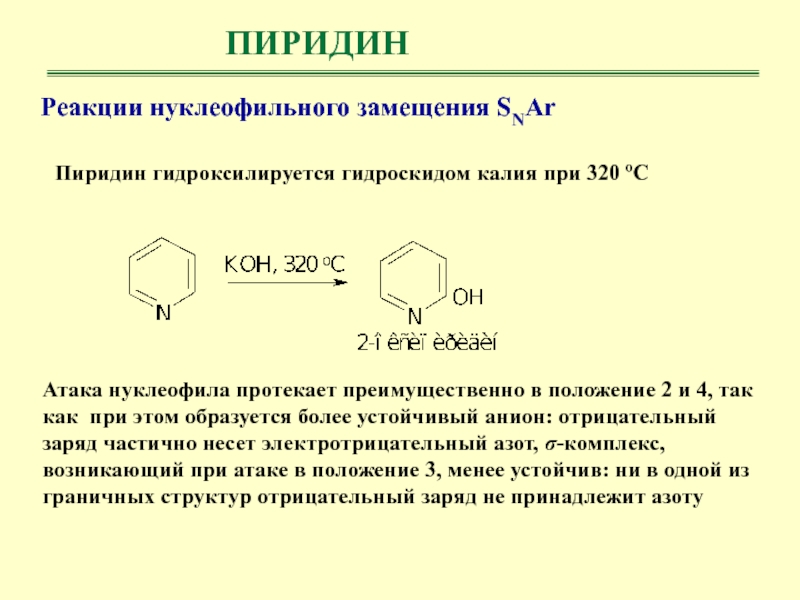
- 34. ПИРИДИНПиридин гидроксилируется гидроскидом калия при 320 ºСРеакции
- 35. ПИРИДИНОсновность пиридинаВ пиридине на атоме азота имеется
- 36. ПИРИДИНОсновность пиридинаПара электронов, обусловливающая основность пиридина, занимает
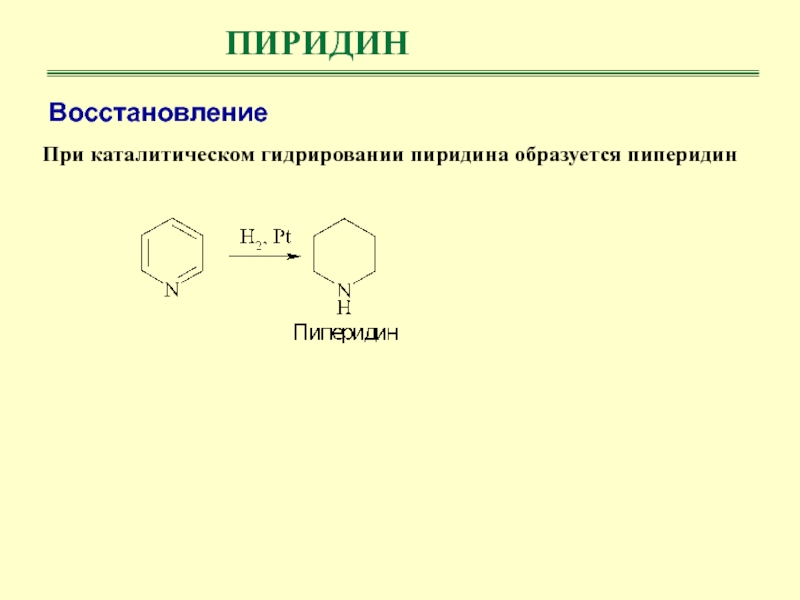
- 37. ПИРИДИНВосстановлениеПри каталитическом гидрировании пиридина образуется пиперидин
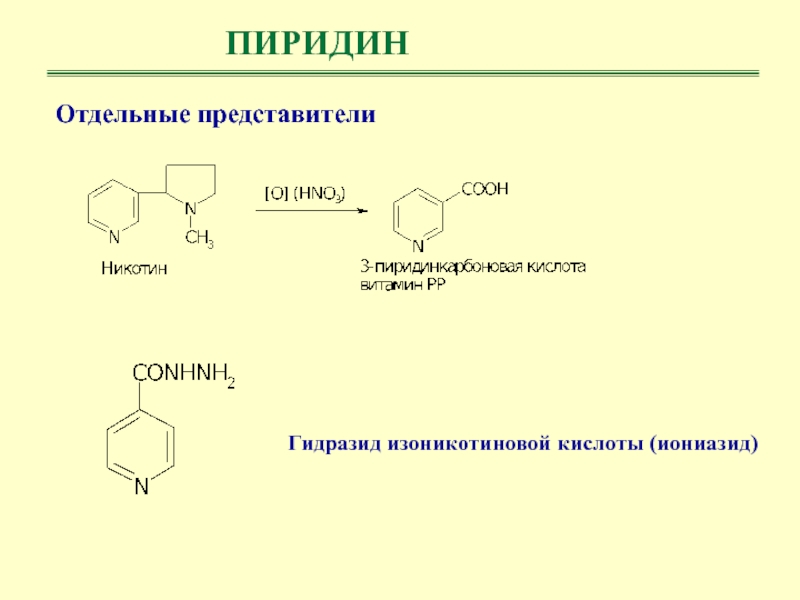
- 38. ПИРИДИНОтдельные представители Гидразид изоникотиновой кислоты (иониазид)
- 39. ПИРИДИНМетоды получения Пиридин содержится в каменноугольной смоле.
- 40. ХИНОЛИНХинолин представляет собой конденсированную систему, содержащую бензольное
- 41. ХИНОЛИНХинолин вступает в реакции электрофильного замещения. При
- 42. ХИНОЛИНРеакции нуклеофильного замещения SNAr Хинолин так же,
- 43. ХИНОЛИНОкислениеПри окислении перманганатом калия образуется дикарбоновая кислота
- 44. ХИНОЛИННаиболее удобным путем получения хинолина является метод
- 45. ХИНОЛИНМетоды получения Синтез состоит из следующих стадий.1.
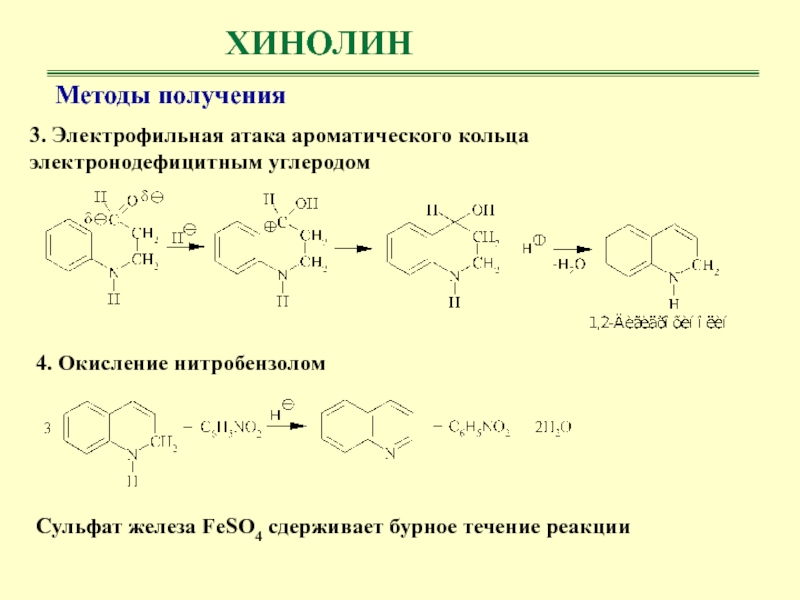
- 46. ХИНОЛИНМетоды получения 3. Электрофильная атака ароматического кольца
- 47. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2ГЕТЕОИКЛИЧСКИЕ СОЕДИНЕНИЯ
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические органические соединения содержат циклы, в которых один
Слайд 3ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические соединения различают
по размеру цикла (трех-, четырех-, пяти-, шестичленные
цилы, конденсированные цилы).
по гетероатому (азотсодержащие, серо- , кислородсодержащие)
по количеству гетератомов
(один, два, три, четыре и т.д.).
Слайд 4
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Простейшие пятичленные гетероциклы: пиррол, фуран, тиофен - содержат один
гетероатом .
В соответствии с представленными формулами каждое из этих соединений
будет обладать свойствами сопряженного диена и соответственно - свойствами амина R-NH-R, простого эфира R-O-R и тиоэфира (сульфида) R-S-R. Однако пиррол не обладает основными свойствами, типичными для аминиов, тиофен не вступает в реакции окисления, типичные для сульфидов. Для них характерна способность вступать в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу Слайд 5
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Величины теплот сгорания указывают на наличие значительной энергии резонансной
стабилизации - 67-117 кДж/моль. Это несколько меньше, чем энергия резонанса
бензола (154 кДж/моль), но гораздо больше, чем аналогичная величина для большинства сопряженных диенов (15 кДж/моль). Следовательно, эти соединения являются ароматическимиСлайд 6
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
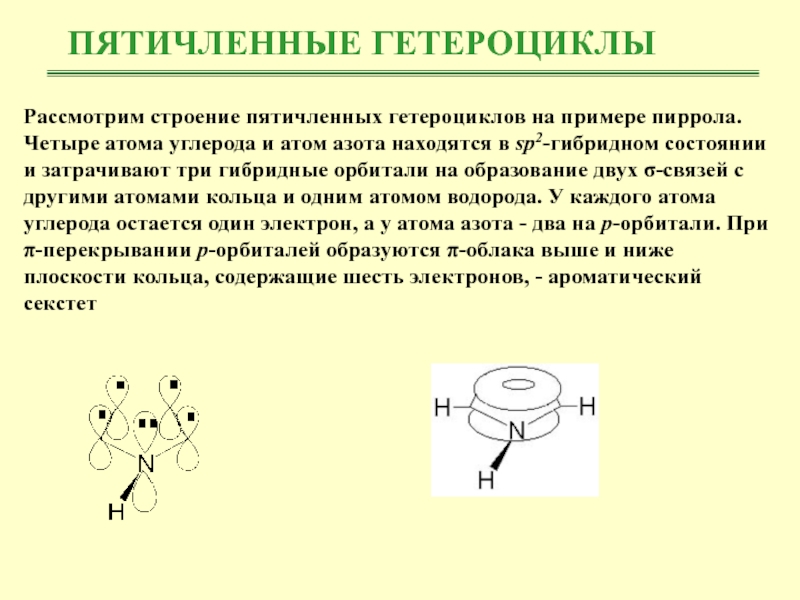
Рассмотрим строение пятичленных гетероциклов на примере пиррола. Четыре атома
углерода и атом азота находятся в sp2-гибридном состоянии и затрачивают
три гибридные орбитали на образование двух σ-связей с другими атомами кольца и одним атомом водорода. У каждого атома углерода остается один электрон, а у атома азота - два на р-орбитали. При π-перекрывании р-орбиталей образуются π-облака выше и ниже плоскости кольца, содержащие шесть электронов, - ароматический секстетСлайд 7
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Следствием делокализации четырех π-электронов атомов углерода и двух электронов
гетероатома является склонность к реакциям электрофильного замещения, в которых сохраняется
π-электронная система
Слайд 8В отличие от вторичных аминов, для которых рКb ≈ 10,5,
пиррол - очень слабое основание (рКb =11,3). Это объясняется тем,
что свободная пара электронов азота, которая обусловливает основные свойства азотсодержащих соединений, вовлечена в π-электронное облако и не может быть предоставлена для образования связи с протоном.Высокая электронная плотность в кольце пиррола (электроноизбыточные циклы) обусловливает высокую реакционную способность пиррола в реакциях электрофильного замещения
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Слайд 9ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
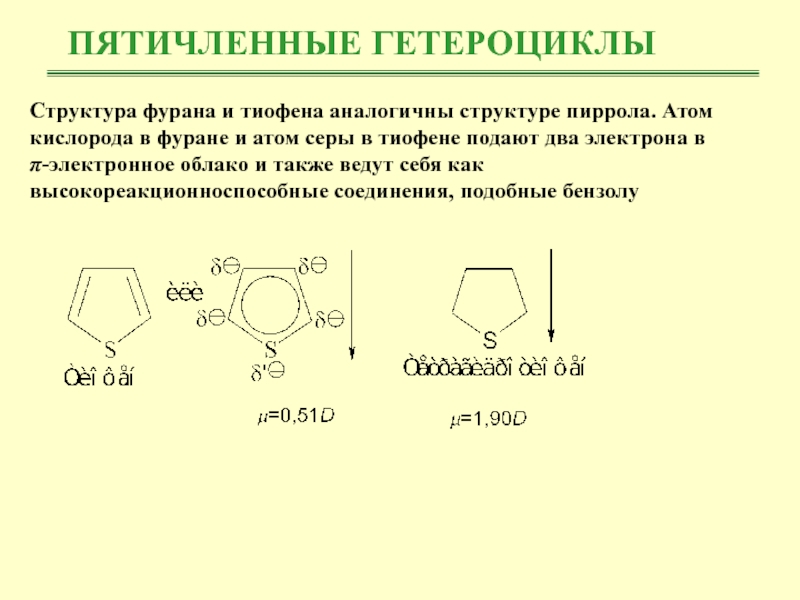
Структура фурана и тиофена аналогичны структуре пиррола. Атом кислорода
в фуране и атом серы в тиофене подают два электрона
вπ-электронное облако и также ведут себя как высокореакционноспособные соединения, подобные бензолу
Слайд 10ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
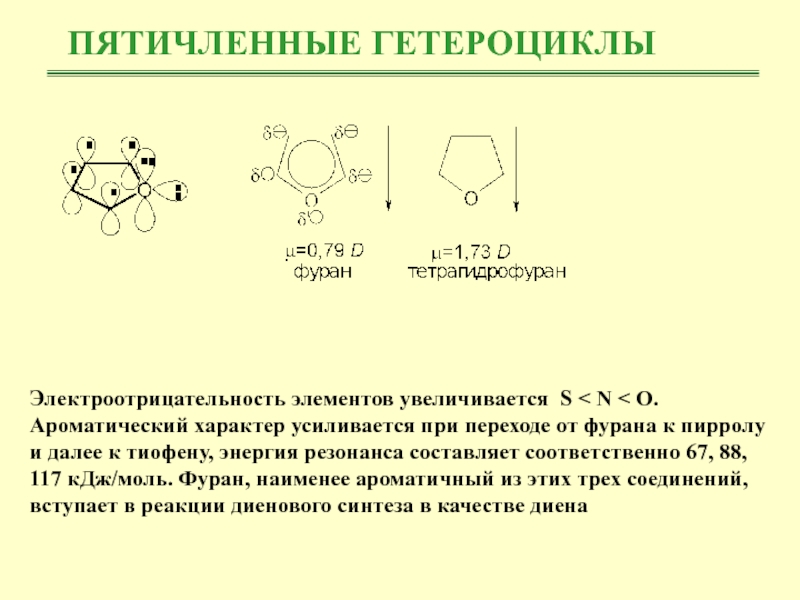
Электроотрицательность элементов увеличивается S < N < O.
Ароматический характер
усиливается при переходе от фурана к пирролу и далее к
тиофену, энергия резонанса составляет соответственно 67, 88, 117 кДж/моль. Фуран, наименее ароматичный из этих трех соединений, вступает в реакции диенового синтеза в качестве диенаСлайд 11ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Химические свойства
Пиррол обладает свойствами слабой кислоты и образует
соли со щелочными металлами
Значение рКа пиррола оценивается приближенно как
16,5, следовательно, это более сильная кислота, чем аммиак. Это обусловлено большей степенью s-характера N-H-связи по сравнению с аммиаком. Свободная электронная пара азота, которая обуславливает основные свойства, вовлечена в π-облако, и поэтому она не способна к обобществлению с протонами кислоты Слайд 12ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Взаимодействие с сильными кислотами, ацидофобность
Пиррол, фуран и тиофен
взаимодейтсвуют с сильными кислотами. В случае пиррола и фурана происходит
осмоление (олигомеризация и полимеризация), тиофен в присутствии серной кислоты сульфируется. Т.е. пиррол и фуран являются ацидофобными (боятся кислот). Ацидофобность связана с присоединением протона к α-углеродному атому, разрушением стабилизированной замкнутой сопряженной системы с вытекающим отсюда следствием – дальнейшими превращениями активной диеновой системы
Слайд 13ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Реакции электрофильного замещения
Пиррол, фуран и тиофен, как и
другие ароматические соединения, вступают в реакции электрофильного замещения: нитрование, сульфирование,
галогенирование, ацилирование по Фриделю-Крафтсу. Пиррол и фуран более реакционноспособные соединения, чем бензол, и сходны с наиболее активными производными бензола: аминами и фенолами. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол.
Слайд 14ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Реакции электрофильного замещения
В реакции электрофильного замещения лимитирующей стадией
является стадия образования σ-комплекса в результате присоединения электрофильного реагента к
атому углерода кольцаЭлектрофильное замещение происходит в положение 2
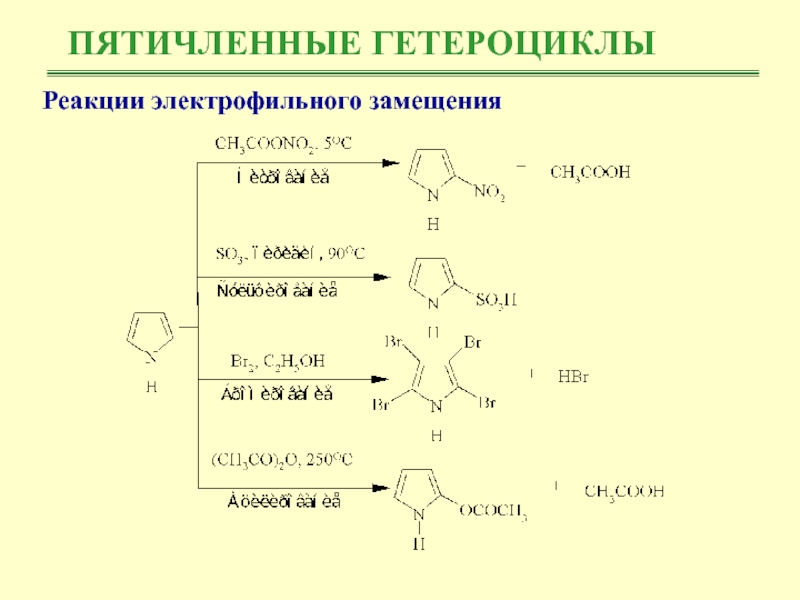
Слайд 15ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Реакции электрофильного замещения
Нитрование и сульфирование пиррола из-за чувствительности
к протонным кислотам (происходит полимеризация) проводят в отсутствие протонных кислот.
Реакция бромирования и ацилирования по Фриделю-Крафту протекает без участия катализатора
Слайд 17ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
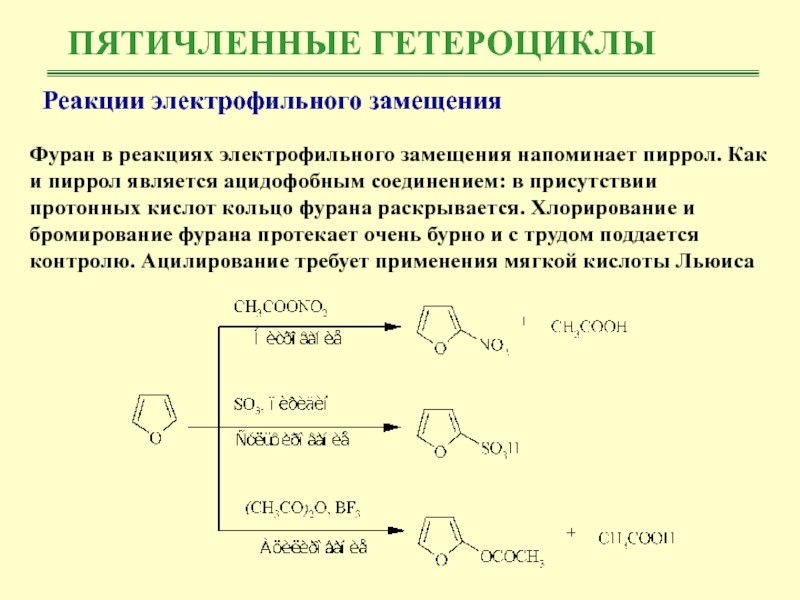
Реакции электрофильного замещения
Фуран в реакциях электрофильного замещения напоминает
пиррол. Как и пиррол является ацидофобным соединением: в присутствии протонных
кислот кольцо фурана раскрывается. Хлорирование и бромирование фурана протекает очень бурно и с трудом поддается контролю. Ацилирование требует применения мягкой кислоты Льюиса
Слайд 18ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
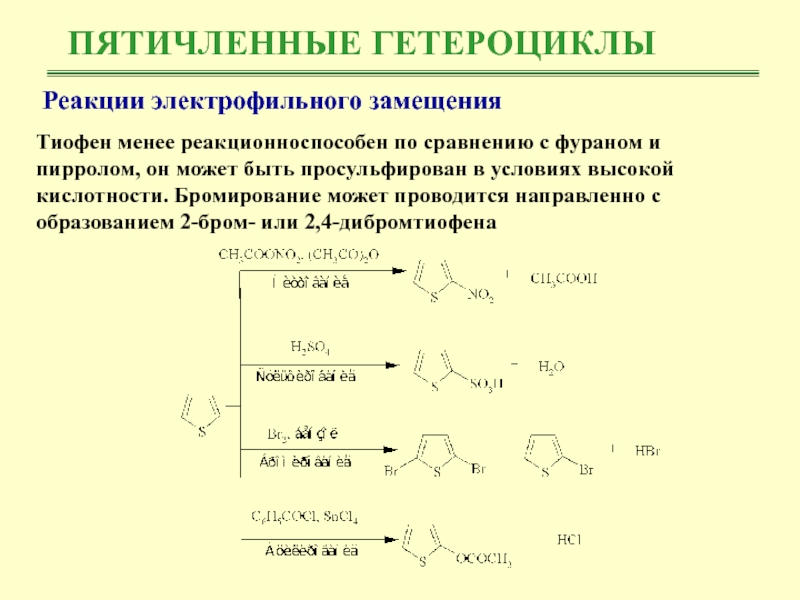
Реакции электрофильного замещения
Тиофен менее реакционноспособен по сравнению с
фураном и пирролом, он может быть просульфирован в условиях высокой
кислотности. Бромирование может проводится направленно с образованием 2-бром- или 2,4-дибромтиофена
Слайд 19ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
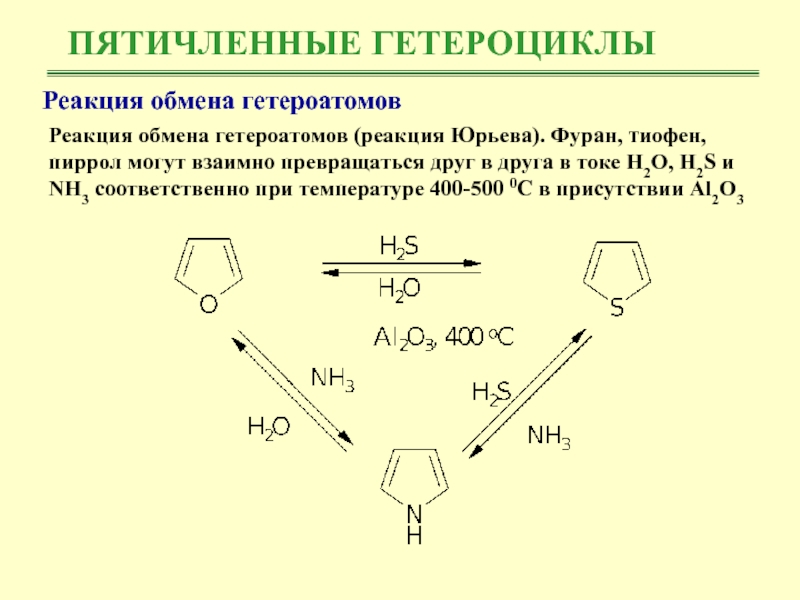
Реакция обмена гетероатомов
Реакция обмена гетероатомов (реакция Юрьева). Фуран,
тиофен, пиррол могут взаимно превращаться друг в друга в токе
Н2О, Н2S и NH3 соответственно при температуре 400-500 0С в присутствии Al2O3
Слайд 20ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Реакции присоединения
Фуран, пиррол сравнительно легко гидрируются (тиофен отравляет
катализатор)
Тиофен может восстанавливаться химически (Na, C2H5OH).
Гидрированные продукты (тетрагидрофуран,
пирролидин и тиофан) используются в качестве растворителей Слайд 21ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Реакции присоединения
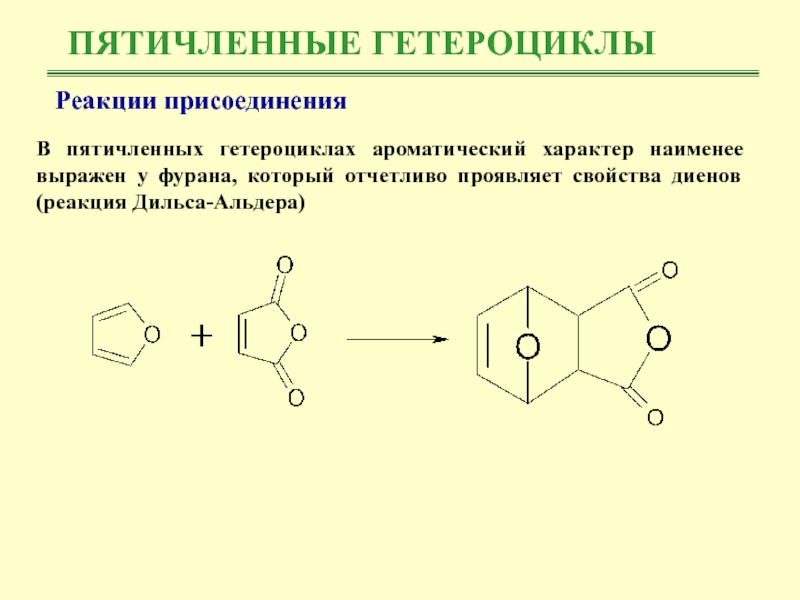
В пятичленных гетероциклах ароматический характер наименее выражен
у фурана, который отчетливо проявляет свойства диенов (реакция Дильса-Альдера)
Слайд 22ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Способы получения
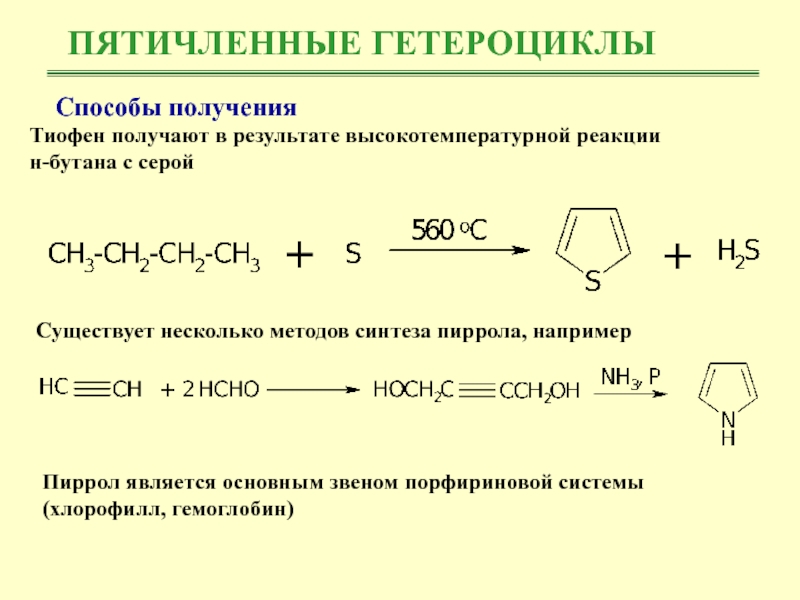
Тиофен получают в результате высокотемпературной реакции
н-бутана
с серой
Существует несколько методов синтеза пиррола, например
Пиррол является основным
звеном порфириновой системы (хлорофилл, гемоглобин) Слайд 23ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Способы получения
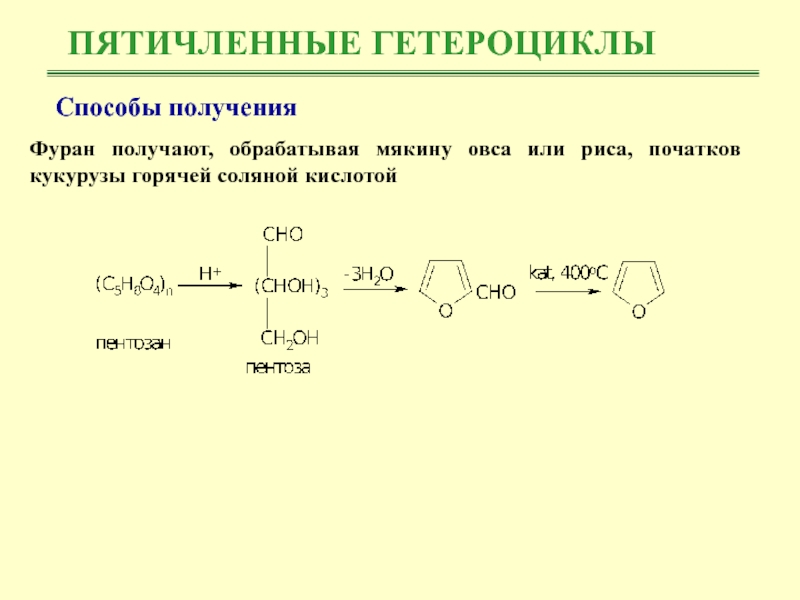
Фуран получают, обрабатывая мякину овса или риса,
початков кукурузы горячей соляной кислотой
Слайд 24ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
Способы получения
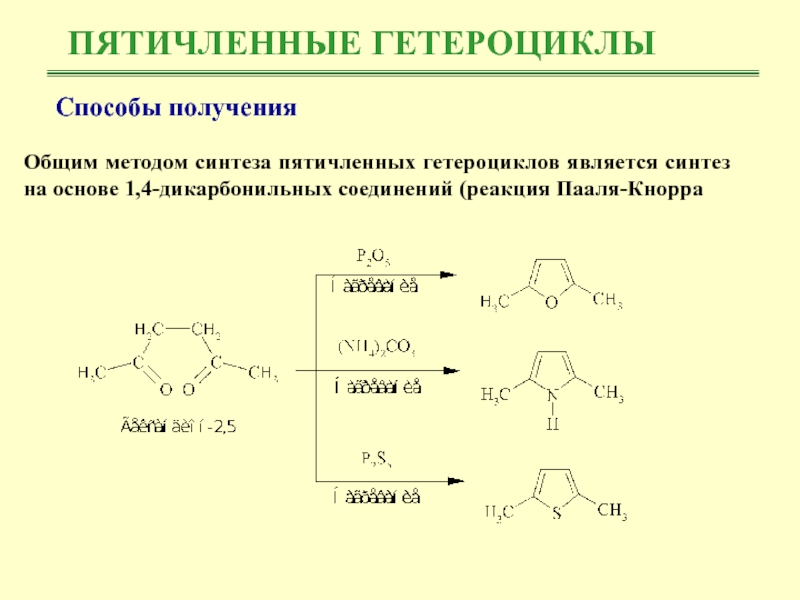
Общим методом синтеза пятичленных гетероциклов является синтез
на основе 1,4-дикарбонильных соединений (реакция Пааля-Кнорра
Слайд 26
ПИРИДИН
Пиридин является шестичленным ароматическим гетероциклом
В пиридине атом азота, как
и все атомы углерода, находится в sp2-cостоянии. Каждый из пяти
атомов углерода и атом азота связаны с соседними атомами кольца с помощью sp2-гибридизованных орбиталей, третья sp2-гибридизованная орбиталь атома углерода затрачивается на образование связи с атомом водорода, а на третьей sp2-гибридизованной орбитали атома азота находится пара электроновСлайд 27
ПИРИДИН
Пять негибридизованных р-облаков атомов углерода и одно р-облако атома азота,
перекрываясь, образуют единую π-электронную систему: два облака - над и
под плоскостью кольцаВ плоском шестиугольнике пиридина все углерод-углеродные имеют одинаковую длину - 0,139 нм, среднюю между длиной простой (0,154 нм) и двойной связей (0,134 нм). Обе связи азот-углерод также имеют одинаковую длину – 0,137 нм, меньшую, чем длина простой связи С-N (0,147 мм), но большую, чем длина двойной связи С=N (0,128 нм)
Слайд 28
ПИРИДИН
Делокализация шести р-электронов кольца пиридина обусловливает значительную устойчивость π-электронного облака.
Действительно, теплота сгорания пиридина указывает на существенную энергию резонанса 96
кДж/моль.Строение пиридина можно изобразить резонансным гибридом граничных структур I-V
Слайд 29
ПИРИДИН
Биполярные структуры III-V вносят значительный вклад в резонансный гибрид, так
как дипольный момент пиридина (2,26 Д) значительно больше, чем дипольный
момент пиперидина (1,17 Д)Для пиридина, как для ароматического соединения, характерны реакции электрофильного замещения, в которых сохраняется устойчивая π-электронная система, он не вступает в реакции присоединения
Слайд 30
ПИРИДИН
Химические свойства
Пиридин обладает слабыми основными свойствами и с сильными
кислотами образует соли
В пиридине атом азота связан с другими
атомами кольца при помощи sp2-орбиталей и предоставляет один электрон для образования π-облака, на sp2-орбитали атома азота имеется пара электронов, которая обуславливает основность пиридина
Слайд 31
ПИРИДИН
Реакции электрофильного замещения SEAr
В реакциях электрофильного замещения пиридин ведет себя
как сильно дезактивированное производное бензола, подобно нитробензолу. Он нитруется, сульфируется
и галогенируется только в очень жестких условиях (боле жестких, чем нитробензол). Замещение происходит в положение 3
Слайд 32
ПИРИДИН
Реакции электрофильного замещения SEAr
Низкая реакционная способность пиридина, как и нитробензола,
объясняется тем, что образующиеся при атаке электрофилом любого положения кольца
карбокатионы менее устойчивы, чем карбокатион, возникающий при атаке бензольного ядра, из-за присутствия в кольце электроотрицательного азотаСлайд 33
ПИРИДИН
Реакции нуклеофильного замещения SNAr
Реакционная способность пиридина в реакциях нуклеофильного
замещения настолько велика, что замещению подвергается даже гидрид-ион Н .
Примером нуклеофильного замещения в пиридине являются реакции Чичибабина: аминирование амидом натрия и арилирование (или алкилирование) с помощью литийорганических соединений
Слайд 34
ПИРИДИН
Пиридин гидроксилируется гидроскидом калия при 320 ºС
Реакции нуклеофильного замещения SNAr
Атака нуклеофила протекает преимущественно в положение 2 и 4, так
как при этом образуется более устойчивый анион: отрицательный заряд частично несет электротрицательный азот, σ-комплекс, возникающий при атаке в положение 3, менее устойчив: ни в одной из граничных структур отрицательный заряд не принадлежит азоту Слайд 35
ПИРИДИН
Основность пиридина
В пиридине на атоме азота имеется неподеленная пара электронов,
которая может обобществляться с протоном, - пиридин является основанием (КВ=2,3х10-9).
Он является более слабым основанием, чем алифатические амины R1R2NH (КВ~10-4). Для объяснения такой зависимости основности от строения можно провести аналогию между электроотрицательностью атома углерода в различных гибридных состояниях и электроотрицательностью атома азота в sp3- и sp2- состоянияхСSP3 < CSP2 < CSP
⎯⎯⎯⎯⎯⎯⎯→
NSP3 < NSP2
⎯⎯⎯⎯⎯⎯⎯→
Электроотрицательность увеличивается
Слайд 36
ПИРИДИН
Основность пиридина
Пара электронов, обусловливающая основность пиридина, занимает sp2-орбиталь атома азота,
она находится ближе к ядру, электроны удерживаются ядром сильнее и
менее доступны для обобществления с протоном, чем пара электронов sp3-гибридизованного атома азота.Благодаря наличию пары электронов на атоме азота пиридин является нуклеофилом и реагирует с галогеналканами с образованием четвертичных солей
Слайд 39
ПИРИДИН
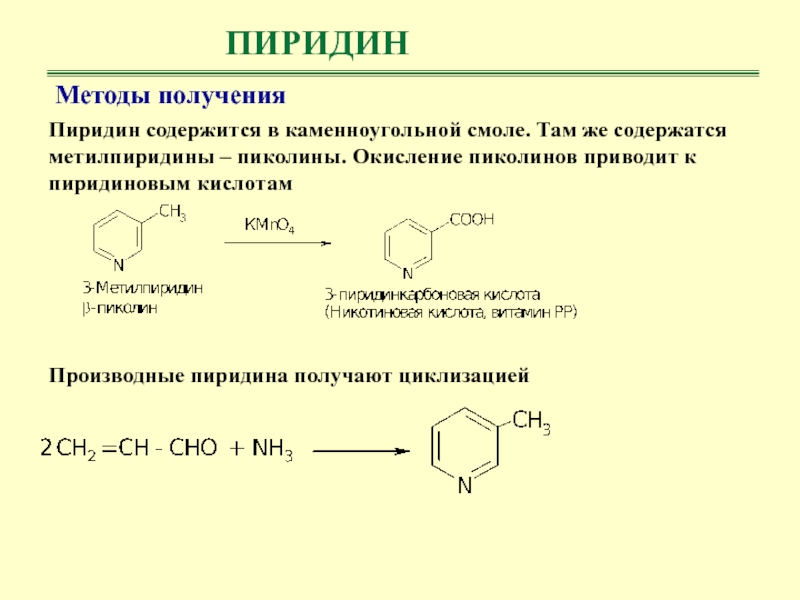
Методы получения
Пиридин содержится в каменноугольной смоле. Там же содержатся
метилпиридины – пиколины. Окисление пиколинов приводит к пиридиновым кислотам
Производные
пиридина получают циклизацией
Слайд 40
ХИНОЛИН
Хинолин представляет собой конденсированную систему, содержащую бензольное и пиридиновое кольца
Свойства хинолина соответствуют свойствам нафталина, содержащего электроноакцепторную группу в положении
1 Слайд 41
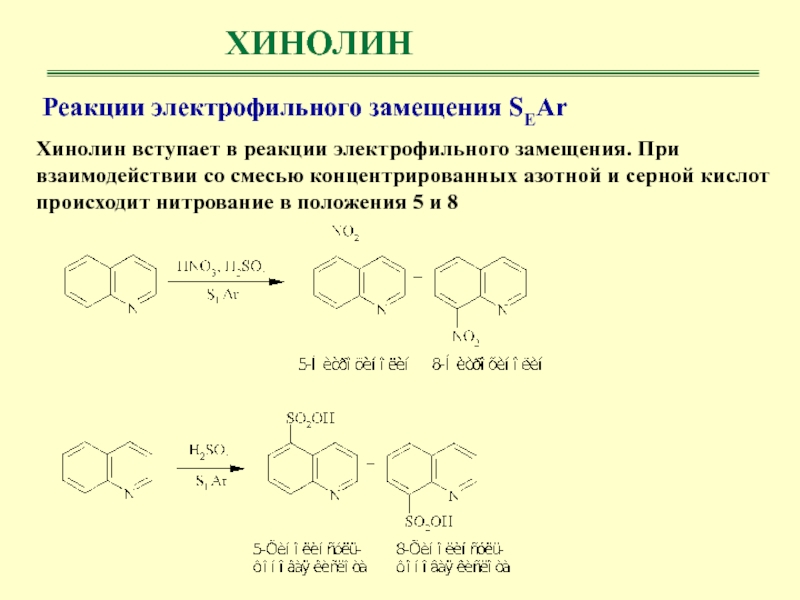
ХИНОЛИН
Хинолин вступает в реакции электрофильного замещения. При взаимодействии со смесью
концентрированных азотной и серной кислот происходит нитрование в положения 5
и 8Реакции электрофильного замещения SEAr
Слайд 42
ХИНОЛИН
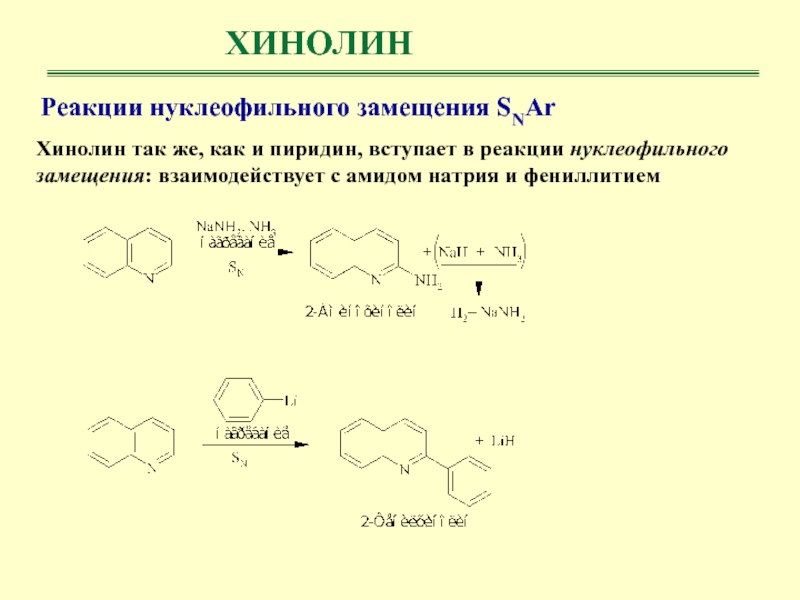
Реакции нуклеофильного замещения SNAr
Хинолин так же, как и пиридин,
вступает в реакции нуклеофильного замещения: взаимодействует с амидом натрия и
фениллитием
Слайд 44
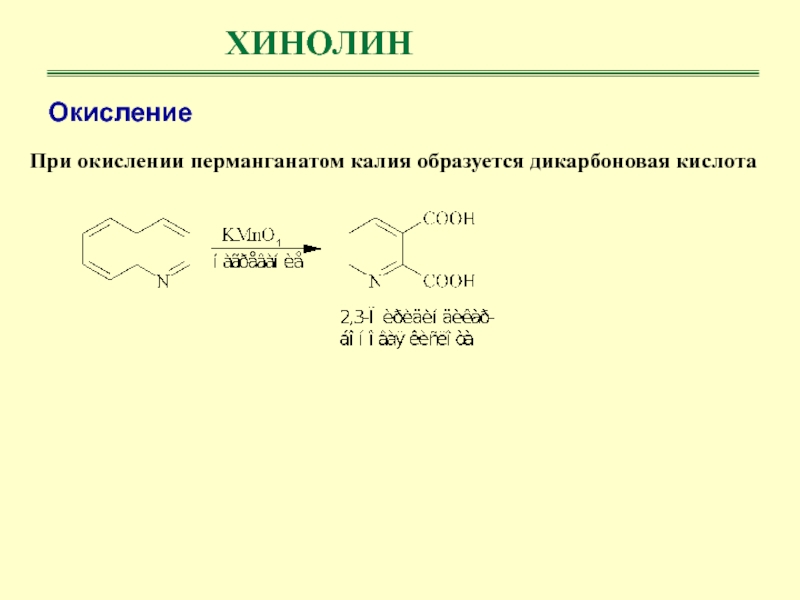
ХИНОЛИН
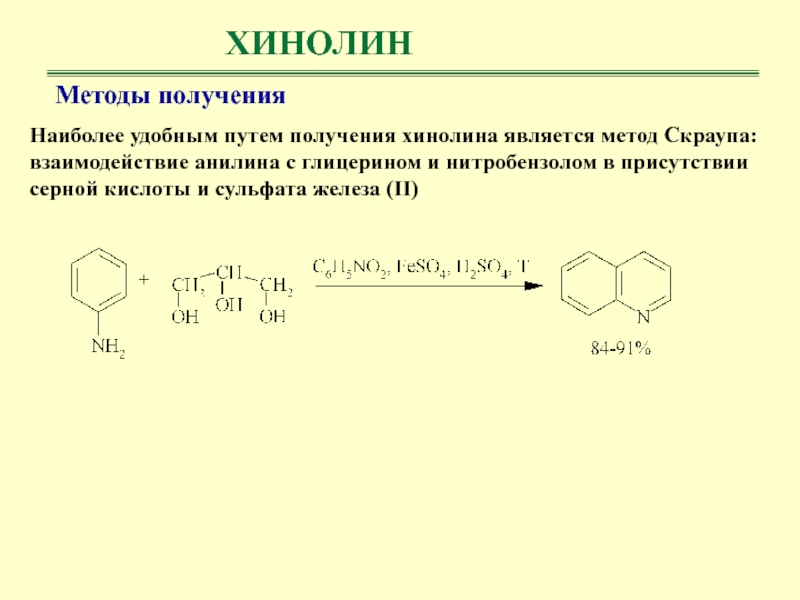
Наиболее удобным путем получения хинолина является метод Скраупа: взаимодействие анилина
с глицерином и нитробензолом в присутствии серной кислоты и сульфата
железа (II)Методы получения
Слайд 45
ХИНОЛИН
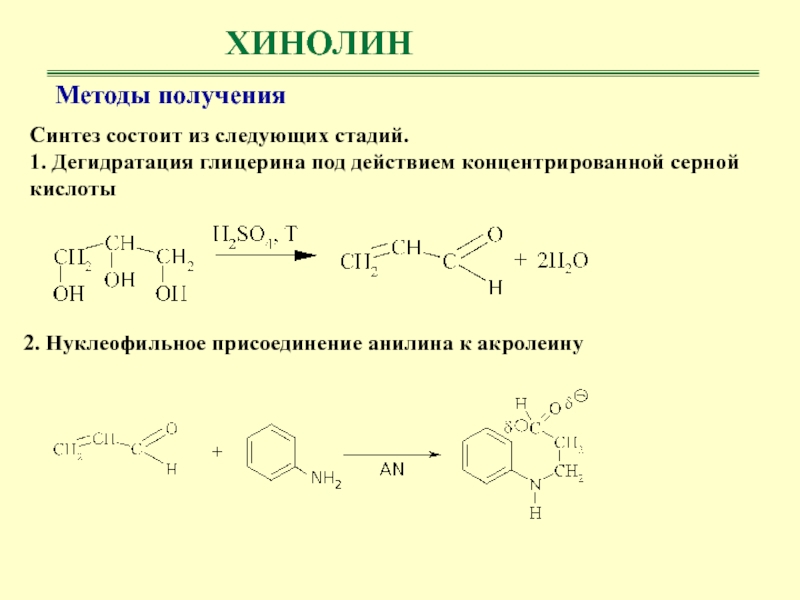
Методы получения
Синтез состоит из следующих стадий.
1. Дегидратация глицерина под
действием концентрированной серной кислоты
2. Нуклеофильное присоединение анилина к акролеину