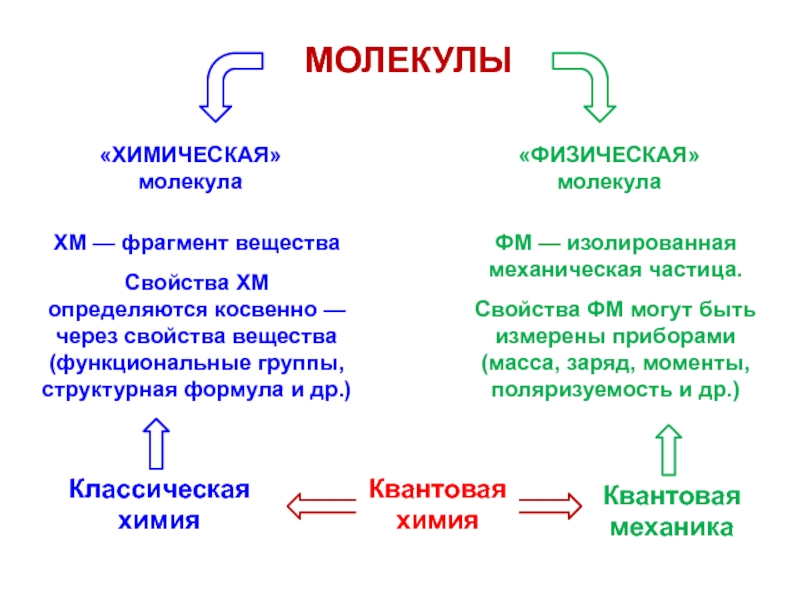
Слайд 1МОЛЕКУЛЫ
ХМ — фрагмент вещества
Свойства ХМ определяются косвенно — через свойства
вещества (функциональные группы, структурная формула и др.)
ФМ — изолированная
механическая частица.
Свойства ФМ могут быть измерены приборами
(масса, заряд, моменты, поляризуемость и др.)
Квантовая химия
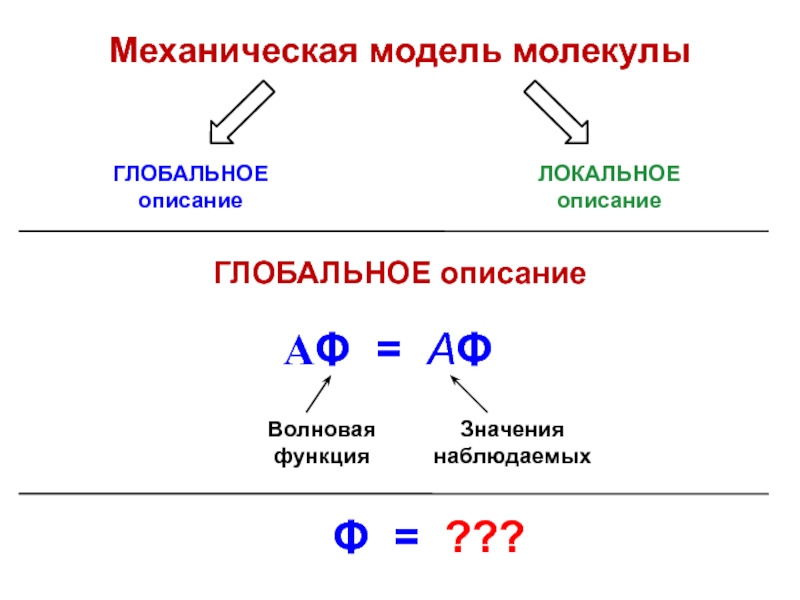
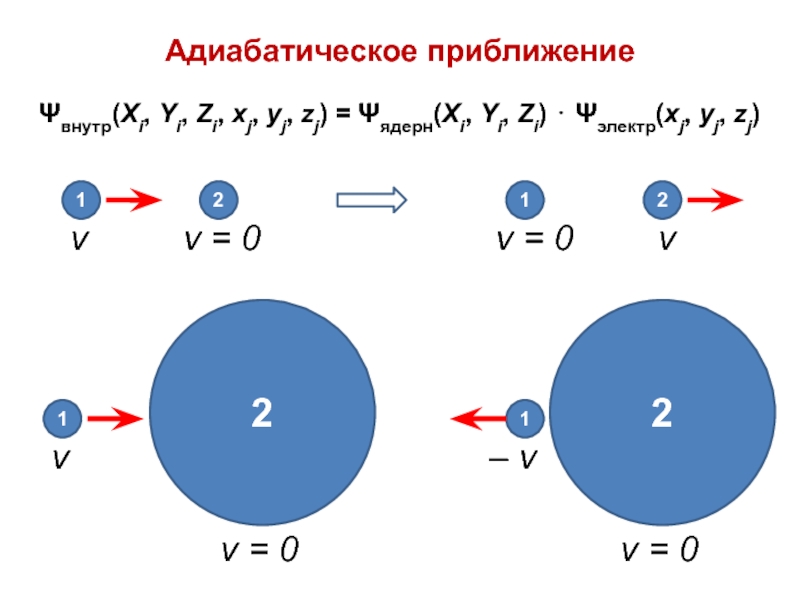
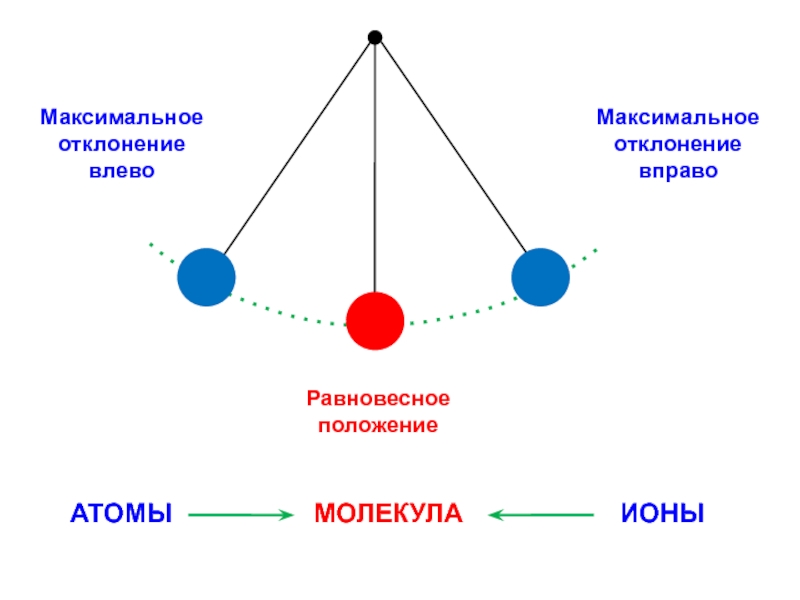
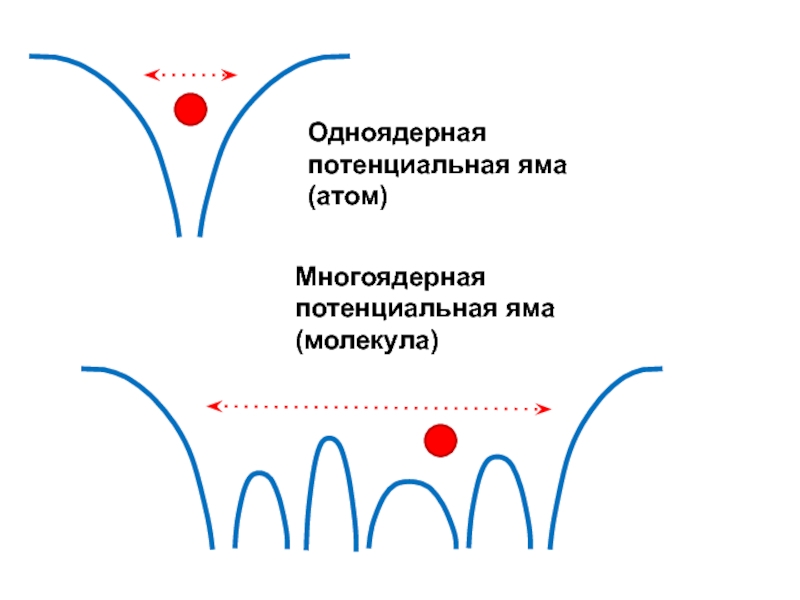
Слайд 2Механическая модель молекулы
Слайд 3Волновая функция стационарного состояния
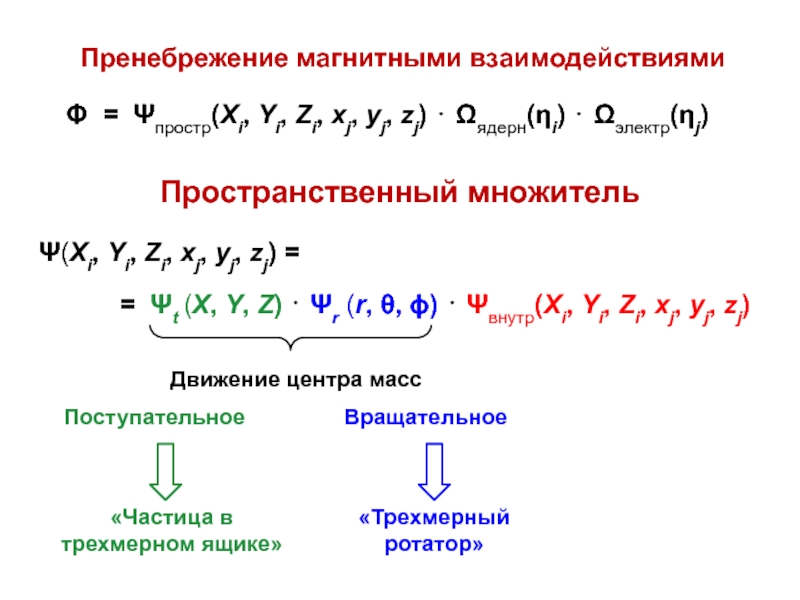
Слайд 4Пренебрежение магнитными взаимодействиями
Пространственный множитель
Слайд 6Ψядерн(Xi, Yi, Zi) = ψ1(ξ1) ⋅ ψ2(ξ2) ⋅ …. ⋅
ψ3N–6(ξ3N–6)
Гармоническое приближение
Ψэлектр(xj, yj, zj) = ???
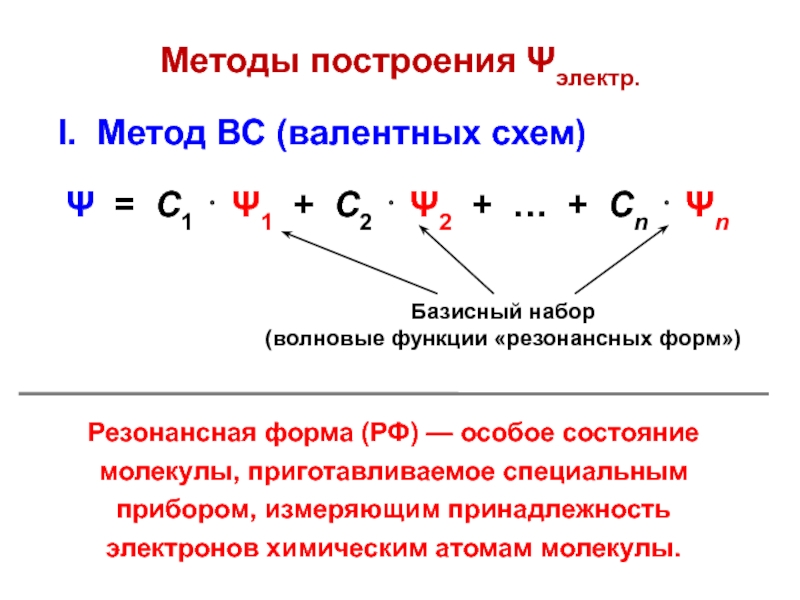
Слайд 7Методы построения Ψэлектр.
I. Метод ВС (валентных схем)
Ψ = С1
⋅ Ψ1 + С2 ⋅ Ψ2 + … + Сn
⋅ Ψn
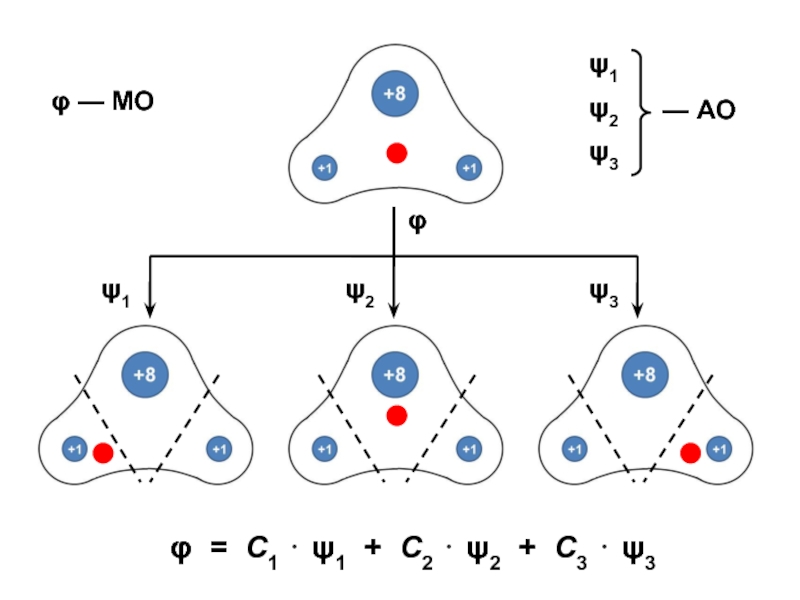
Слайд 8К какому «атому» принадлежит каждый из 10 электронов?
Слайд 9Ψ = С1 ⋅ Ψ1 + С2 ⋅ Ψ2 +
… + Сn ⋅ Ψn
Слайд 10Построение волновой функции молекулы в методе ВС
1) определение набора РФ
(всех возможных способов распределения электронов молекулы по «атомам»);
2) составление для
каждого «атома» атомной волновой функции и ее оптимизация, например, методом самосогласованного поля Хартри-Фока;
3) построение волновых функций РФ в виде произведений атомных волновых функций;
4) составление линейной комбинации общего вида из волновых функций РФ;
5) оптимизация набора коэффициентов (С1, С2, ..., Cn) построенной линейной комбинации.
Слайд 11Проблема оптимизации коэффициентов
1) Волновая функция молекулы должна удовлетворять требованиям симметрии.
а) перестановочная симметрия (принцип Паули) — волновая функция должна быть
антисимметричной, относительно перестановки местами двух любых электронов:
Ф(1, 2, …, i, j, …, n) = – Ф(1, 2, …, j, i, …, n)
В частности, все слагаемые, входящие в волновую функцию должны быть либо антисимметричными, либо образовывать с другими слагаемыми антисимметричные комбинации.
б) пространственная симметрия — волновая функция должна принадлежать одному из неприводимых представлений (типов симметрии) ТГС, т.е. быть собственной для операторов симметрии, входящих в ТГС.
Ф ∈ НП ТГС или F Ф = (±1)Ф
Слайд 122) Абсолютная величина коэффициентов при базисных волновых функциях конкретных РФ
зависит от их энергий:
чем выше энергия РФ, тем меньший
вклад в молекулярную волновую функцию она вносит. Например, энергии РФ, составленных из «ионов», существенно выше энергии РФ, составленных из нейтральных «атомов». Это обстоятельство, в большинстве случаев, позволяет не рассматривать полный набор РФ, а ограничиться небольшим их числом, т.е. включать в линейную комбинацию только те РФ, энергии которых заметно ниже остальных.
3) Волновая функция должна быть нормированной.
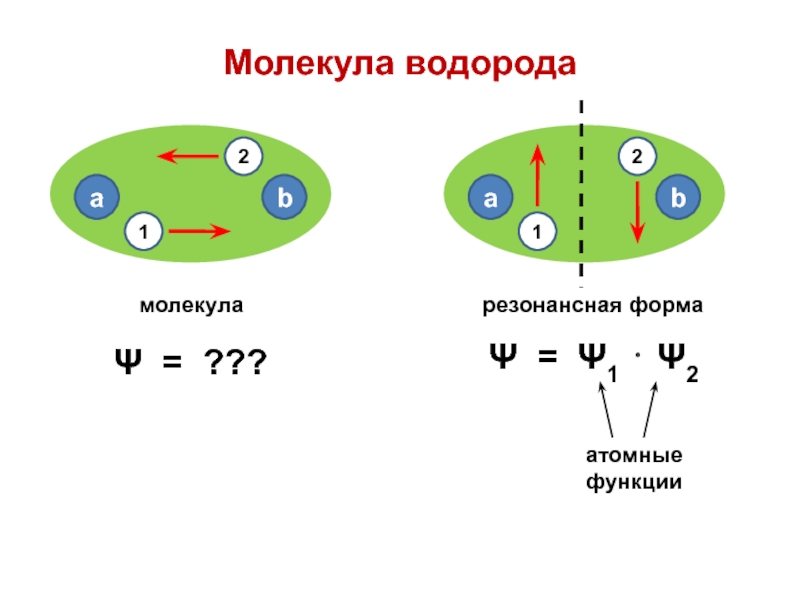
Слайд 13Молекула водорода
Ψ = ???
Ψ = Ψ1 ⋅ Ψ2
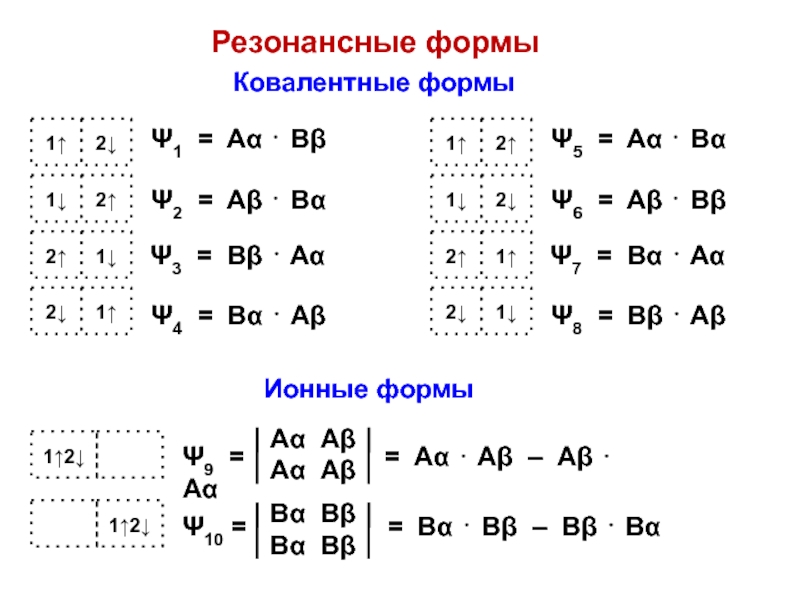
Слайд 15Резонансные формы
Ионные формы
Ковалентные формы
Слайд 16Волновые функции резонансных форм
Ψ1 = Aα ⋅ Bβ = AB
⋅ αβ
Ψ9 = Aα ⋅ Aβ – Aβ ⋅
Aα = AA[αβ – βα]
Ψ10 = Bα ⋅ Bβ – Bβ ⋅ Bα = BB[αβ – βα]
Ψ = С1 ⋅ Ψ1 + С2 ⋅ Ψ2 + … + С10 ⋅ Ψ10
Слайд 17Φ = С1 ⋅ Ψ1 + С2 ⋅ Ψ2 +
… + С10 ⋅ Ψ10
1) требование антисимметричности: Φ(ij) =
– Φ(ji)
2) требование пространственной симметрии: Φ ⊂ НП
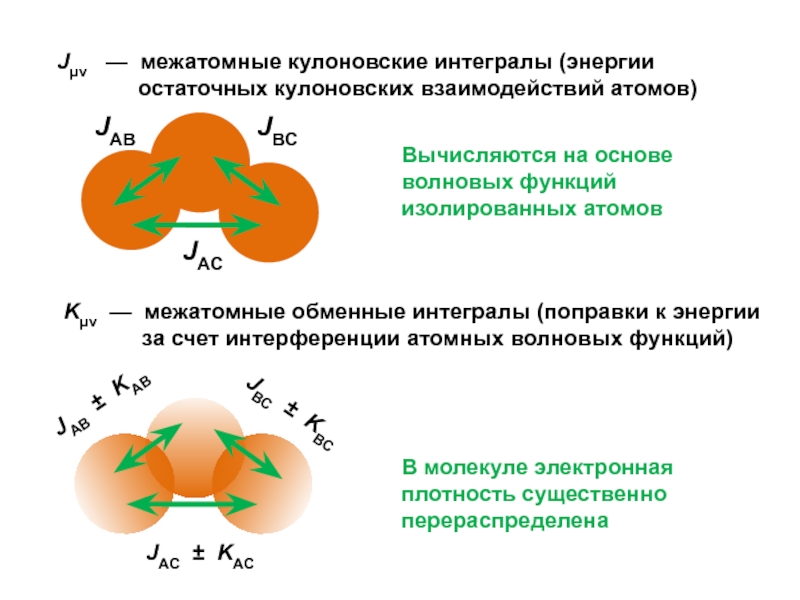
Слайд 19 Еk — полная энергия изолированного атома с номером k
Е = ∑ Еk + ½ ∑∑ ( Jμν ±
Kμν )
Одноатомные энергии ( Еk )
Еk = ∑Hi + ∑∑(Jij ± Kij) ( i < j )
Hi — остовные интегралы,
Jij и Kij — внутриатомные межэлектронные кулоновские и обменные интегралы.
Слайд 20Kμν — межатомные обменные интегралы (поправки к энергии за счет
интерференции атомных волновых функций)
Jμν — межатомные кулоновские интегралы
(энергии остаточных кулоновских взаимодействий атомов)
В молекуле электронная плотность существенно перераспределена
Вычисляются на основе волновых функций изолированных атомов
Слайд 21Молекула водорода
( s — интеграл перекрывания )
Слайд 24ВЫВОД
В основе метода ВС лежит структурная модель, заимствованная из классической
теории химического строения, согласно которой молекула представляет собой результат химического
взаимодействия атомов, смысл которого состоит в обобществлении электронов.
Поэтому метод ВС позволяет сопоставить вводимые в его рамках поправки на межатомное взаимодействие (Jμν — межатомные кулоновские интегралы и Kμν — межатомные обменные интегралы) химическим связям. Это позволяет получать в квантовой химии некоторые количественные оценки таких характеристик химических связей, как длины, энергии диссоциации и др.
Слайд 25Теория резонанса
В отличие от полного метода ВС, в теории
резонанса учитывают не все базисные функции (резонансные формы), а только
их небольшое число.
Ψмолекулы = С1Ψ1 + С2Ψ2 + ... + СnΨn
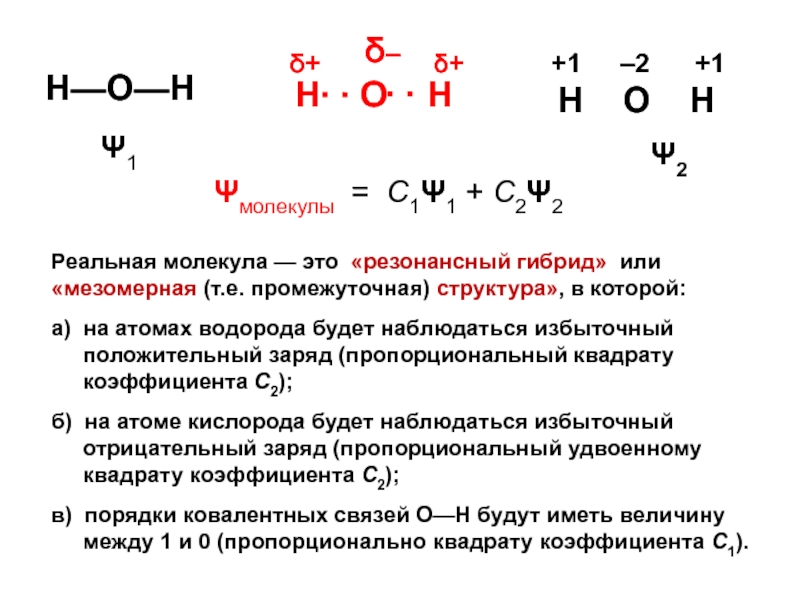
Слайд 26Н—О—Н
Ψмолекулы = С1Ψ1 + С2Ψ2
Реальная молекула — это «резонансный
гибрид» или «мезомерная (т.е. промежуточная) структура», в которой:
а) на атомах
водорода будет наблюдаться избыточный положительный заряд (пропорциональный квадрату коэффициента С2);
б) на атоме кислорода будет наблюдаться избыточный отрицательный заряд (пропорциональный удвоенному квадрату коэффициента С2);
в) порядки ковалентных связей О—Н будут иметь величину между 1 и 0 (пропорционально квадрату коэффициента С1).
Слайд 29II. Метод МО (молекулярных орбиталей)
Молекула — деформированный атом
Слайд 31Электронная оболочка молекулы в методе МО
Слайд 32Одноэлектронное приближение
Каждому электрону приписывается:
индивидуальная функция — «молекулярная орбиталь» (МО)
φi
(xi, yi, zi, ηi)
набор одноэлектронных наблюдаемых
εi ji
i si
φi (xi, yi, zi, ηi) = ψi (xi, yi, zi) ⋅ χi (ηi)
Слайд 33Глобальная волновая функция молекулы
Каков явный вид МО?
Слайд 35φ = С1 ⋅ ψ1 + С2 ⋅ ψ2 +
С3 ⋅ ψ3
φ — МО
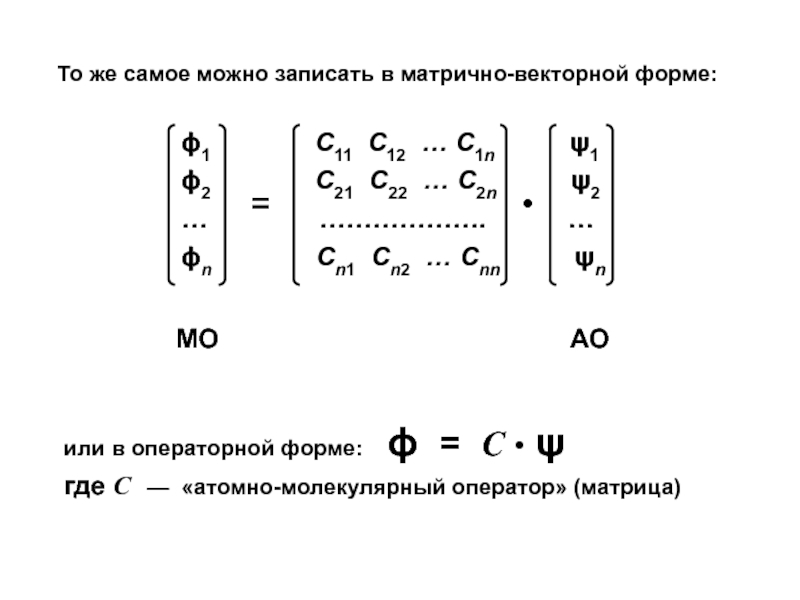
Слайд 36Определение коэффициентов разложения Сij
(матричных элементов атомно-молекулярного оператора С )
Слайд 37Оставшеся после учета симметрии молекулы коэффициенты Сij определяются посредством процедуры
самосогласования:
Е = min
Для этого:
1) выбирают электронную конфигурацию,
2) выражают каждую занятую
МО в виде ЛКАО,
выражают полную энергию через молекулярные орбитали, в результате чего она получается в виде функции от коэффициентов
Е = f (Сij)
Слайд 38дифференцируют функцию Е = f (Сij) по коэффициентам и приравнивают
производные к нулю:
∂Е / ∂Сij = 0
Уравнения Хартри-Фока-Рутана
Слайд 39Уравнения Хартри-Фока-Рутана
Fμν — матричные элементы оператора Фока, характеризующие либо
энергию электрона в изолированном атоме с номером μ (при μ
= ν), либо изменение энергии электрона при его обобществлении двумя атомами с номерами μ и ν (при μ ≠ ν),
Sμν — интегралы перекрывания для базисных АО с номерами μ и ν,
ε — энергия МО с коэффициентами {Сα Сβ … Сn }.
Слайд 41 { Cij }о → { Fμν, Sμν
}о → ХФР → { εi }o →
→
{ Cij }1 → { Fμν, Sμν }1 → ХФР → { εi }1 →
→ { Cij }2 → { Fμν, Sμν }2 → ХФР → { εi }2 →
→ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . →
→ { Cij }m → { Fμν, Sμν }m → ХФР → { εi }m →
→ { Cij }* → { Fμν, Sμν }* → ХФР → { εi }*
Итерационная процедура
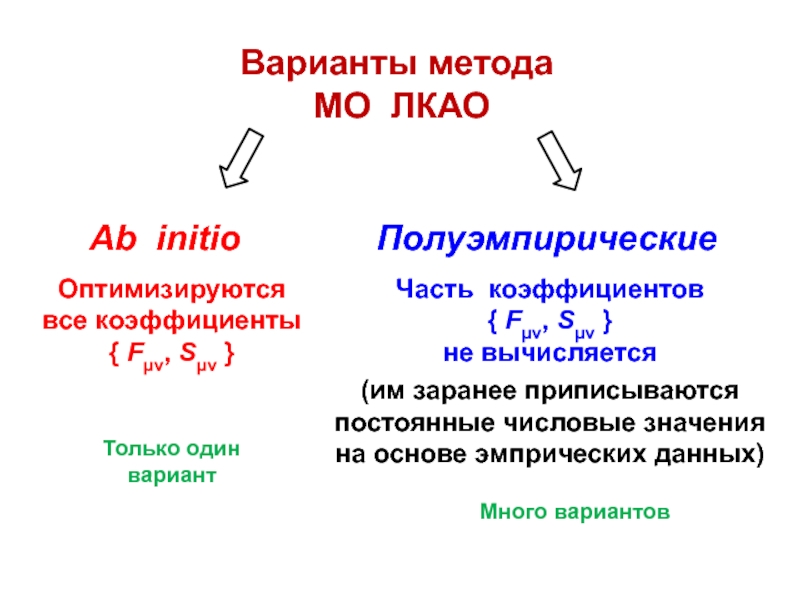
Слайд 42Варианты метода
МО ЛКАО
Оптимизируются все коэффициенты
{ Fμν, Sμν }
Часть
коэффициентов
{ Fμν, Sμν }
не вычисляется
(им заранее приписываются постоянные числовые значения на основе эмпрических данных)
Только один вариант
Много вариантов
Слайд 43Полная энергия молекулы
Остовный интеграл — это энергия одноэлектронной молекулы, содержащего
i-й электрон в состоянии φi
(такую энергию имел бы
i-й электрон при отсутствии межэлектронного отталкивания)
Слайд 45εi* = Hi + ∑ Jij ± ∑ Kij
Орбитальные
энергии
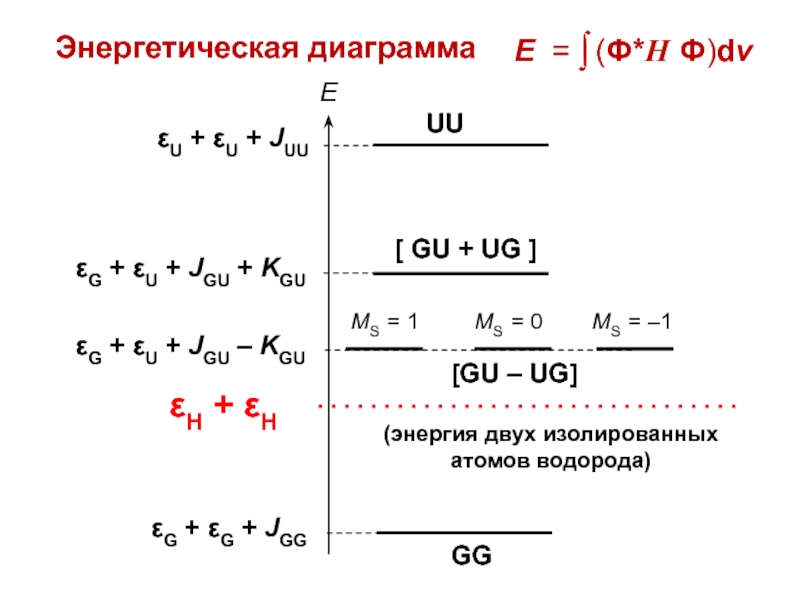
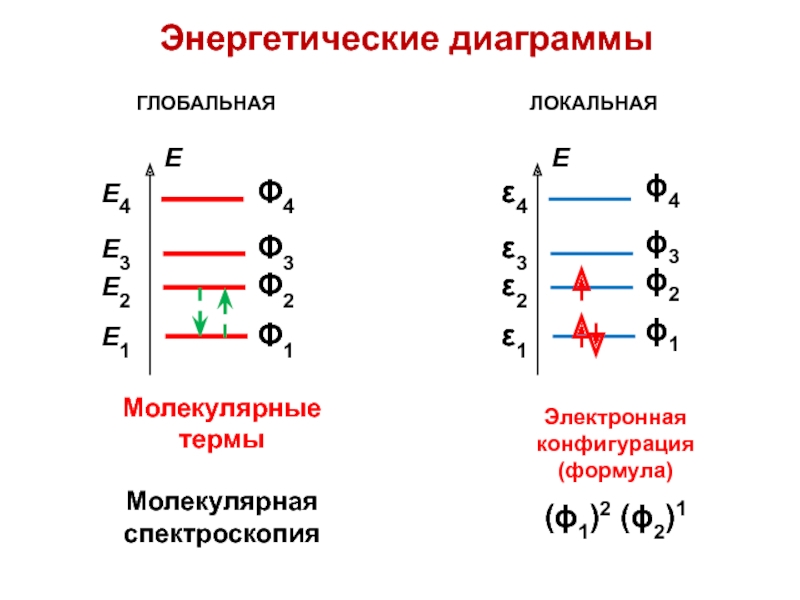
Слайд 46Энергетические диаграммы
Молекулярные термы
Молекулярная спектроскопия
ГЛОБАЛЬНАЯ
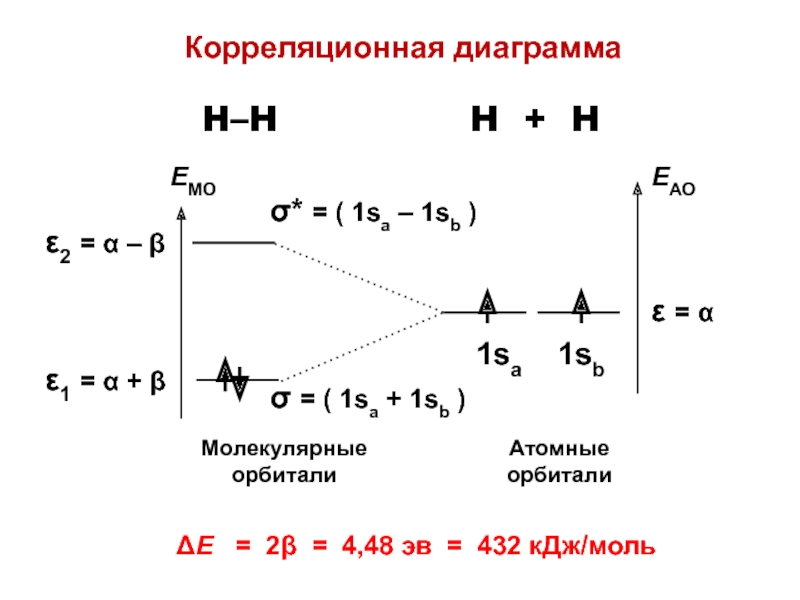
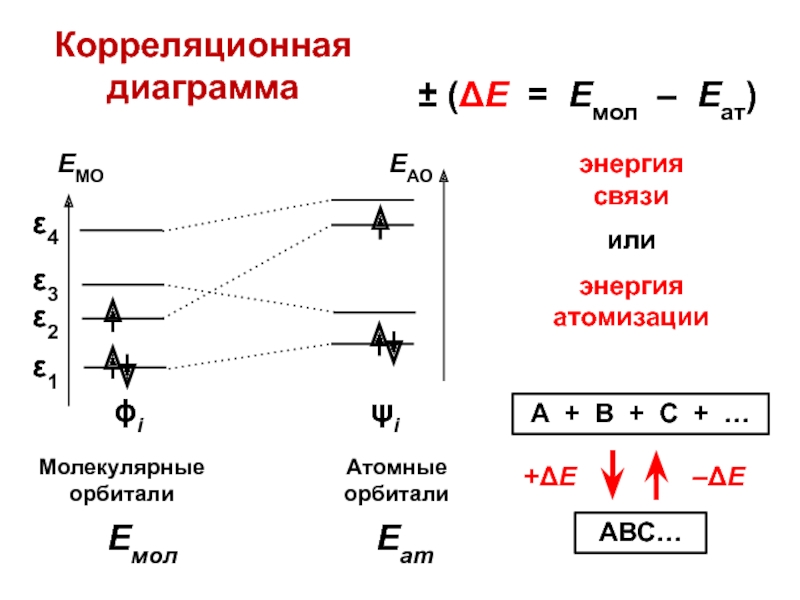
Слайд 47Корреляционная диаграмма
энергия связи
или
энергия атомизации
± (ΔЕ = Емол –
Еат)
Слайд 48Молекула водорода в методе МО
φ1 = С11ψ1 + С12ψ2
φ2
= С21ψ1 + С22ψ2
Слайд 49Атомный базис
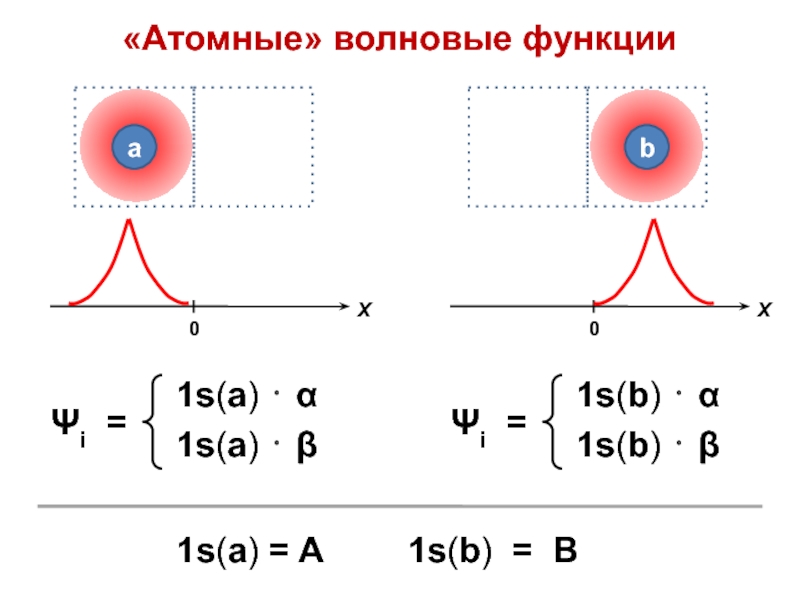
φ1 = С11ψ1 + С12ψ2
Ψ1 = 1s(a) =
A
ψ2 = 1s(b) = B
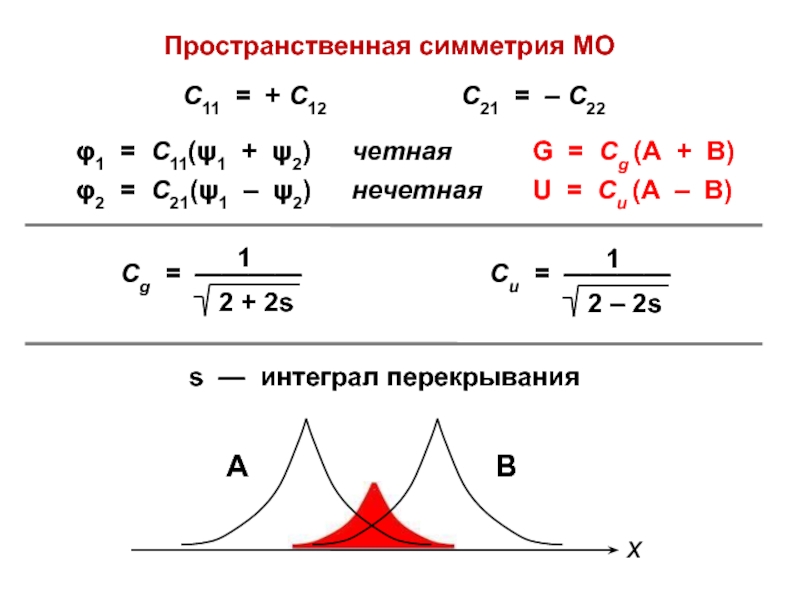
Слайд 50Пространственная симметрия МО
С11 = + С12
С21 = – С22
φ1 = С11(ψ1
+ ψ2)
φ2 = С21(ψ1 – ψ2)
G = Сg (А + В)
U = Сu (А – В)
четная
нечетная
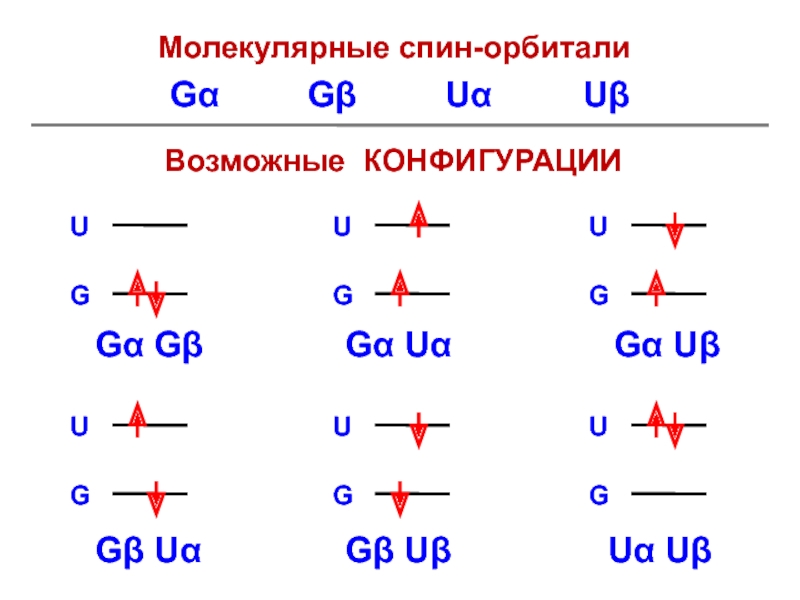
Слайд 52Глобальные волновые функции
Gα Gβ
Фg = GG [αβ – βα]
Фu
= { GU – UG } [C1(αβ) + C2(αβ +
βα) + C3(βα)]
Ф'u = { GU + UG } [ αβ – βα ]
Ф'g = UU [αβ – βα]
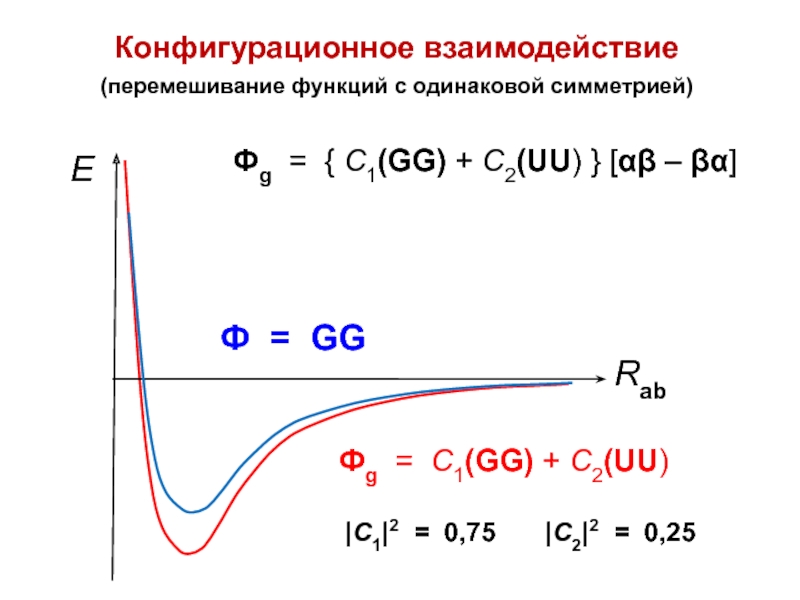
Слайд 54Полученный результат можно улучшить, если использовать МНОГОДЕТЕРМИНАНТНЫЕ волновые функции, каждая
из которых соответствует своей электронной конфигурации:
метод «конфигурационного взаимодействия» —
МО-КВ
Слайд 55
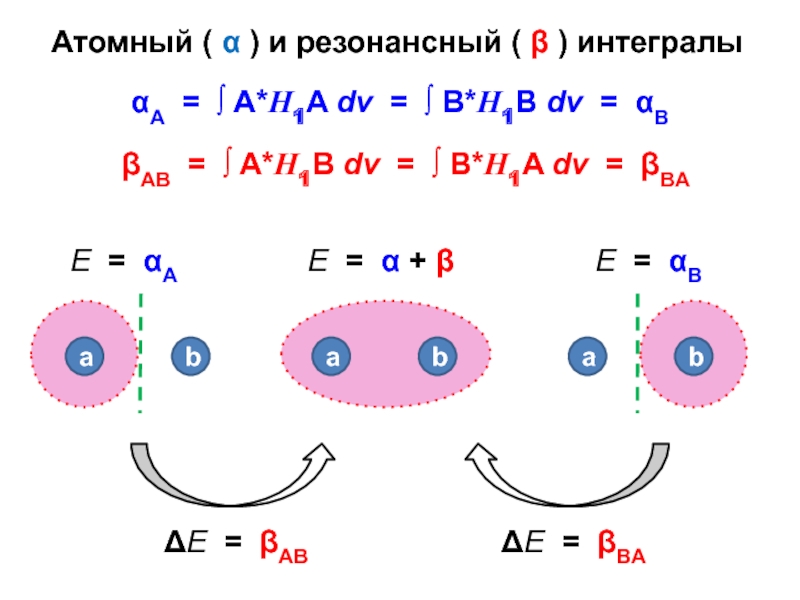
Остовные энергии МО
εG = ∫ G*Н1G dv = (CG)2 ∫
(A + B)*Н1(A + B) dv =
=
(CG)2 ∫ A*Н1A dv + ∫ A*Н1B dv +
+ ∫ B*Н1A dv + ∫ B*Н1B dv =
= (CG)2 ( α + β + β + α )
α < 0
β < 0
Слайд 56Атомный ( α ) и резонансный ( β ) интегралы
Слайд 57Корреляционная диаграмма
ΔЕ = 2β = 4,48 эв = 432
кДж/моль
Слайд 58Конфигурационное взаимодействие
(перемешивание функций с одинаковой симметрией)
|C1|2 = 0,75
|C2|2 =
0,25
U = A
– B
G = (1s)a + (1s)b U = (1s)a – (1s)b
G = (1s*)a + (1s*)b U = (1s*)a – (1s*)b
МО:
МО-КВ
Слайд 60Уравнения ХФР «Канонические
МО» (КМО)
Каждая КМО распространяется на всю молекулу в целом,
что отражает тот факт, что любой электрон молекулы может быть найден в любой точке внутри молекулярного объема.
Узловая структура — совокупность узловых поверхностей, разделяющих объем молекулы на части.
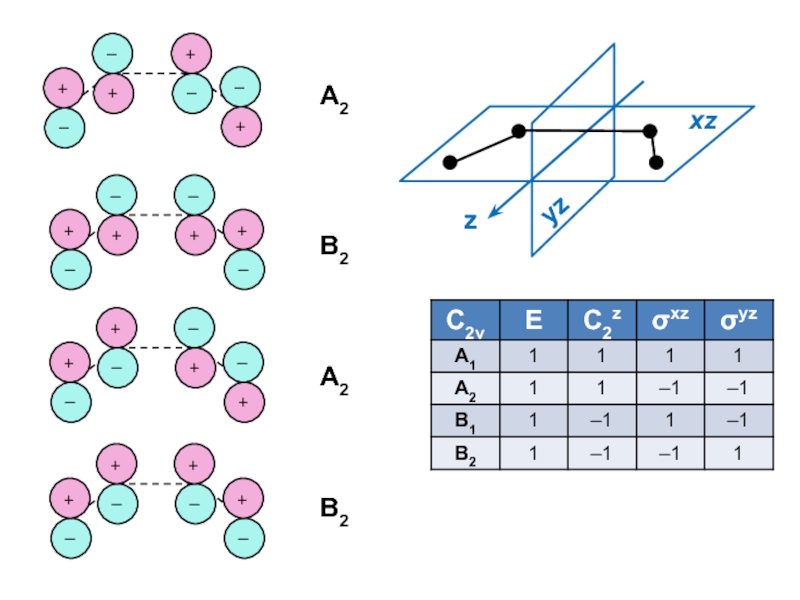
Пространственная симметрия — неприводимое представление (тип симметрии) точечной группы молекулы (например, все КМО молекулы воды должны иметь один из четырех типов симметрии группы С2v)
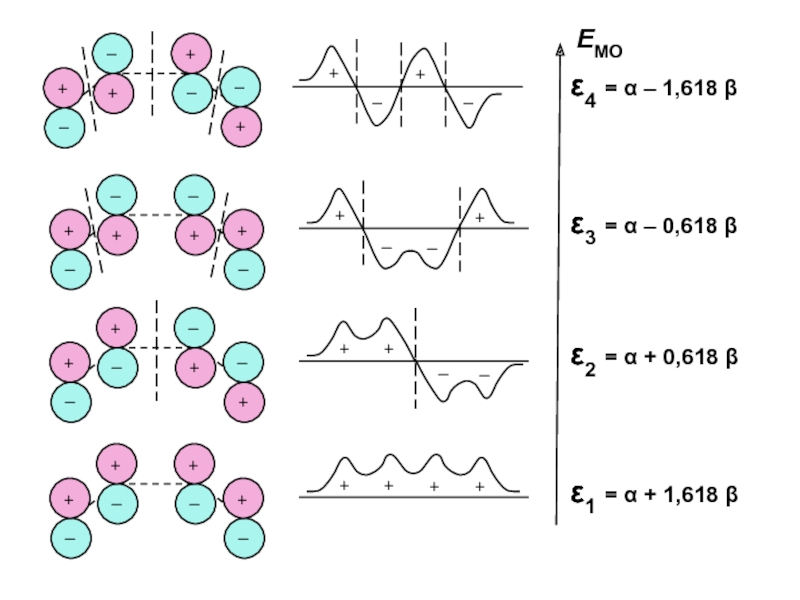
Слайд 61Пример: бутадиен H2C=CH–CH=CH2
πi = Ci1 (2pz)1 + Ci2 (2pz)2
+ Ci3 (2pz)3 + Ci4 (2pz)4
Слайд 64
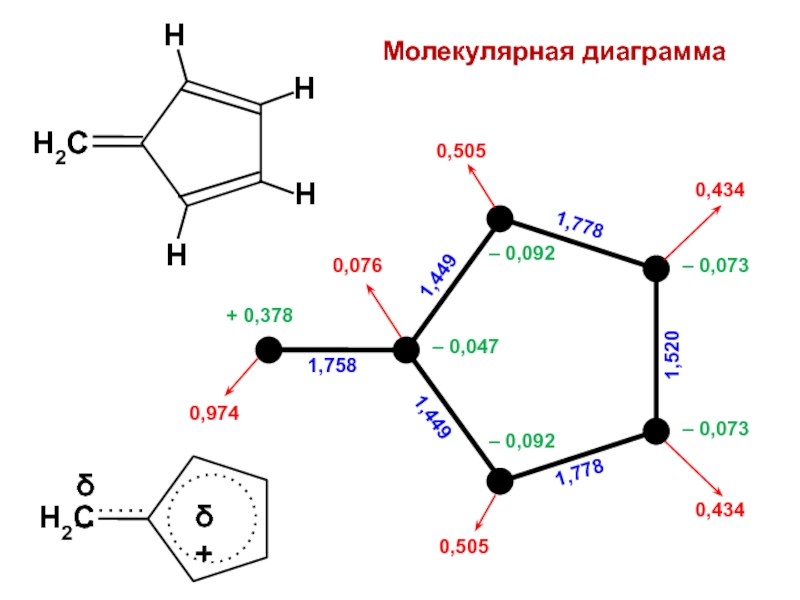
Локальные характеристики молекул
Слайд 65(Сik)2 = Рik
( вероятность нахождения электрона с номером i
в окрестности атома с номером k, или, другими словами, электронная
плотность на атоме с номером k, создаваемая электроном с номером i )
iΣ(Сik)2 = Nk
(электронная плотность на атоме с номером k, создаваемая всеми электронами молекулы или среднее число электронов, принадлежащих этому атому )
Nk = –Qk
(электрический заряд той доли электронной оболочки, которая входит в состав атома с номером k )
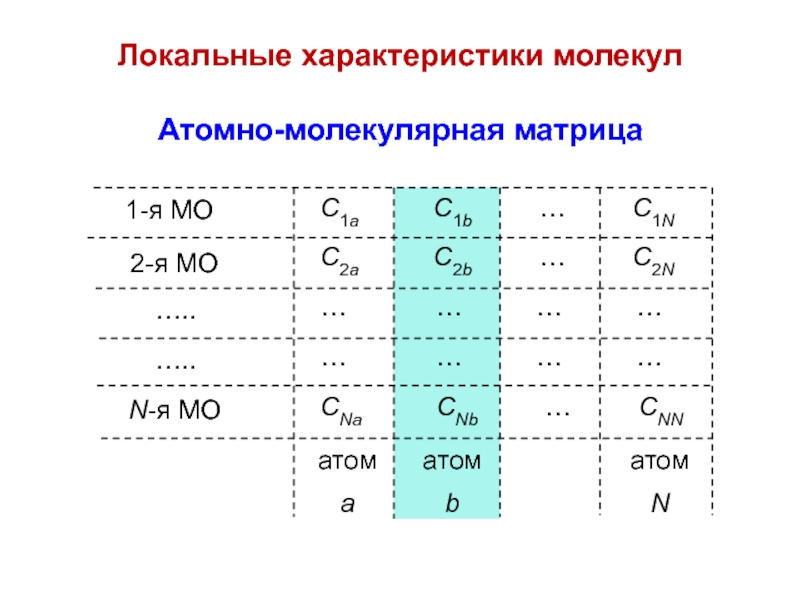
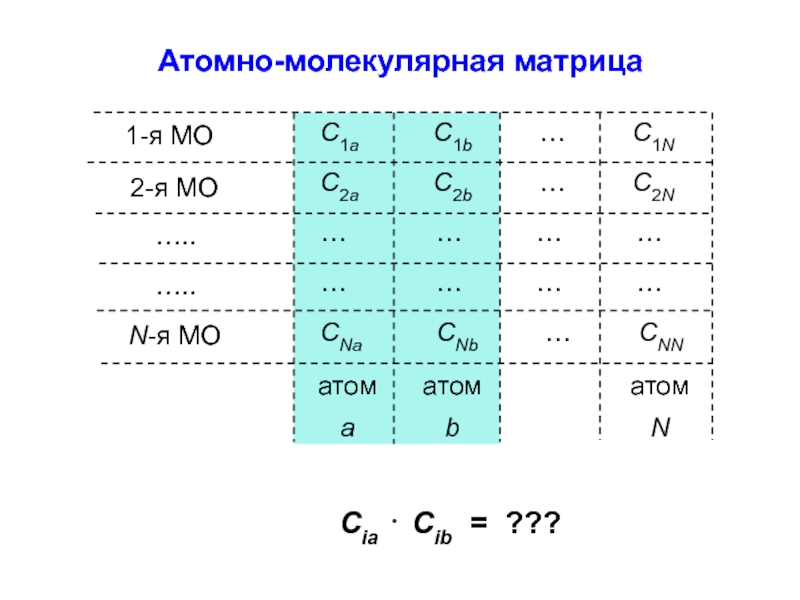
Слайд 68
Атомно-молекулярная матрица
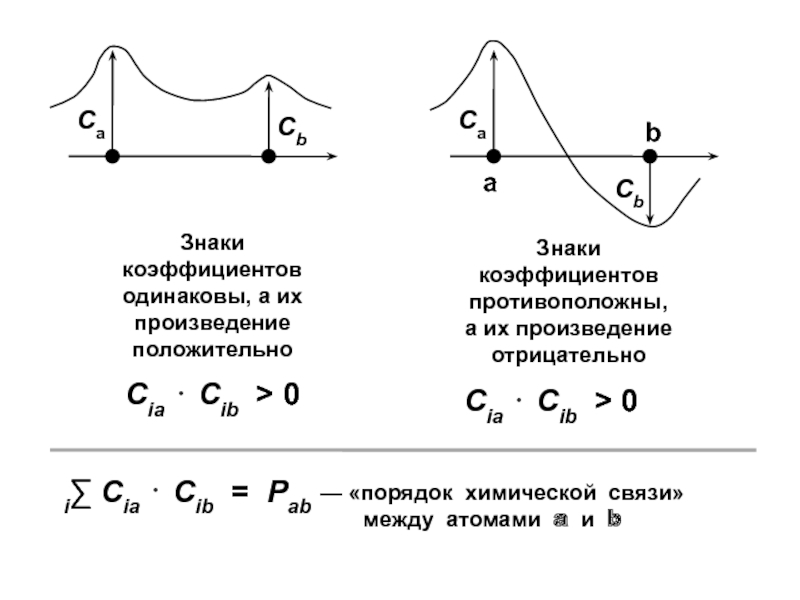
Cia ⋅ Cib = ???
Слайд 69i∑ Cia ⋅ Cib = Pab
— «порядок химической связи»
между атомами a и b
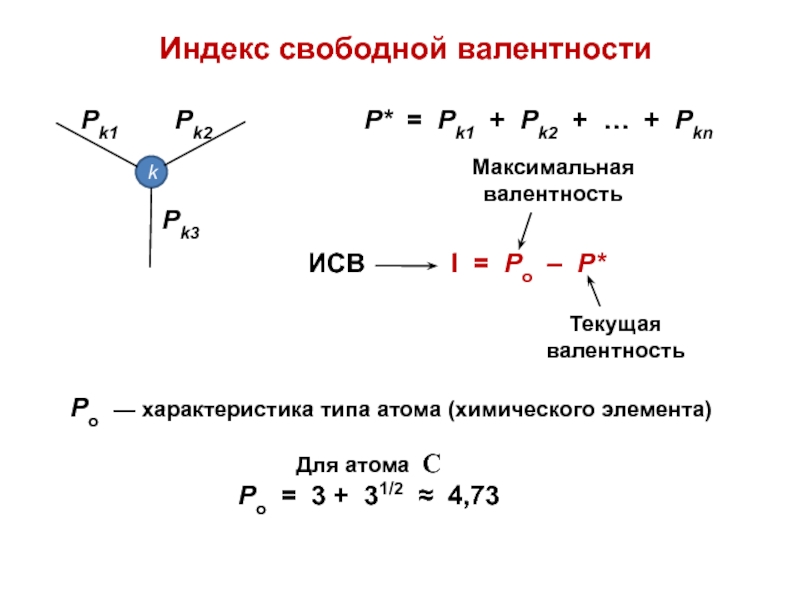
Слайд 70Индекс свободной валентности
P* = Pk1 + Pk2 + … +
Pkn
I = Po – P*
Po — характеристика типа атома (химического
элемента)
Для атома С
Ро = 3 + 31/2 ≈ 4,73
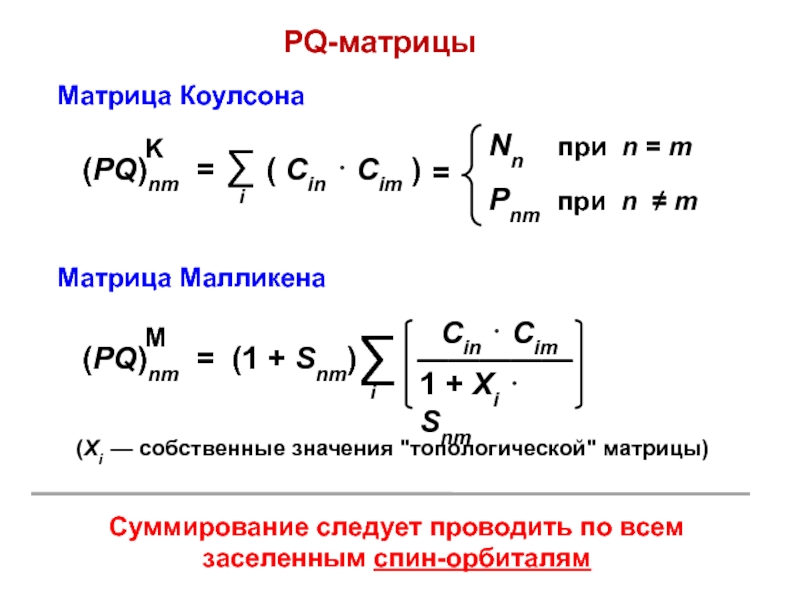
Слайд 72PQ-матрицы
Матрица Коулсона
Суммирование следует проводить по всем заселенным спин-орбиталям
(Xi — собственные
значения "топологической" матрицы)
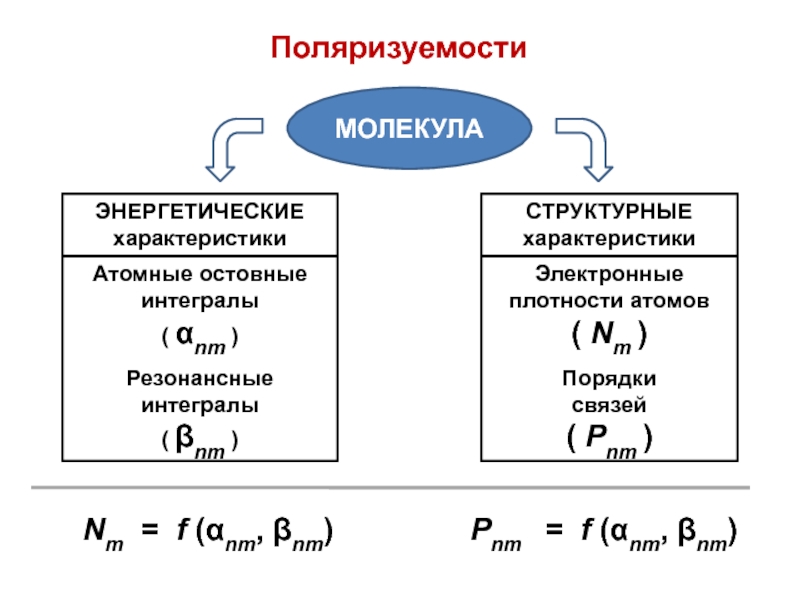
Слайд 73Поляризуемости
МОЛЕКУЛА
Атомные остовные
интегралы
( αnm )
Резонансные интегралы
( βnm )
Электронные плотности
атомов ( Nm )
Порядки
связей
( Рnm
)
Nm = f (αnm, βnm)
Рnm = f (αnm, βnm)
Слайд 75Возмущения атомов
αr → αr + δα r
πs,
r — поляризуемость «атом – атом» (показывает, насколько электронная плотность
на атоме s чувствительна к возмущениям остовного интеграла атома r.
πst, r — поляризуемость «связь – атом» (показывает, насколько электронная плотность между атомами s и t (т.е. порядок связи Pst) чувствительна к возмущениям остовного интеграла атома r.
Слайд 76Возмущения связей
πt, rs — поляризуемость «атом – связь» (показывает,
насколько электронная плотность на атоме s чувствительна к возмущениям резонансного
интеграла пары атомов r и s.
πtu, rs — поляризуемость «связь – связь» (показывает, насколько электронная плотность между атомами t и u (т.е. порядок связи Ptu) чувствительна к возмущениям резонансного интеграла пары атомов r и s.
βrs → βrs + δβrs
Слайд 77Зная величины поляризуемостей, можно легко и надежно решать ряд химических
задач:
1) предсказывать результат внешнего возмущения в виде изменений в зарядах
атомов и порядках связей, а, следовательно, и в реакционной способности молекулы:
2) анализировать закономерности в изменения свойств в рядах аналогичных по строению молекул.
Все поляризуемости могут быть вычислены через коэффициенты МО:
π = f (Cij)
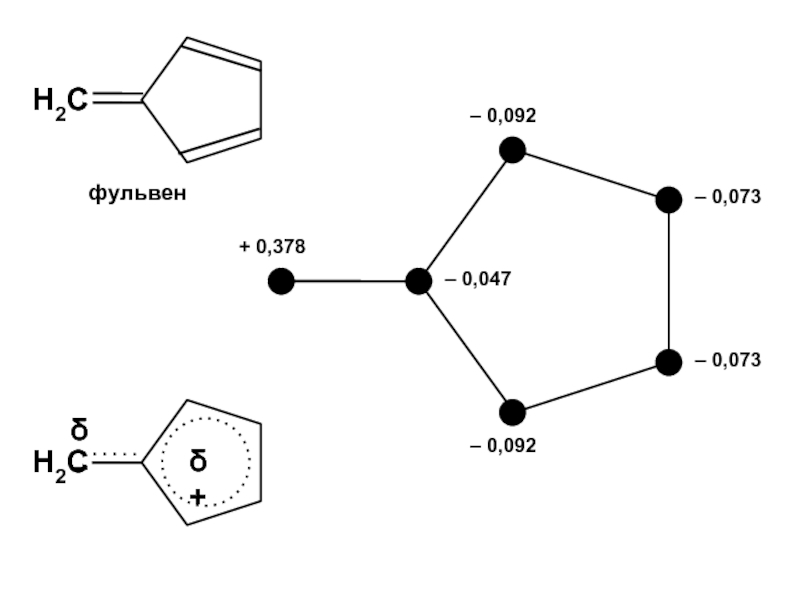
Слайд 78Индексы реакционной способности (ИРС)
Ni Pij
Ik π
































![Молекулы Глобальные волновые функцииGα GβФg = GG [αβ – βα] Фu = Глобальные волновые функцииGα GβФg = GG [αβ – βα] Фu = { GU – UG } [C1(αβ)](/img/thumbs/425b08be6ba209471830fc53e294f6f7-800x.jpg)