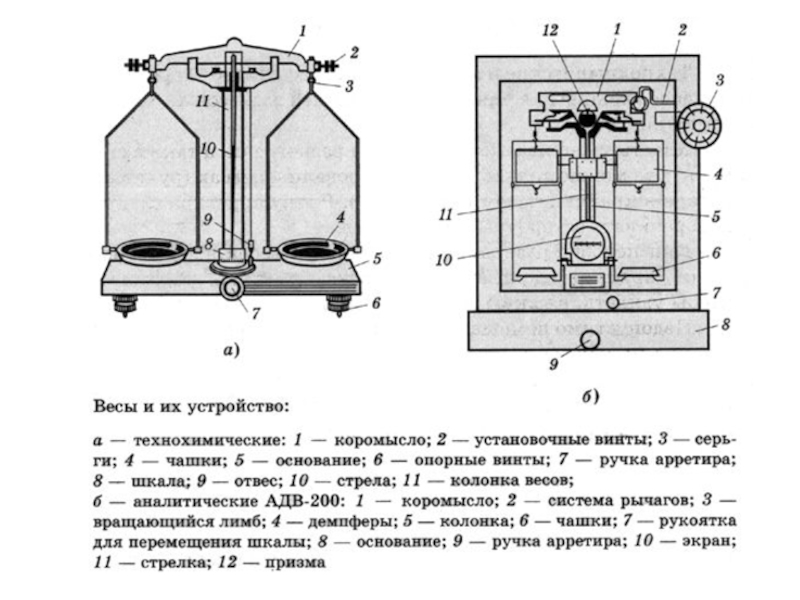
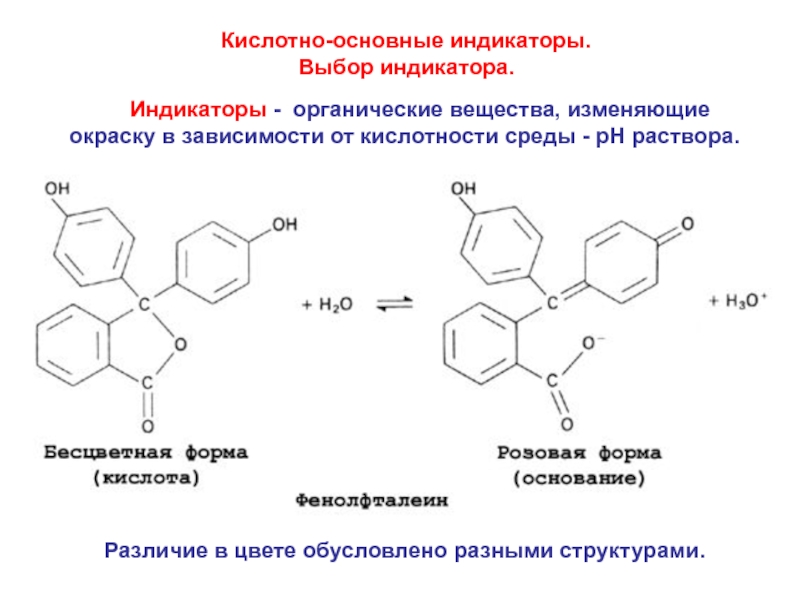
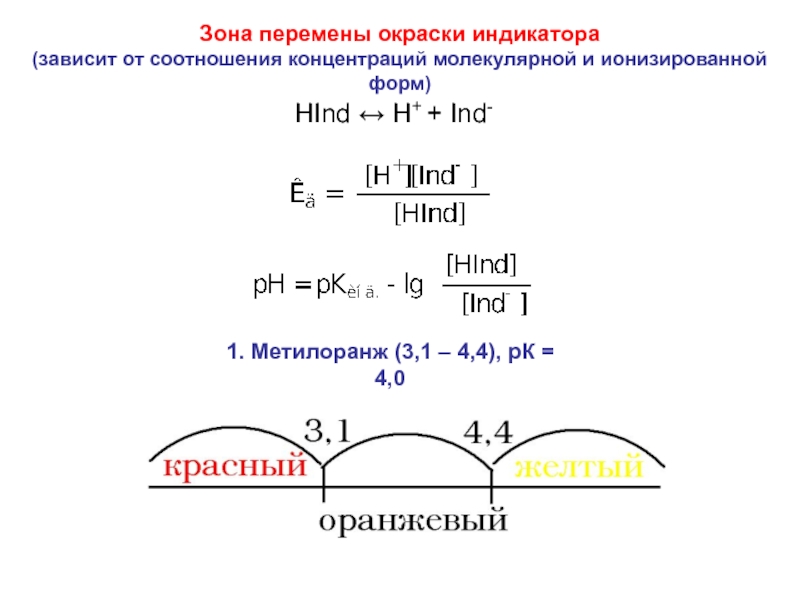
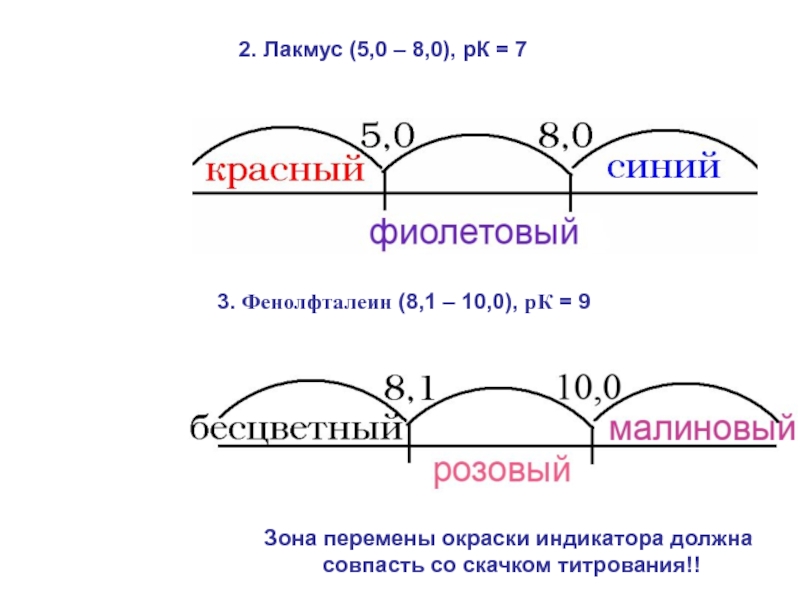
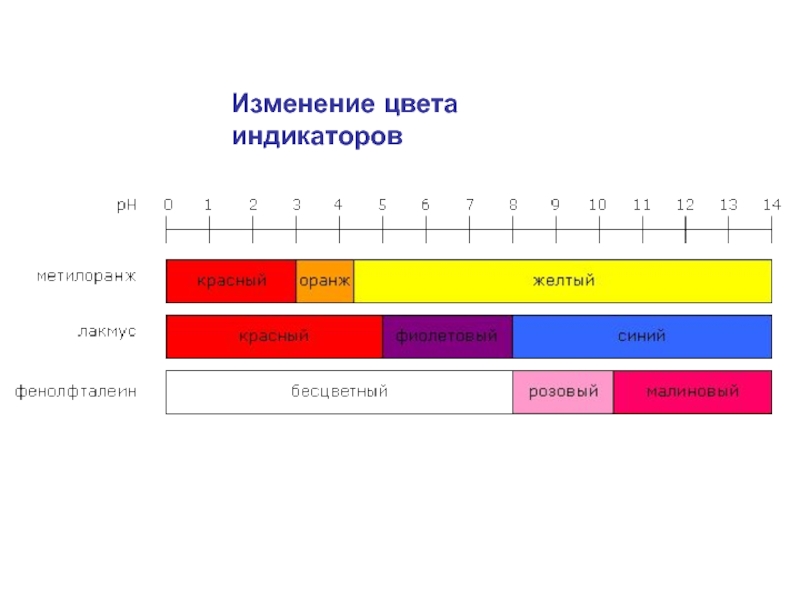
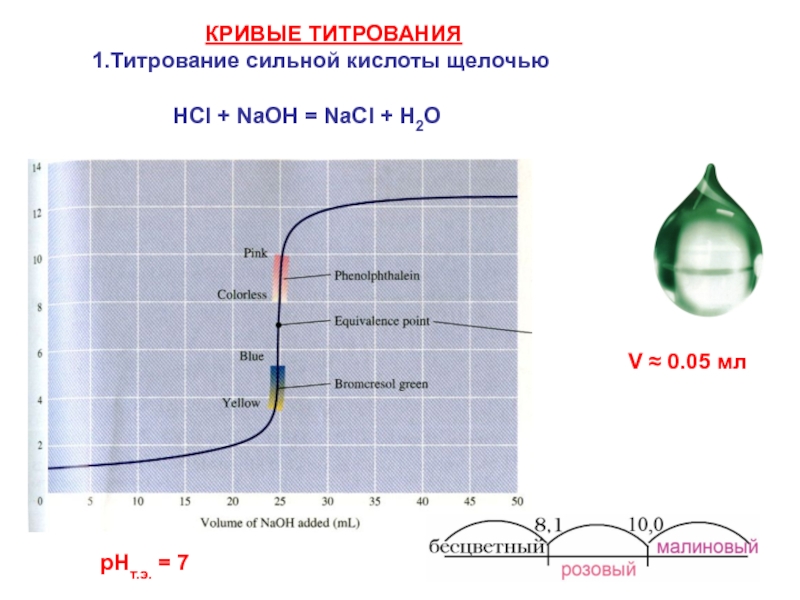
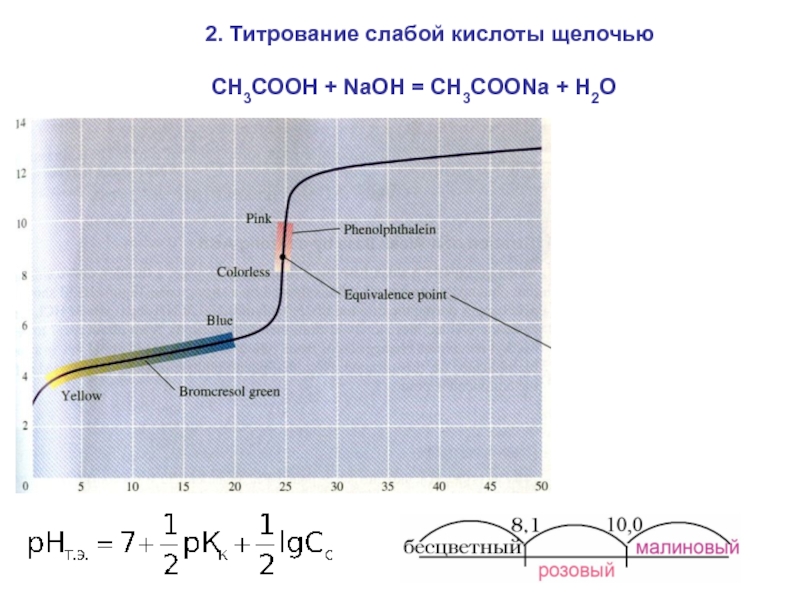
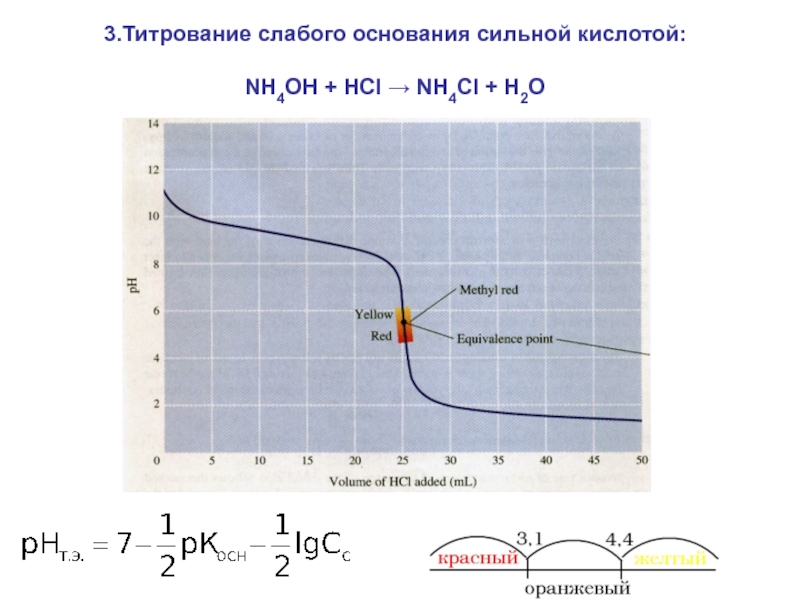
= Н2О
2. Окислительно-восстановительные
I2 + 2ē = 2I-
MnO4- + 8H+
+ 5ē = Mn2+ + 4Н2О3. Комплексообразования
Ag+ + 2CN- → [Ag(CN)2]-
4. Осаждения
Ag+ + Cl- = AgCl↓
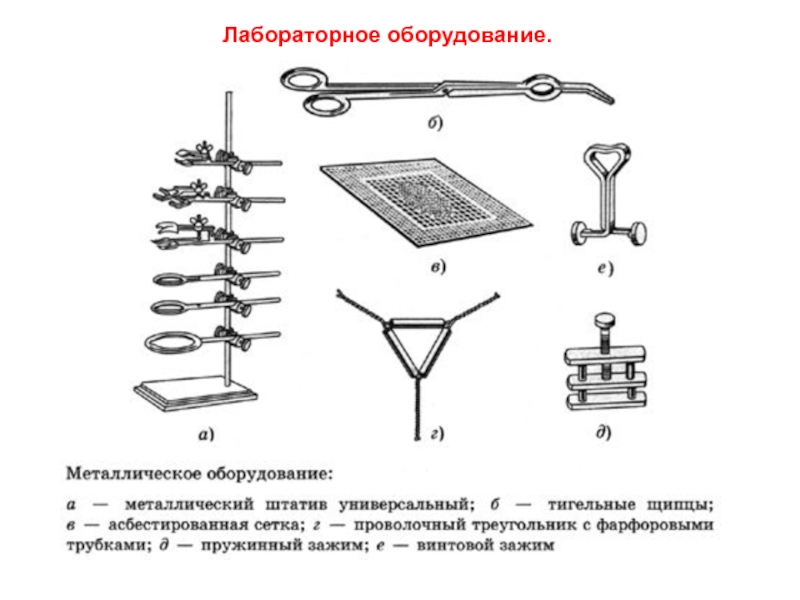
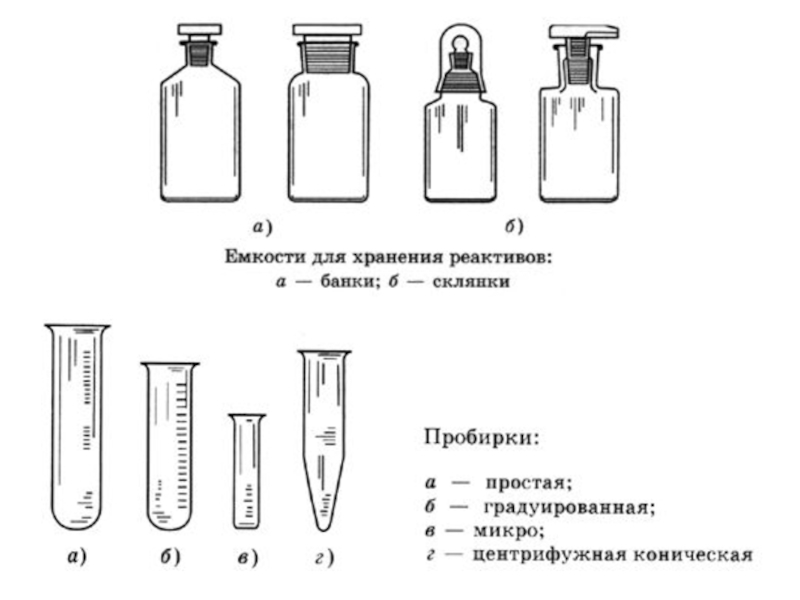
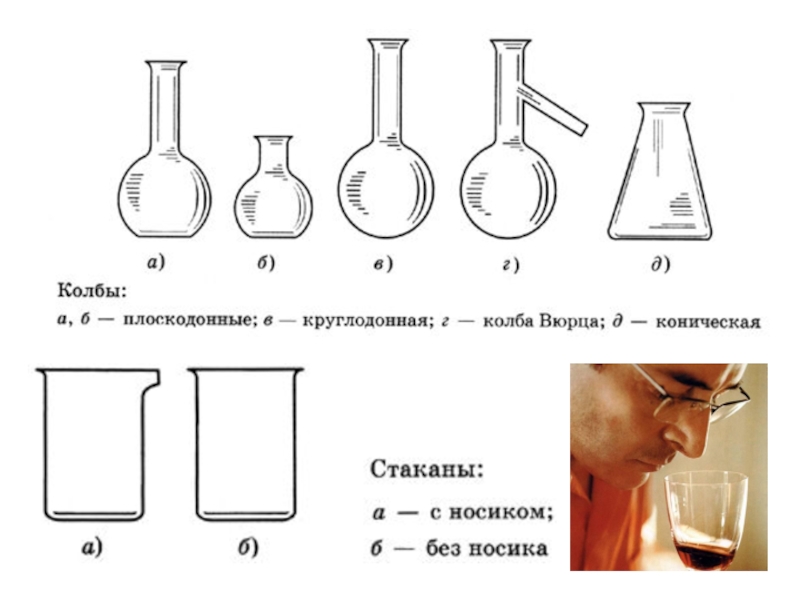
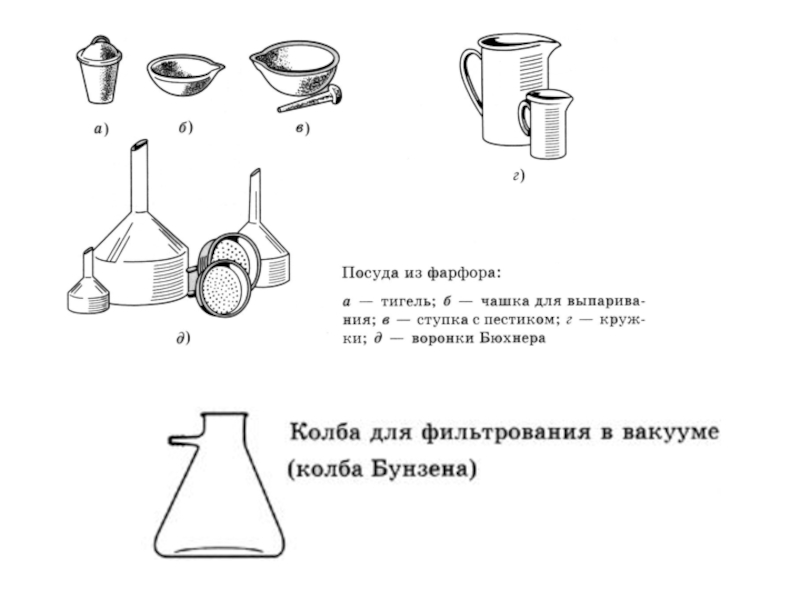
ОСНОВНЫЕ МЕТОДЫ АНАЛИЗА: