Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амфотерные органические и неорганические соединения
Содержание
- 1. Амфотерные органические и неорганические соединения
- 2. Определение Амфотерность (переменность) – проявление химическим соединением
- 3. Амфотерными называются соединения
- 4. Амфотерность в свойствах проявляют оксиды металлов и
- 5. Классификация оксидов и гидроксидов неорганических веществ
- 6. Амфотерные соединения : оксиды и
- 7. Амфотерные оксиды и гидроксиды некоторых элементовH3ЭО3
- 8. Типичным амфотерным соединением является вода,
- 9. Некоторые оксиды и гидроксиды с кислотно-основными свойствам
- 10. Типичным
- 11. AlCl3 + 3NH3 * H2O = Al(OH)3
- 12. Слайд 12
- 13. При сплавлении
- 14. В растворахКомплексная соль - тетрагидроксоалюминат натрия
- 15. Соли анионного типа (комплексные соли) устойчивы в
- 16. В органической химии
- 17. Структурная формулаАминогруппа - акцептор Н+ (определяет основные свойства)Карбоксильная группа – донор Н+ - (определяет кислотные свойства)
- 18. Химические свойстваКислотные свойства - взаимодействие с металлами, основными оксидами, основаниями, солями , спиртами:
- 19. Основные свойства – взаимодействие с кислотами, с азотистой кислотой, комплексообразование, алкилирование:Химические свойства
- 20. Подобно первичным аминам, аминокислоты реагируют с азотистой
- 21. При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.Химические свойства
- 22. Реакции с одновременным участием карбоксильной и аминогрупп
- 23. Химические свойстваАминокислоты содержат кислотный и основный центры
- 24. Форма существования аминокислот в водных растворах зависит
- 25. a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.Химические свойства
- 26. γ, δ, ε - Аминокислоты претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамовХимические свойства
- 27. Аминокислоты вступают в реакцию поликонденсации (линейная дегидратация)
- 28. Часть 2Задание 1. Установите соответствие между реагирующими
- 29. Задание 2. Установите соответствие между реагирующими веществами
- 30. Задание 3. Установите соответствие между реагирующими
- 31. Задание 4. Установите соответствие между реагирующими веществами
- 32. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Определение
Амфотерность (переменность) – проявление химическим соединением кислотных или основных
Слайд 3
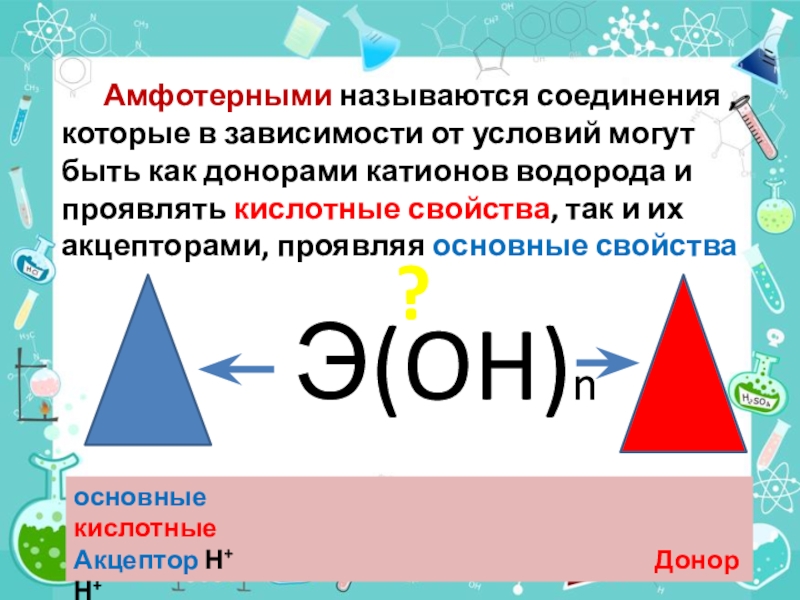
Амфотерными называются соединения , которые в
зависимости от условий могут быть как донорами катионов водорода и
проявлять кислотные свойства, так и их акцепторами, проявляя основные свойства Э(OH)n
?
основные кислотные
Акцептор Н+ Донор Н+
Слайд 4
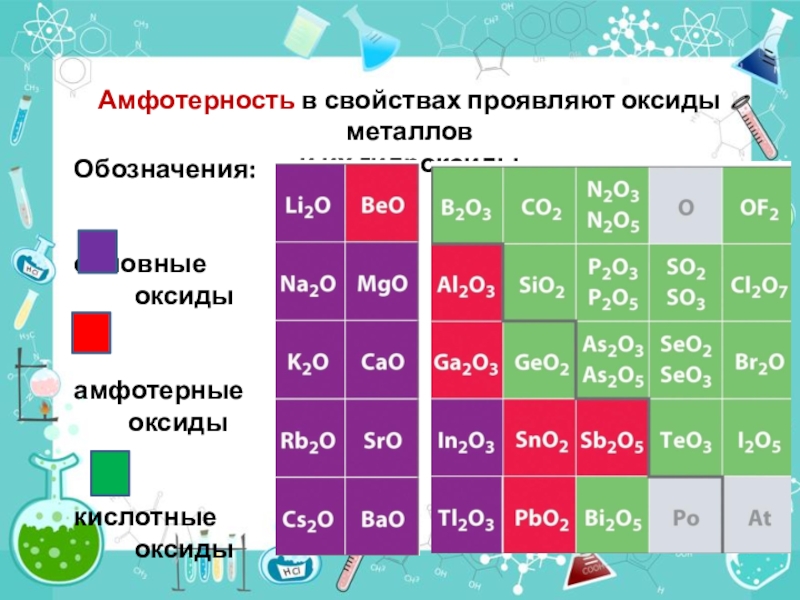
Амфотерность в свойствах проявляют оксиды металлов
и их гидроксиды
Обозначения:
основные
оксидыамфотерные
оксиды
кислотные
оксиды
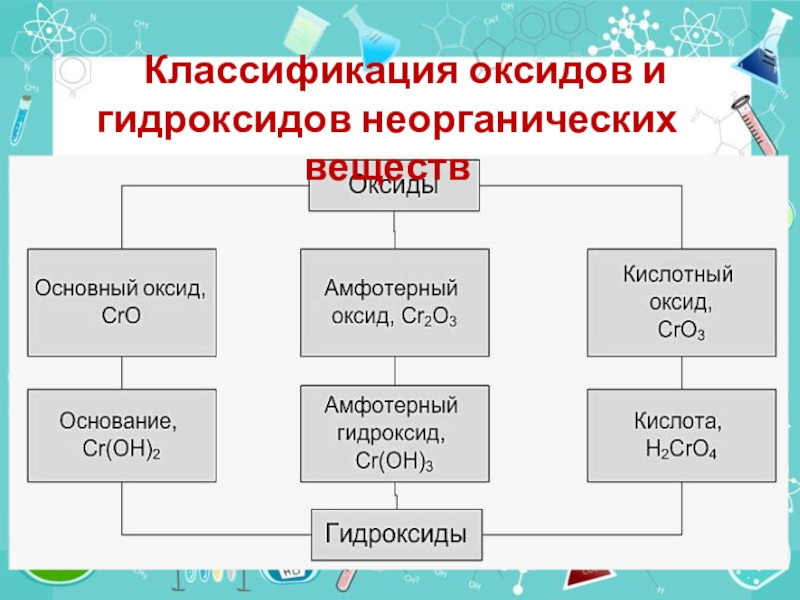
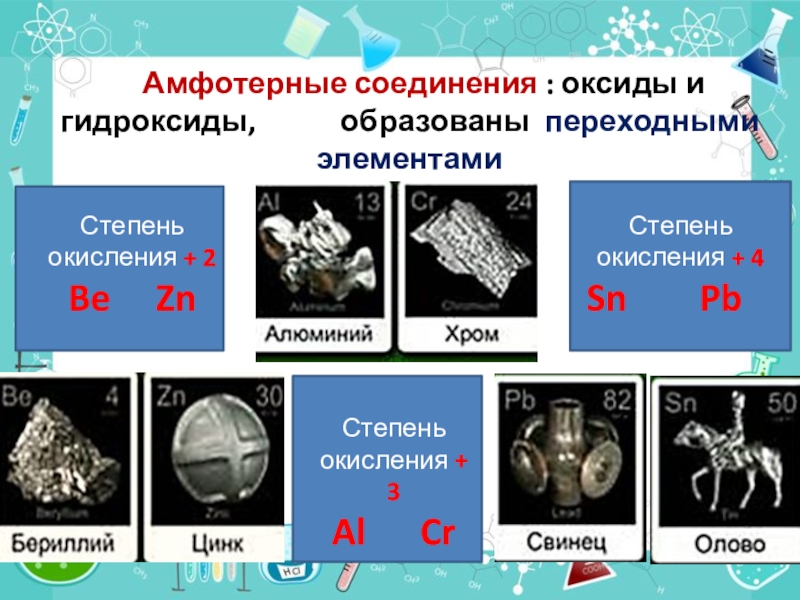
Слайд 6 Амфотерные соединения : оксиды и гидроксиды,
образованы переходными элементами
Степень окисления + 2
Be
Zn
Степень окисления + 3
Al Cr
Степень окисления + 4
Sn Pb
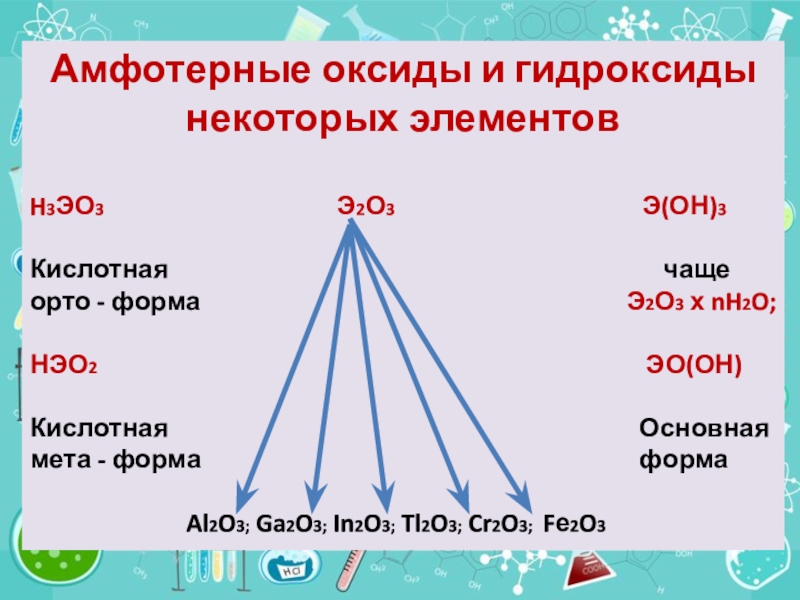
Слайд 7Амфотерные оксиды и гидроксиды некоторых элементов
H3ЭО3
Э2О3 Э(ОН)3
Кислотная чаще
орто - форма Э2О3 х nH2O;
НЭО2 ЭО(ОН)
Кислотная Основная
мета - форма форма
Al2O3; Ga2O3; In2O3; Tl2O3; Cr2O3; Fе2O3
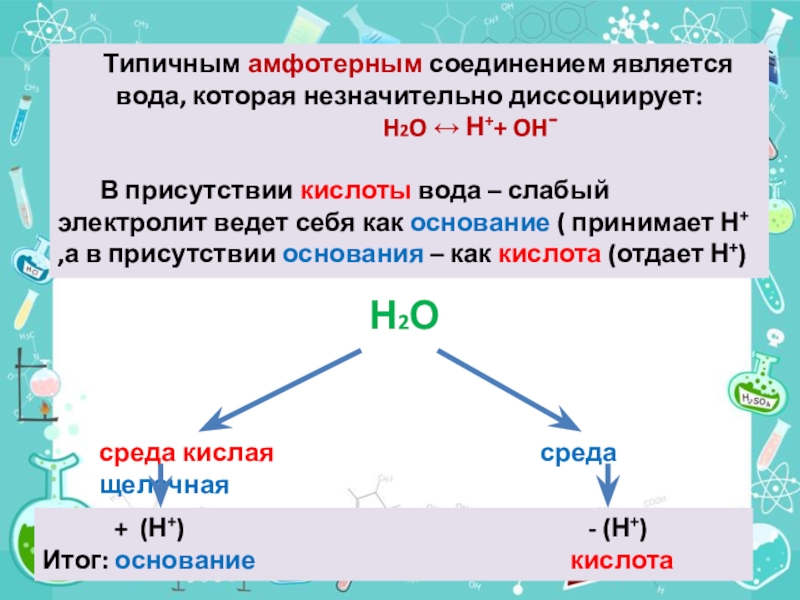
Слайд 8 Типичным амфотерным соединением является вода, которая незначительно диссоциирует:
H2O ↔ Н++ OH¯
В присутствии кислоты вода – слабый электролит ведет себя как основание ( принимает Н+ ,а в присутствии основания – как кислота (отдает Н+)
Н2О
среда кислая среда щелочная
+ (Н+) - (Н+)
Итог: основание кислота
Слайд 10 Типичным амфотерным гидроксидом является
Al(OH)3 (гидроксид алюминия)
При взаимодействии с кислотами образует соли, содержащие катионы
алюминия.В кислой среде – ион Аl3+
При взаимодействии с растворами щелочей (взятыми в избытке) образуют алюминаты, т.е. соли, в которых алюминий входит в состав аниона.
В щелочной среде – однозарядный анион
Слайд 11AlCl3 + 3NH3 * H2O = Al(OH)3 + 3NH4Cl
Вывод: гидроксид
алюминия взаимодействует и с кислотами, и с основаниями, т.е. проявляет
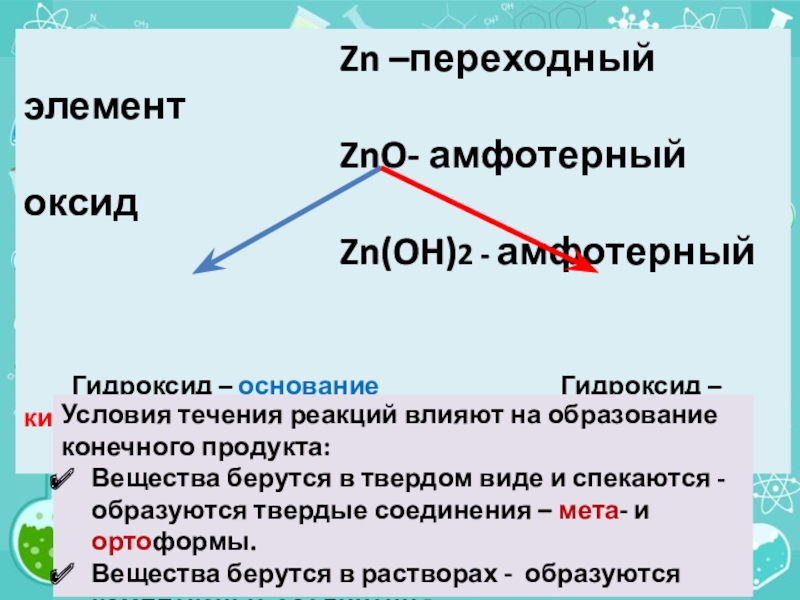
амфотерные свойстваСлайд 12
Zn –переходный
элементZnO- амфотерный оксид
Zn(OH)2 - амфотерный
Гидроксид – основание Гидроксид – кислота
Zn(OH)2 H2ZnO2
Условия течения реакций влияют на образование конечного продукта:
Вещества берутся в твердом виде и спекаются - образуются твердые соединения – мета- и ортоформы.
Вещества берутся в растворах - образуются комплексные соединения.
Слайд 15Соли анионного типа (комплексные соли) устойчивы в щелочной среде, но
разрушаются:
а) при подкислении растворов
Na[Al(OH)4]+4HCl (изб.) = NaCl + AlCl3+4H2O
Na[Al(OH)4] +
HCl (нед.) = NaCl + Al(ОН)3 + H2Oб) при пропускании через них газов
Na[Al(OH)4] + СО2 = NaНСО3 + Al(ОН)3
б) при нагревании
Na[Al(OH)4] NaАlО2 + 2Н2О
Слайд 16 В органической химии типичными амфотерными соединениями
являются аминокислоты
триптофан изолейцин тирозин
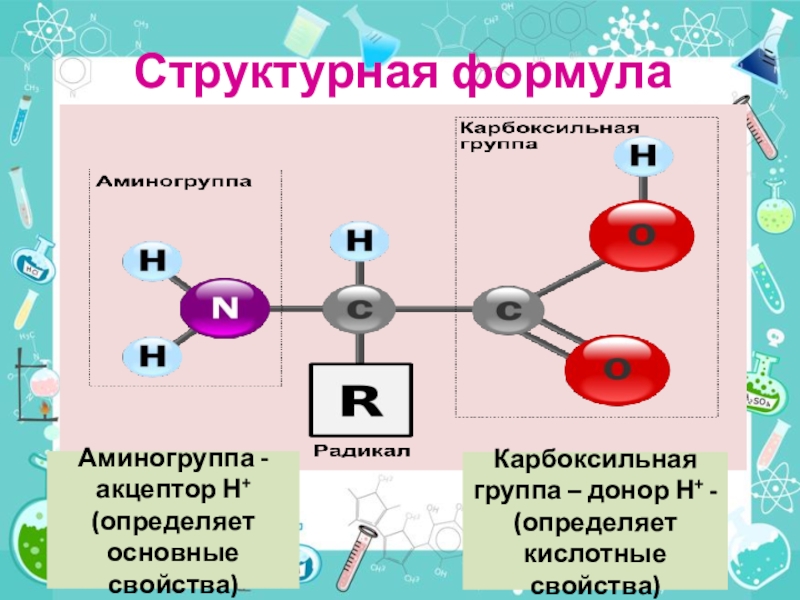
Слайд 17Структурная формула
Аминогруппа - акцептор Н+ (определяет основные свойства)
Карбоксильная группа –
донор Н+ - (определяет кислотные свойства)
Слайд 18Химические свойства
Кислотные свойства - взаимодействие с металлами, основными оксидами, основаниями,
солями , спиртами:
Слайд 19Основные свойства – взаимодействие с кислотами, с азотистой кислотой, комплексообразование,
алкилирование:
Химические свойства
Слайд 20Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом
аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
Химические свойства
Слайд 21При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы
и образуются внутренние соли.
Химические свойства
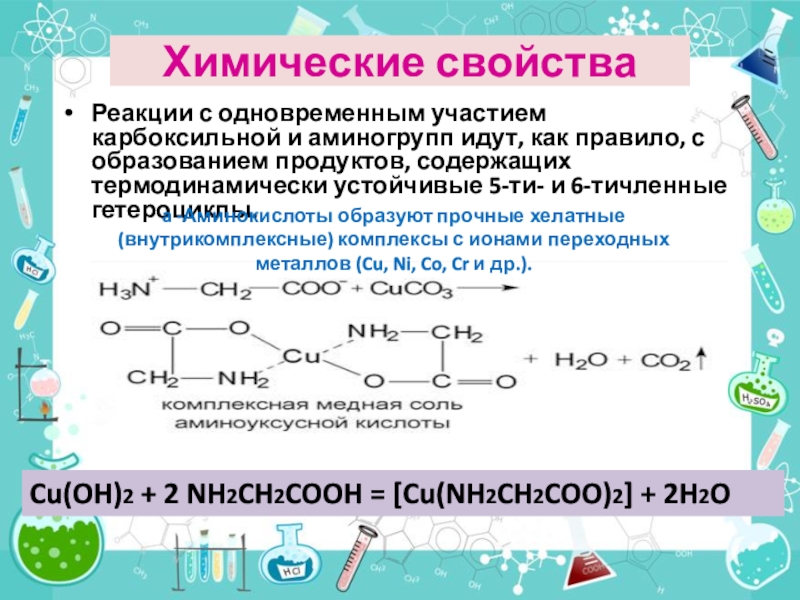
Слайд 22Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило,
с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
a
-Аминокислоты образуют прочные хелатные (внутрикомплексные) комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).Химические свойства
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2H2O
Слайд 23Химические свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными
соединениями. В кристаллическом состоянии они существуют в виде внутренних солей
(биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого кислотного центра (СОО-) к более сильному основному центру (NH2)Слайд 24Форма существования аминокислот в водных растворах зависит от рН. В
кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде
катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.Химические свойства
Слайд 25a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются
циклические амиды – дикетопиперазины.
Химические свойства
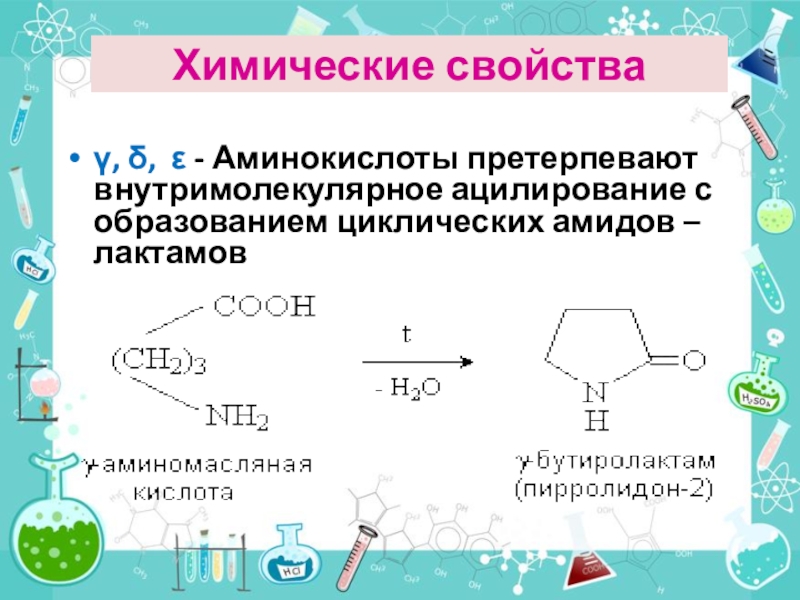
Слайд 26γ, δ, ε - Аминокислоты претерпевают внутримолекулярное ацилирование с образованием
циклических амидов – лактамов
Химические свойства
Слайд 27Аминокислоты вступают в реакцию поликонденсации (линейная дегидратация) с образованием пептидов.
Пептиды – это полиамиды, построенные из a -аминокислот. По числу
аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.Химические свойства
Слайд 28Часть 2
Задание 1. Установите соответствие между реагирующими веществами и продуктами
их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯА. Zn(OH)2+KOH сплав 1). Zn(NO3)2
Б. Zn(OH)2+KOH р-р 2). Zn(NO3)2+H2O
В. Zn(OH)2+HNO3 3). K2ZnO2+H2O
Г. Zn(OH)2 нагрев 4). K2[Zn(OH)4]
5). ZnO+ H2
6). ZnO+ H2O
Слайд 29Задание 2. Установите соответствие между реагирующими веществами и продуктами их
взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯА. Al2O3 + NaOH сплав 1). NaAlO2
Б. Al2O3 + NaOH + H2O 2).NaAlO2+H2O
В. Al2O3 + Na2CO3 сплав 3). NaAlO2+CO2
Г. Al2O3+HCl 4). AlCl3+H2O
5). Na[Al(OH)4]
6). AlCl3+H2
Слайд 30 Задание 3. Установите соответствие между реагирующими веществами и продуктами
их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯА. Al(OH)3+Rb(OH) р-р 1). RbAlO2
Б. Al(OH)3+Rb2О сплав 2).Rb3[Al(OH)6]
В. Al(OH)3+CsOH сплав 3). CsAlO2
Г. Al(OH)3+Cs2СО3 сплав 4).Cs3[Al(OH)6]
5). Rb3AlO3
Слайд 31Задание 4. Установите соответствие между реагирующими веществами и продуктами их
взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯА. Be(OH)2+NaOH (t,спл) 1). BeSO3+H2
Б. Be(OH)2+NaOH р-р 2). BeSO3+H2O
В. Be(OH)2+SO3 3). Na2[Be(OH)4]
Г. Be(OH)2+ SO2 4). BeSO4+ H2O
5). Na2BeO2+ H2
6). Na2BeO2+ H2O







![Амфотерные органические и неорганические соединения Соли анионного типа (комплексные соли) устойчивы в щелочной среде, но разрушаются: Соли анионного типа (комплексные соли) устойчивы в щелочной среде, но разрушаются: а) при подкислении растворовNa[Al(OH)4]+4HCl (изб.) =](/img/tmb/6/588435/e7af4effa25c46cbfb457c70c8d31d99-800x.jpg)