Слайд 2 Дисперсными называют гетерогенные системы , в которых одно
вещество в виде очень мелких частиц равномерно распределено в объеме
другого
То вещество , которое в меньшем количестве и распределено в массе другого, называют дисперсной фазой
Вещество присутствующее в большем количестве , в объеме которого распределена дисперсная фаза, называется дисперсионной средой
Слайд 3Классификация по степени дисперсности (или размеру частиц )
Слайд 4Суспензии – это грубодисперсные системы, в которых дисперсная фаза состоит
из твердых частиц, взвешенных в жидкой среде. Для получения стабильной
суспензии вводят подходящий стабилизатор – различные поверхностно-активные вещества (ПАВ).
Эмульсии – это грубодисперсные системы, которые состоят из двух несмешивающихся жидкостей. В качестве стабилизатора используют эмульгаторы: органические кислоты, спирты и др. ПАВ.
Пены – это грубодисперсные системы газов (или воздуха) в жидкости. В качестве стабилизатора применяют пенообразователи: мыло, органические кислоты, спирты и др. ПАВ.
Аэрозоли- взвеси в газе мелких частиц жидкости или твердых веществ.
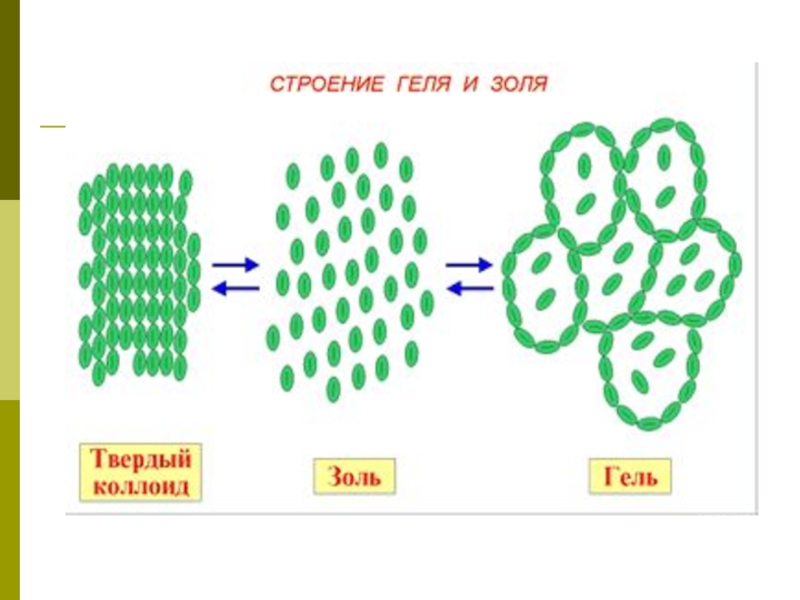
Слайд 5Коллоидные системы- это такие дисперсные системы, в которых размер частиц
фазы от 100 до 1 нм
Коллоидные растворы, или золи.
Это большинство жидкостей живой клетки (цитоплазма) и живого организма в целом (кровь, лимфа). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Гели или студни. Представляют собой студенистые осадки, образующиеся при коагуляции золей.
Это кондитерские, косметические и медицинские гели ( желатин, холодец, желе, мармелад, торт « Птичье молоко») , а также природные гели: минералы( опал), тела медуз, хрящи, сухожилия, мышечная и нервная ткани
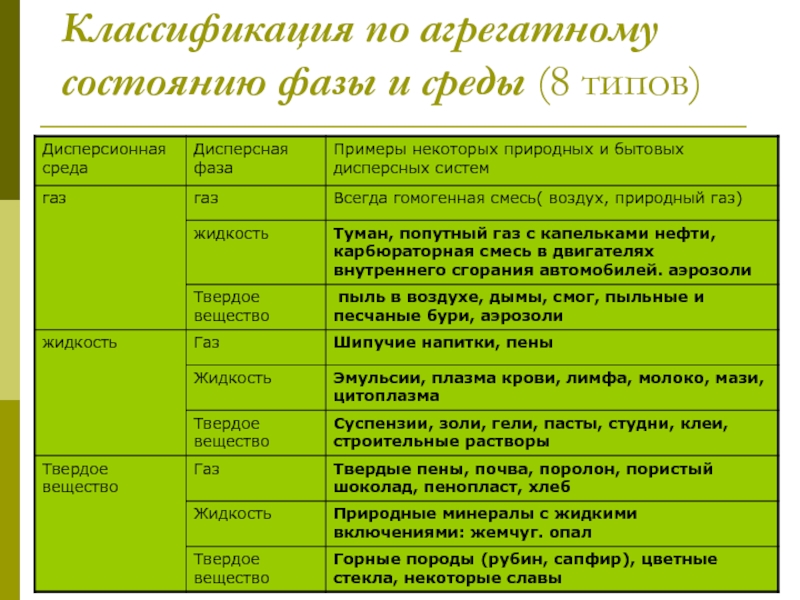
Слайд 7Классификация по агрегатному состоянию фазы и среды (8 типов)
Слайд 8Дисперсионные методы получения коллоидных систем
механические – дробление, растирание, размол и
т. д.;
электрический – получение золей металлов под действием силы
тока 5-10 A и напряжении 100 B в присутствии соответствующих стабилизаторов;
ультразвуковой – дробление ультразвуком (например, камней в почках);
химического диспергирования (пептизация и получение растворов ВМС из твердого полимера: набухание крахмала, желатина, агара-агара в воде).
Слайд 9Конденсационные методы
физические: резкое охлаждение (образование тумана);
замена лучшего растворителя на
худший (раствор мыла в спирте – истинный раствор, а в
воде – пена);
выпаривание, т.е. снижение концентрации дисперсионной среды (раствор желатина до 0,9 % – истинный раствор, а больше 1 % – коллоидный)
Слайд 10Химические способы
проведение таких химических реакций, как окисление:
2H2S + O2
2H2O + 2S (золь серы),
восстановление:
2HAuCl4 + 2H2O2
2Au + 8HCl + 3O2
(золь золота)
обмена:
AgNO3 + KCl AgCl+ KNO3,
гидролиза:
FeCl3 + 3H2O Fe(OH)3 + 3HCl.
Слайд 11Теория Думанского и Пескова
Коллоидный раствор состоит из мицелл (твердая или
дисперсная фаза) и
Интермицеллярной жидкости, которая содержит растворенные в
ней электролиты и неэлектролиты (дисперсионная среда).
Мицелла – это электрически нейтральная структурная единица коллоидного раствора.
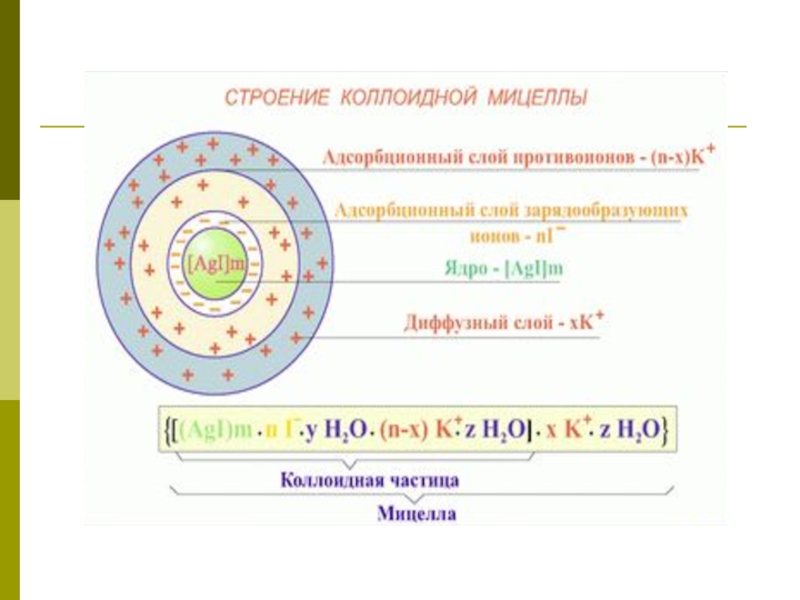
Слайд 13Схема мицеллы
{mCuS nCu 2+ (n - х)SO42- }2х+ хSO42-
ПОИ
ПИ ДС
__________ ________________
ядро АС
_____________________
коллоидная частица (гранула)
__________________________________
мицелла
Слайд 14
(mCuS) –это агрегат, на поверхности которого, согласно правилу
Фаянса-Пескова:
Из дисперсионной среды адсорбируются те ионы стабилизатора (вещества в
избытке), которые входят в состав золя, то есть Cu2+, в количестве n.
Эти ионы называются потенциалопределяющими ионами (ПОИ). Золь и ПОИ образуют ядро.
Слайд 15Затем адсорбируются противоионы (ПИ), в данном случае SO42- в количестве
(n – х).
Ядро и ПИ образуют гранулу или коллоидную
частицу, имеющую заряд ПОИ, в данном ионы случае это 2х+.
На поверхности гранулы адсорбируются ПИ SO42- в количестве х, создавая так называемый диффузный слой (ДС), или подвижный слой ионов.
Слой ПИ и ДС представляют собой адсорбционный слой (АС). Все вместе это называется мицеллой золя.
Некоторые коллоидные системы проявляют большое сродство к молекулам воды Н2О и имеют гидратную оболочку.
Слайд 16Устойчивость коллоидных растворов.
Агрегативная устойчивость - сохранение размеров частиц.
Седиментационная устойчивость
– равномерное распределение частиц по всему объему.
Процесс слияния мицелл в
более крупные агрегаты называется коагуляцией (Т, излучение, электролиты)происходит в 2 стадии.
Слайд 17Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а
только тот его ион, который противоположен по заряду гранулы. Причем
чем выше заряд коагулирующего иона, тем меньше этого вещества необходимо для коагуляции.
Устойчивость повышается за счет проведения диализа- процесса очистки дисперсионной среды от примесей.
Процесс обратный коагуляции – пептизация.
Слайд 18Коллоидные растворы в природе и технике.
В природной воде содержится
часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных
нужд, электростанций, строительства подвергают обработке, вызывающей коагуляцию коллоидных частиц. Дымовые газы электростанций, металлургических заводов и других предприятий представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях поля.
Слайд 19Применение
Можно разделить коллоидные частицы и ионы через мембрану, проницаемую для
молекул и ионов и непроницаемую для коллоидных частиц. Такой метод
разделения называется диализом. Он, например, лежит в основе аппарата «искусственная почка».
Слайд 20В коллоидном состоянии находятся многие составные части живых организмов: кровь,
лимфа, внутриклеточная жидкость. Поэтому для лечения некоторых болезней широко используется
введение в организм лекарств методом электрофореза.